Reacción aldólica
La reacción aldólica (adición de aldol) es una reacción que combina dos compuestos carbonílicos (aldehídos o cetonas) para formar un nuevo compuesto β-hidroxicarbonilo.

Estos productos se conocen como aldols, del aldehído + alcoholol, un motivo estructural que se ve en muchos de los productos. El uso de aldehído en el nombre proviene de su historia de descubrimiento, donde se usaron por primera vez aldehídos en la reacción y no cetonas.
Las unidades estructurales aldólicas se encuentran en muchas moléculas importantes, ya sean naturales o sintéticas. La reacción aldólica es un medio común para formar enlaces carbono-carbono en química orgánica.
La reacción se utiliza en varias síntesis industriales, en particular de pentaeritritol, trimetilolpropano, el plastificante 2-etilhexanol y el fármaco Lipitor (atorvastatina, sal de calcio). Para muchas de las aplicaciones de productos básicos, la estereoquímica de la reacción aldólica no es importante, pero el tema es de gran interés para la síntesis de muchos productos químicos especializados.
Estereoquímica
La reacción aldólica une dos moléculas relativamente simples en una más compleja. Surge una mayor complejidad porque se forman hasta dos nuevos centros estereogénicos (en los carbonos α y β del aducto aldólico, marcados con asteriscos en el esquema siguiente). La metodología moderna es capaz no sólo de permitir que las reacciones aldólicas se desarrollen con alto rendimiento sino también de controlar la configuración relativa y absoluta de estos estereocentros. Esta capacidad de sintetizar selectivamente un estereoisómero particular es importante porque los estereoisómeros pueden tener propiedades químicas y biológicas distintivas.
Por ejemplo, las unidades aldol estereogénicas son especialmente comunes en los policétidos, una clase de moléculas que se encuentran en los organismos biológicos. En la naturaleza, los policétidos son sintetizados por enzimas que efectúan condensaciones iterativas de Claisen. Los productos 1,3-dicarbonilo de estas reacciones pueden derivatizarse de diversas formas para producir una amplia variedad de estructuras interesantes. A menudo, dicha derivatización implica la reducción de uno de los grupos carbonilo, produciendo la subunidad aldólica. Algunas de estas estructuras tienen potentes propiedades biológicas: el inmunosupresor FK506, el agente antitumoral discodermolida o el agente antifúngico anfotericina B, por ejemplo. Aunque la síntesis de muchos de estos compuestos alguna vez se consideró casi imposible, la metodología aldólica ha permitido su síntesis eficiente en muchos casos.

Una reacción de adición de aldólico moderna típica, que se muestra arriba en la parte superior, podría implicar la adición nucleofílica de un enolato de cetona a un aldehído. Una vez formado, el producto aldólico a veces puede perder una molécula de agua para formar un compuesto carbonílico α,β-insaturado. Esto se llama condensación aldólica. En la reacción aldólica se pueden emplear diversos nucleófilos, incluidos los enoles, enolatos y éteres enólicos de cetonas, aldehídos y muchos otros compuestos carbonílicos. El compañero electrofílico suele ser un aldehído o una cetona (existen muchas variaciones, como la reacción de Mannich). Cuando el nucleófilo y el electrófilo son diferentes, la reacción se denomina reacción aldólica cruzada; por el contrario, cuando el nucleófilo y el electrófilo son iguales, la reacción se denomina dimerización aldólica.

El frasco de la derecha es una solución de litio diisopropylamida (LDA) en tetrahidrofuran (THF). El frasco a la izquierda es una solución del enolato de litio ter-butyl propionate (formed by addition of LDA to ter-butyl propionate). Un aldehído se puede añadir al frasco enolatado para iniciar una reacción adicional aldol.
Ambos frascos se sumergen en un baño de refrigeración de hielo seco/acetona (78 °C) cuya temperatura está siendo monitoreada por un termopar (el alambre de la izquierda).
Mecanismos
La reacción aldólica puede proceder mediante dos mecanismos distintos. Los compuestos carbonílicos, como los aldehídos y las cetonas, se pueden convertir en enoles o éteres enólicos. Estas especies, al ser nucleófilas en el carbono α, pueden atacar carbonilos protonados especialmente reactivos, como los aldehídos protonados. Este es el "mecanismo enol". Los compuestos carbonílicos, al ser ácidos carbónicos, también pueden desprotonarse para formar enolatos, que son mucho más nucleofílicos que los enoles o los éteres enólicos y pueden atacar directamente a los electrófilos. El electrófilo habitual es un aldehído, ya que las cetonas son mucho menos reactivas. Este es el "mecanismo enolato".
A pesar del atractivo de la variedad aldólica, hay varios problemas que deben abordarse para que el proceso sea catalítico y eficaz. El primer problema es termodinámico: la mayoría de las reacciones aldólicas son reversibles. Además, en el caso de reacciones simples aldehído-cetona aldólica, el equilibrio también está ligeramente del lado de los productos. Si las condiciones son particularmente duras (p. ej.: NaOMe/MeOH/reflujo), puede producirse condensación, pero esto normalmente se puede evitar con reactivos suaves y bajas temperaturas (p. ej., LDA (una base fuerte), THF, −78 °C). Aunque la adición aldólica generalmente avanza hasta casi completarse en condiciones irreversibles, los aductos aldólicos aislados son sensibles a la escisión retroaldólica inducida por bases para devolver los materiales de partida. Por el contrario, las condensaciones retroaldólicas son raras, pero posibles. Ésta es la base de la estrategia catalítica de las aldolasas de clase I en la naturaleza, así como de numerosos catalizadores de aminas de molécula pequeña.

Mecanismo de enolato
Si el catalizador es una base moderada como un ion hidróxido o un alcóxido, la reacción aldólica se produce mediante un ataque nucleofílico por parte del enolato estabilizado por resonancia sobre el grupo carbonilo de otra molécula. El producto es la sal alcóxido del producto aldólico. Luego se forma el propio aldol, que luego puede sufrir deshidratación para dar el compuesto carbonílico insaturado. El esquema muestra un mecanismo simple para la reacción aldólica catalizada por bases de un aldehído consigo mismo.
Reacción aldólica catalizada por bases

Aunque en algunos casos solo se requiere una cantidad catalítica de base, el procedimiento más habitual es utilizar una cantidad estequiométrica de una base fuerte como LDA o NaHMDS. En este caso, la formación de enolato es irreversible y el producto aldólico no se forma hasta que el alcóxido metálico del producto aldólico se protona en una etapa de procesamiento separada.
Mecanismo enol
Cuando se utiliza un catalizador ácido, el paso inicial en el mecanismo de reacción implica la tautomerización catalizada por ácido del compuesto carbonílico al enol. El ácido también sirve para activar el grupo carbonilo de otra molécula mediante protonación, volviéndolo altamente electrófilo. El enol es nucleofílico en el carbono α, lo que le permite atacar el compuesto carbonílico protonado, dando lugar al aldol después de la desprotonación. Algunos también pueden deshidratarse más allá del producto deseado para dar el compuesto carbonílico insaturado mediante condensación aldólica.
Mecanismo aldólico catalizado por ácido

Modelo Zimmerman-Traxler
Se conocen formas más refinadas del mecanismo. En 1957, Howard Zimmerman y Marjorie D. Traxler propusieron que algunas reacciones aldólicas tienen "estados de transición de seis miembros que tienen una conformación de silla". Esto se conoce ahora como el modelo Zimmerman-Traxler. Los enolatos E dan lugar a productos anti, mientras que los enolatos Z dan lugar a productos syn. Los factores que controlan la selectividad son la preferencia por colocar sustituyentes ecuatorialmente en estados de transición de seis miembros y evitar interacciones sin-pentano, respectivamente. E y Z se refieren a la relación estereoquímica cis-trans entre el oxígeno enolato que lleva el contraión positivo y el grupo de mayor prioridad en el carbono alfa. En realidad, sólo algunos metales, como el litio, siguen de forma fiable el modelo de Zimmerman-Traxler. Por tanto, en algunos casos, el resultado estereoquímico de la reacción puede ser impredecible.

Control de reactivos aldólicos cruzados
Cuando se hace reaccionar una mezcla de cetonas asimétricas, se pueden anticipar cuatro productos de aldólico cruzado (adición):

Por lo tanto, si se desea obtener solo uno de los productos cruzados, se debe controlar qué carbonilo se convierte en enol/enolato nucleófilo y cuál permanece en su forma de carbonilo electrófilo. El control más simple es si solo uno de los reactivos tiene protones ácidos y solo esta molécula forma el enolato. Por ejemplo, la adición de malonato de dietilo al benzaldehído produce un solo producto:

Si un grupo es considerablemente más ácido que el otro, la base extrae el protón más ácido y se forma un enolato en ese carbonilo, mientras que el carbonilo que es menos ácido no se ve afectado por la base. Este tipo de control funciona sólo si la diferencia de acidez es lo suficientemente grande y no se utiliza exceso de base para la reacción. Un sustrato típico para esta situación es cuando la posición desprotonable es activada por más de un grupo tipo carbonilo. Los ejemplos comunes incluyen un grupo CH2 flanqueado por dos carbonilos o nitrilos (ver, por ejemplo, la condensación de Knoevenagel y los primeros pasos de la síntesis de éster malónico y la síntesis de éster acetoacético).
Una solución común es formar primero el enolato de un socio y luego agregar el otro socio bajo control cinético. El control cinético significa que la reacción de adición aldólica directa debe ser significativamente más rápida que la reacción retroaldólica inversa. Para que este enfoque tenga éxito, también deben cumplirse otras dos condiciones; debe ser posible formar cuantitativamente el enolato de un socio, y la reacción aldólica directa debe ser significativamente más rápida que la transferencia del enolato de un socio a otro. Las condiciones de control cinético comunes implican la formación del enolato de una cetona con LDA a -78 °C, seguida de la adición lenta de un aldehído.
Estereoselectividad
La reacción aldólica es particularmente útil porque en una reacción se generan dos nuevos centros estereogénicos. La convención syn/anti se usa comúnmente para indicar la estereoquímica relativa en los carbonos α y β.

La convención se aplica cuando se añaden nucleófilos de propionato (o de orden superior) a los aldehídos. El grupo R de la cetona y el grupo R' del aldehído están alineados en un "zig zag" patrón en el plano del papel (o pantalla), y la disposición de los estereocentros formados se considera syn o anti, dependiendo de si están en el mismo o en lados opuestos de la cadena principal.
Los artículos más antiguos utilizan la nomenclatura eritro/treo familiar de la química de los sacáridos.
Geometría enolada
No existe una diferencia significativa entre el nivel de estereoinducción observado con los enolatos E y Z. Cada geometría de alqueno conduce principalmente a una estereoquímica relativa específica en el producto, E da anti y Z da syn:

Iones metálicos
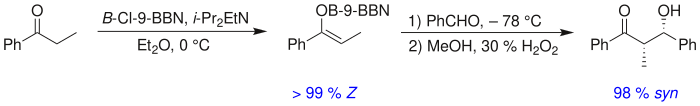
El catión metálico enolato puede desempeñar un papel importante en la determinación del nivel de estereoselectividad en la reacción aldólica. El boro se utiliza a menudo porque la longitud de sus enlaces es significativamente más corta que la de metales como el litio, el aluminio o el magnesio.

Por ejemplo, los enlaces boro-carbono y boro-oxígeno tienen una longitud de 1,4–1,5 Å y 1,5–1,6 Å, respectivamente, mientras que los enlaces típicos metal-carbono y metal-oxígeno tienen una longitud de 1,9–2,2 Å y 2,0–2,2 Å. longitud, respectivamente. El uso de boro en lugar de metal "aprieta" la calidad del aire. el estado de transición y da una mayor estereoselectividad en la reacción. Por lo tanto, la reacción anterior da una proporción syn:anti de 80:20 usando un enolato de litio en comparación con 97:3 usando un enolato de bibutilboro.
Estereocentro alfa en el enolato
La reacción aldólica puede exhibir un "estereocontrol basado en sustrato", en el que la quiralidad existente en cualquiera de los reactivos influye en el resultado estereoquímico de la reacción. Esto se ha estudiado ampliamente y, en muchos casos, se puede predecir la sensación de inducción asimétrica, si no el nivel absoluto de diastereoselectividad. Si el enolato contiene un estereocentro en posición alfa, se puede lograr un excelente estereocontrol.

En el caso de un enolato E, el elemento de control dominante es la cepa alílica 1,3, mientras que en el caso de un enolato Z, el elemento de control dominante es evitar las interacciones 1,3-diaxiales. El modelo general se presenta a continuación:

Para mayor claridad, se ha epimerizado el estereocentro del enolato; en realidad, se habría atacado la diastereocara opuesta del aldehído. En ambos casos, se prefiere el diastereómero 1,3-syn. Hay muchos ejemplos de este tipo de estereocontrol:

Estereocentro alfa en el electrófilo
Cuando los enolatos atacan a los aldehídos con un estereocentro alfa, también es posible un excelente estereocontrol. La observación general es que los enolatos E exhiben selección diastereoface de Felkin, mientras que los enolatos Z exhiben selectividad anti-Felkin. El modelo general se presenta a continuación:

Dado que los enolatos de Z deben reaccionar a través de un estado de transición que contiene una interacción desestabilizadora sin-pentano o un rotámero anti-Felkin, los enolatos de Z exhiben niveles más bajos de diastereoselectividad. en este caso. Algunos ejemplos se presentan a continuación:

Modelo unificado de estereoinducción
Si tanto el enolato como el aldehído contienen quiralidad preexistente, entonces el resultado de la "doble estereodiferenciación" La reacción aldólica se puede predecir utilizando un modelo estereoquímico combinado que tiene en cuenta el sesgo facial del enolato, la geometría del enolato y el sesgo facial del aldehído. A continuación se dan varios ejemplos de la aplicación de este modelo:

Evans' química de la oxazolidinona
Un método ampliamente utilizado es el método de Evans' Método de acil oxazolidinona. Desarrollado a finales de los años 1970 y 1980 por David A. Evans y sus compañeros de trabajo, el método funciona creando temporalmente un enolato quiral añadiendo un auxiliar quiral. La quiralidad preexistente del auxiliar se transfiere luego al aducto aldólico realizando una reacción aldólica diastereoselectiva. Tras la eliminación posterior del auxiliar, se revela el estereoisómero aldólico deseado.



En el caso de Evans' En el método, el auxiliar quiral añadido es una oxazolidinona y el compuesto carbonílico resultante es una imida. Actualmente se encuentran disponibles varias oxazolidinonas en ambas formas enantioméricas. Son relativamente caros. Sin embargo, las oxazolidinonas enantiopras se obtienen en 2 pasos sintéticos a partir de aminoácidos comparativamente económicos, lo que significa que las síntesis a gran escala pueden resultar más económicas mediante una preparación interna. Esto normalmente implica una reducción del resto ácido mediada por borohidruro, seguida de una condensación/ciclación del aminoalcohol resultante con un éster carbonato simple tal como carbonato de dietilo.

La acilación de una oxazolidinona es un procedimiento conveniente y se denomina informalmente "carga realizada". Los Z-enolatos, que conducen a aductos de sin-aldol, se pueden formar de forma fiable mediante una enolización suave mediada por boro:

A menudo, se puede obtener un único diastereómero mediante una cristalización del aducto aldólico. Sin embargo, los aductos anti-aldol no se pueden obtener de forma fiable con el método de Evans. A pesar del costo y la limitación de proporcionar solo aductos syn, la confiabilidad superior, la facilidad de uso y la versatilidad del método lo convierten en el método de elección en muchas situaciones. Hay muchos métodos disponibles para la escisión del auxiliar:

Tras la construcción de la imida, se pueden realizar reacciones de adición de aldol tanto syn como antiselectivas, lo que permite el ensamblaje de tres de los cuatro estereoarreglos posibles: syn selectivo: y anti selectivo:

En las reacciones sinselectivas, ambos métodos de enolización dan el enolato Z, como se esperaba; sin embargo, el resultado estereoquímico de la reacción está controlado por el estereocentro de metilo, en lugar de por la quiralidad de la oxazolidinona. Los métodos descritos permiten el ensamblaje estereoselectivo de policétidos, una clase de productos naturales que a menudo presentan el retrón aldólico.
Variaciones y métodos
Reacciones acetato aldólico
Una limitación clave del enfoque auxiliar quiral descrito anteriormente es la incapacidad de las N-acetilimidas de reaccionar selectivamente. Un primer enfoque fue utilizar un grupo tioéter temporal:

Reacción aldólica de Mukaiyama
La reacción aldólica de Mukaiyama es la adición nucleofílica de éteres de sililo enol a aldehídos catalizada por un ácido de Lewis como el trifluoruro de boro (como eterato de trifluoruro de boro) o el tetracloruro de titanio. La reacción aldólica de Mukaiyama no sigue el modelo de Zimmerman-Traxler. Carreira ha descrito una metodología asimétrica particularmente útil con acetales de silil ceteno, destacable por sus altos niveles de enantioselectividad y amplio alcance de sustrato.
El método funciona con aldehídos alifáticos no ramificados, que a menudo son electrófilos pobres para procesos catalíticos asimétricos. Esto puede deberse a una pobre diferenciación electrónica y estérica entre sus enantiocaras.

El proceso aldólico análogo de Mukaiyama también puede volverse catalítico y asimétrico. El ejemplo que se muestra a continuación funciona eficientemente para aldehídos aromáticos (pero no alifáticos) y se cree que el mecanismo implica un dienolato quiral unido a un metal.

Aldol de tiazolidintiona de Crimins
En el enfoque de tiazolidinetiona de Crimins una tiazolidinetiona realiza reacciones de acetato aldólico. y puede producir el "Evans syn" o "síntesis que no es de Evans" aductos simplemente variando la cantidad de (-)-esparteína. Se cree que la reacción se produce a través de estados de transición unidos a titanio de seis miembros, análogos a los estados de transición propuestos para el auxiliar de Evans. NOTA: a la estructura de la esparteína que se muestra a continuación le falta un átomo de N.

Organocatálisis
Los catalizadores quirales de amina secundaria catalizan algunas reacciones aldólicas. Estas aminas secundarias forman enaminas transitorias cuando se exponen a cetonas, que pueden reaccionar enantioselectivamente con electrófilos de aldehído adecuados. La amina reacciona con el carbonilo para formar una enamina, la enamina actúa como un nucleófilo similar a un enol y luego la amina se libera del producto: la amina en sí es un catalizador. Este método de catálisis de enaminas es un tipo de organocatálisis, ya que el catalizador se basa íntegramente en una pequeña molécula orgánica. En un ejemplo fundamental, la prolina catalizó eficientemente la ciclación de una tricetona:

Esta reacción se conoce como reacción Hajos-Parrish (también conocida como reacción Hajos-Parrish-Eder-Sauer-Wiechert, en referencia a un informe contemporáneo de Schering sobre la reacción en condiciones más duras). En las condiciones de Hajos-Parrish sólo es necesaria una cantidad catalítica de prolina (3 mol%). No hay peligro de una reacción de fondo aquiral porque los intermedios de enamina transitorios son mucho más nucleofílicos que sus enoles cetónicos originales. Esta estrategia ofrece una forma sencilla de generar enantioselectividad en reacciones sin utilizar metales de transición, que tienen las posibles desventajas de ser tóxicos o costosos.
Las reacciones aldólicas catalizadas por prolina no muestran ningún efecto no lineal (la enantioselectividad de los productos es directamente proporcional a la enantiopureza del catalizador). Combinado con evidencia de etiquetado isotópico y estudios computacionales, el mecanismo de reacción propuesto para reacciones aldólicas catalizadas por prolina es el siguiente:

Esta estrategia permite la difícil reacción cruzada entre dos aldehídos. En general, las reacciones cruzadas entre aldehídos suelen ser un desafío porque pueden polimerizarse fácilmente o reaccionar de forma no selectiva para dar una mezcla estadística de productos. El primer ejemplo se muestra a continuación:

En contraste con la preferencia por los aductos syn que se observa típicamente en las adiciones aldólicas a base de enolato, estas adiciones aldólicas organocatalizadas son antiselectivas. En muchos casos, las condiciones organocatalíticas son lo suficientemente suaves como para evitar la polimerización. Sin embargo, la selectividad requiere la adición lenta y controlada con una bomba de jeringa del socio electrófilo deseado porque ambos socios reactivos suelen tener protones enolizables. Si un aldehído no tiene protones enolizables ni ramificaciones alfa o beta, se puede lograr un control adicional.
MacMillan y sus compañeros de trabajo revelaron en 2004 una elegante demostración del poder de las reacciones aldólicas organocatalíticas asimétricas en su síntesis de carbohidratos diferencialmente protegidos. Mientras que los métodos sintéticos tradicionales logran la síntesis de hexosas utilizando variaciones de estrategias iterativas de protección-desprotección, que requieren de 8 a 14 pasos, la organocatálisis puede acceder a muchos de los mismos sustratos utilizando un protocolo eficiente de dos pasos que implica la dimerización catalizada por prolina de alfa-oxialdehídos seguida de mediante ciclación aldólica de Mukaiyama en tándem.

La dimerización aldólica de alfa-oxialdehídos requiere que el aducto aldólico, en sí mismo un aldehído, sea inerte a reacciones aldólicas adicionales. Estudios anteriores revelaron que los aldehídos que llevaban sustituyentes alfa-alquiloxi o alfa-sililoxi eran adecuados para esta reacción, mientras que los aldehídos que llevaban grupos aceptores de electrones, como el acetoxi, no eran reactivos. El producto eritrosa protegido podría luego convertirse en cuatro posibles azúcares mediante la adición de aldol de Mukaiyama seguida de la formación de lactol. Esto requiere un diastereocontrol apropiado en la adición de aldol de Mukaiyama y que el ion sililoxicarbenio producto cicle preferentemente, en lugar de sufrir una reacción aldólica adicional. Al final se sintetizaron glucosa, manosa y alosa:

"Directo" adiciones aldólicas
En la adición aldólica habitual, se desprotona un compuesto carbonílico para formar el enolato. El enolato se añade a un aldehído o cetona, que forma un alcóxido, que luego se protona durante el procesamiento. Un método superior, en principio, evitaría el requisito de una secuencia de varios pasos en favor de una secuencia "directa". reacción que podría realizarse en un solo paso del proceso. Una idea es generar el enolato utilizando un catalizador metálico que se libera después del mecanismo de adición aldólica. El problema general es que la adición genera un alcóxido, que es mucho más básico que los materiales de partida. Este producto se une firmemente al metal, evitando que reaccione con reactivos carbonilo adicionales.

Un enfoque, demostrado por Evans, es sililar el aducto aldólico. En la reacción se añade un reactivo de silicio como TMSCl, que reemplaza el metal en el alcóxido, lo que permite la renovación del catalizador metálico. Minimizar el número de pasos de reacción y la cantidad de productos químicos reactivos utilizados conduce a una reacción rentable e industrialmente útil.

Reacciones aldólicas biológicas
Ejemplos de reacciones aldólicas en bioquímica incluyen la división de fructosa-1,6-bifosfato en dihidroxiacetona y gliceraldehído-3-fosfato en la cuarta etapa de la glucólisis, que es un ejemplo de reacción inversa ("retro").;) reacción aldólica catalizada por la enzima aldolasa A (también conocida como fructosa-1,6-bisfosfato aldolasa).
En el ciclo del glioxilato de las plantas y algunos procariotas, la isocitrato liasa produce glioxilato y succinato a partir del isocitrato. Después de la desprotonación del grupo OH, la isocitrato liasa escinde el isocitrato en succinato de cuatro carbonos y glioxilato de dos carbonos mediante una reacción de escisión aldólica. Esta escisión es mecánicamente similar a la reacción de la glucólisis con aldolasa A.
Historia
La reacción aldólica fue descubierta de forma independiente por el químico ruso (y compositor romántico) Alexander Borodin en 1869 y por el químico francés Charles-Adolphe Wurtz en 1872, que originalmente utilizó aldehídos para realizar la reacción.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar