Quinasa
En bioquímica, una quinasa o cinasa es una enzima que cataliza la transferencia de grupos fosfato de moléculas donadoras de fosfato de alta energía a sustratos específicos. Este proceso se conoce como fosforilación, donde la molécula de ATP de alta energía dona un grupo fosfato a la molécula de sustrato. Esta transesterificación produce un sustrato fosforilado y ADP. Por el contrario, se denomina desfosforilación cuando el sustrato fosforilado dona un grupo fosfato y el ADP gana un grupo fosfato (produciendo un sustrato desfosforilado y la molécula de ATP de alta energía). Estos dos procesos, fosforilación y desfosforilación, ocurren cuatro veces durante la glucólisis.
Las quinasas son parte de la familia más grande de fosfotransferasas. Las quinasas no deben confundirse con las fosforilasas, que catalizan la adición de grupos fosfato inorgánicos a un aceptor, ni con las fosfatasas, que eliminan los grupos fosfato (desfosforilación). El estado de fosforilación de una molécula, ya sea una proteína, un lípido o un carbohidrato, puede afectar su actividad, reactividad y capacidad para unirse a otras moléculas. Por lo tanto, las quinasas son fundamentales en el metabolismo, la señalización celular, la regulación de proteínas, el transporte celular, los procesos de secreción y muchas otras vías celulares, lo que las hace muy importantes para la fisiología humana.
Bioquímica y relevancia funcional
Las quinasas median en la transferencia de un resto de fosfato desde una molécula de alta energía (como ATP) a su molécula de sustrato, como se ve en la figura a continuación. Se necesitan quinasas para estabilizar esta reacción porque el enlace fosfoanhídrido contiene un alto nivel de energía. Las quinasas orientan adecuadamente su sustrato y el grupo fosforilo dentro de sus sitios activos, lo que aumenta la velocidad de la reacción. Además, suelen utilizar residuos de aminoácidos cargados positivamente, que estabilizan electrostáticamente el estado de transición al interactuar con los grupos fosfato cargados negativamente. Alternativamente, algunas quinasas utilizan cofactores metálicos unidos en sus sitios activos para coordinar los grupos fosfato. Las proteínas quinasas se pueden clasificar como catalíticamente activas (canónicas) o como pseudoquinasas,Sin embargo, en términos de resultados de señalización y relevancia de la enfermedad, tanto las quinasas como las pseudoquinasas son moduladores de señalización importantes en las células humanas, lo que hace que las quinasas sean dianas farmacológicas muy importantes.
Las quinasas se utilizan ampliamente para transmitir señales y regular procesos complejos en las células. La fosforilación de moléculas puede potenciar o inhibir su actividad y modular su capacidad para interactuar con otras moléculas. La adición y eliminación de grupos fosforilo proporciona a la célula un medio de control porque varias quinasas pueden responder a diferentes condiciones o señales. Las mutaciones en las cinasas que conducen a una pérdida o ganancia de función pueden causar cáncer y enfermedades en humanos, incluidos ciertos tipos de leucemia y neuroblastomas, glioblastoma, ataxia espinocerebelosa (tipo 14), formas de agammaglobulinemia y muchos otros..
Historia y clasificación
La primera proteína reconocida como catalizadora de la fosforilación de otra proteína utilizando ATP fue observada en 1954 por Eugene P. Kennedy, momento en el que describió una enzima hepática que catalizaba la fosforilación de la caseína. En 1956, Edmond H. Fischer y Edwin G. Krebs descubrieron que la interconversión entre la fosforilasa ay la fosforilasa b estaba mediada por la fosforilación y la desfosforilación.La quinasa que transfirió un grupo fosforilo a la fosforilasa b, convirtiéndolo en fosforilasa a, se denominó fosforilasa quinasa. Años más tarde, se identificó el primer ejemplo de una cascada de cinasas, en la que la proteína cinasa A (PKA) fosforila a la fosforilasa cinasa. Al mismo tiempo, se descubrió que la PKA inhibía la glucógeno sintasa, que fue el primer ejemplo de un evento de fosforilación que resultó en una inhibición. En 1969, Lester Reed descubrió que la fosforilación inactivaba la piruvato deshidrogenasa, y este descubrimiento fue la primera pista de que la fosforilación podría servir como medio de regulación en otras vías metabólicas además del metabolismo del glucógeno. En el mismo año, Tom Langan descubrió que la PKA fosforila la histona H1, lo que sugirió que la fosforilación podría regular las proteínas no enzimáticas. La década de 1970 incluyó el descubrimiento de proteínas quinasas dependientes de calmodulina y el hallazgo de que las proteínas pueden fosforilarse en más de un residuo de aminoácido. La década de 1990 puede describirse como la "década de las cascadas de proteína quinasa". Durante este tiempo, se descubrieron la vía MAPK/ERK, las cinasas JAK (una familia de proteínas tirosina cinasas) y la cascada de cinasas dependientes de PIP3.
Las quinasas se clasifican en amplios grupos según el sustrato sobre el que actúan: proteínas quinasas, lípidos quinasas, carbohidratos quinasas. Las quinasas se pueden encontrar en una variedad de especies, desde bacterias hasta moho, gusanos y mamíferos. Se han identificado más de quinientas quinasas diferentes en humanos.Su diversidad y su papel en la señalización las convierte en un interesante objeto de estudio. Varias otras quinasas actúan sobre moléculas pequeñas como lípidos, carbohidratos, aminoácidos y nucleótidos, ya sea para la señalización o para prepararlas para las vías metabólicas. Las quinasas específicas a menudo reciben el nombre de sus sustratos. Las proteínas quinasas a menudo tienen múltiples sustratos y las proteínas pueden servir como sustratos para más de una quinasa específica. Por esta razón, las proteínas quinasas se denominan en función de lo que regula su actividad (es decir, proteínas quinasas dependientes de calmodulina). A veces se subdividen en categorías porque hay varias formas isoenzimáticas. Por ejemplo, las proteínas quinasas dependientes de AMP cíclico de tipo I y tipo II tienen subunidades catalíticas idénticas pero diferentes subunidades reguladoras que se unen al AMP cíclico.
Proteínas quinasas
Las proteínas quinasas actúan sobre las proteínas, fosforilándolas en sus residuos de serina, treonina, tirosina o histidina. La fosforilación puede modificar la función de una proteína de muchas maneras. Puede aumentar o disminuir la actividad de una proteína, estabilizarla o marcarla para su destrucción, localizarla dentro de un compartimento celular específico y puede iniciar o interrumpir su interacción con otras proteínas. Las proteínas quinasas constituyen la mayoría de todas las quinasas y se estudian ampliamente. Estas quinasas, junto con las fosfatasas, desempeñan un papel importante en la regulación de proteínas y enzimas, así como en la señalización en la célula.
Un punto común de confusión surge al pensar en las diferentes formas en que una célula logra la regulación biológica. Hay innumerables ejemplos de modificaciones covalentes que pueden sufrir las proteínas celulares; sin embargo, la fosforilación es una de las pocas modificaciones covalentes reversibles. Esto proporcionó la justificación de que la fosforilación de proteínas es reguladora. El potencial para regular la función de las proteínas es enorme dado que existen muchas formas de modificar covalentemente una proteína además de la regulación proporcionada por el control alostérico. En su Hopkins Memorial Lecture, Edwin Krebs afirmó que el control alostérico evolucionó para responder a las señales que surgen desde el interior de la célula, mientras que la fosforilación evolucionó para responder a las señales fuera de la célula.
Quinasas dependientes de ciclina
Las quinasas dependientes de ciclina (CDK) son un grupo de varias quinasas diferentes involucradas en la regulación del ciclo celular. Fosforilan otras proteínas en sus residuos de serina o treonina, pero las CDK primero deben unirse a una proteína ciclina para ser activas. Diferentes combinaciones de CDK y ciclinas específicas marcan diferentes partes del ciclo celular. Además, el estado de fosforilación de las CDK también es fundamental para su actividad, ya que están sujetas a la regulación de otras quinasas (como la quinasa activadora de CDK) y fosfatasas (como Cdc25).Una vez que las CDK están activas, fosforilan otras proteínas para cambiar su actividad, lo que conduce a los eventos necesarios para la siguiente etapa del ciclo celular. Si bien son más conocidas por su función en el control del ciclo celular, las CDK también tienen funciones en la transcripción, el metabolismo y otros eventos celulares.
Debido a su papel clave en el control de la división celular, las mutaciones en las CDK a menudo se encuentran en las células cancerosas. Estas mutaciones conducen al crecimiento descontrolado de las células, donde pasan rápidamente por todo el ciclo celular repetidamente. Las mutaciones de CDK se pueden encontrar en linfomas, cáncer de mama, tumores pancreáticos y cáncer de pulmón. Por lo tanto, los inhibidores de CDK se han desarrollado como tratamientos para algunos tipos de cáncer.
Proteínas quinasas activadas por mitógenos
Las MAP quinasas (MAPK) son una familia de serina/treonina quinasas que responden a una variedad de señales de crecimiento extracelular. Por ejemplo, la hormona del crecimiento, el factor de crecimiento epidérmico, el factor de crecimiento derivado de plaquetas y la insulina se consideran estímulos mitógenos que pueden participar en la vía MAPK. La activación de esta vía a nivel del receptor inicia una cascada de señalización mediante la cual Ras GTPase intercambia GDP por GTP. A continuación, Ras activa la quinasa Raf (también conocida como MAPKKK), que activa MEK (MAPKK). MEK activa MAPK (también conocido como ERK), que puede continuar regulando la transcripción y la traducción. Mientras que RAF y MAPK son serina/treonina quinasas, MAPKK es una tirosina/treonina quinasa.
MAPK puede regular los factores de transcripción directa o indirectamente. Sus objetivos transcripcionales principales incluyen ATF-2, Chop, c-Jun, c-Myc, DPC4, Elk-1, Ets1, Max, MEF2C, NFAT4, Sap1a, STATs, Tal, p53, CREB y Myc. MAPK también puede regular la traducción al fosforilar la cinasa S6 en la subunidad ribosómica grande. También puede fosforilar componentes en la parte anterior de la cascada de señalización de MAPK, incluidos Ras, Sos y el propio receptor de EGF.
El potencial carcinogénico de la vía MAPK la hace clínicamente significativa. Está implicado en procesos celulares que pueden conducir a un crecimiento descontrolado y la posterior formación de tumores. Las mutaciones dentro de esta vía alteran sus efectos reguladores sobre la diferenciación, proliferación, supervivencia y apoptosis celular, todos los cuales están implicados en diversas formas de cáncer.
Lípidos quinasas
Las quinasas de lípidos fosforilan los lípidos en la célula, tanto en la membrana plasmática como en las membranas de los orgánulos. La adición de grupos fosfato puede cambiar la reactividad y localización del lípido y puede usarse en la transmisión de señales.
Fosfatidilinositol quinasas
Las fosfatidilinositol quinasas fosforilan especies de fosfatidilinositol, para crear especies como fosfatidilinositol 3,4-bisfosfato (PI(3,4)P 2), fosfatidilinositol 3,4,5-trifosfato (PIP 3) y fosfatidilinositol 3-fosfato (PI3P). Las quinasas incluyen fosfoinositido 3-quinasa (PI3K), fosfatidilinositol-4-fosfato 3-quinasa y fosfatidilinositol-4,5-bisfosfato 3-quinasa. El estado de fosforilación del fosfatidilinositol juega un papel importante en la señalización celular, como en la vía de señalización de la insulina, y también tiene funciones en la endocitosis, la exocitosis y otros eventos de tráfico. Las mutaciones en estas quinasas, como PI3K, pueden provocar cáncer o resistencia a la insulina.
Las enzimas quinasas aumentan la velocidad de las reacciones al hacer que el grupo hidroxilo del inositol sea más nucleofílico, a menudo utilizando la cadena lateral de un residuo de aminoácido para actuar como una base general y desprotonar el hidroxilo, como se ve en el mecanismo a continuación. Aquí se coordina una reacción entre el trifosfato de adenosina (ATP) y el fosfatidilinositol. El resultado final es un fosfatidilinositol-3-fosfato y adenosina difosfato (ADP). Las enzimas también pueden ayudar a orientar correctamente la molécula de ATP, así como el grupo de inositol, para que la reacción avance más rápido. Los iones metálicos a menudo se coordinan para este propósito.
 Mecanismo de la fosfatidilinositol-3 quinasa. El ATP y el fosfatidilinositol reaccionan para formar fosfatidilinositol-3-fosfato y ADP, con la ayuda de la base general
Mecanismo de la fosfatidilinositol-3 quinasa. El ATP y el fosfatidilinositol reaccionan para formar fosfatidilinositol-3-fosfato y ADP, con la ayuda de la base general
B.
Esfingosina quinasas
La esfingosina quinasa (SK) es una lípido quinasa que cataliza la conversión de esfingosina en esfingosina-1-fosfato (S1P). Los esfingolípidos son lípidos de membrana ubicuos. Tras la activación, la esfingosina cinasa migra desde el citosol a la membrana plasmática, donde transfiere un fosfato γ (que es el último o terminal fosfato) del ATP o GTP a la esfingosina. El receptor S1P es un receptor GPCR, por lo que S1P tiene la capacidad de regular la señalización de la proteína G. La señal resultante puede activar efectores intracelulares como ERK, Rho GTPase, Rac GTPase, PLC y AKT/PI3K. También puede ejercer su efecto sobre moléculas diana dentro de la célula. Se ha demostrado que S1P inhibe directamente la actividad de la histona desacetilasa de las HDAC. Por el contrario, la esfingosina desfosforilada promueve la apoptosis celular, y, por lo tanto, es fundamental comprender la regulación de las SK debido a su papel en la determinación del destino celular. Investigaciones anteriores muestran que las SK pueden sostener el crecimiento de células cancerosas porque promueven la proliferación celular, y SK1 (un tipo específico de SK) está presente en concentraciones más altas en ciertos tipos de cáncer.
Hay dos quinasas presentes en las células de mamífero, SK1 y SK2. SK1 es más específico en comparación con SK2 y sus patrones de expresión también difieren. SK1 se expresa en células de pulmón, bazo y leucocitos, mientras que SK2 se expresa en células de riñón e hígado. La participación de estas dos quinasas en la supervivencia, proliferación, diferenciación e inflamación celular las convierte en candidatas viables para terapias quimioterapéuticas.
Carbohidrato quinasas

Para muchos mamíferos, los carbohidratos proporcionan una gran parte del requerimiento calórico diario. Para obtener energía de los oligosacáridos, primero deben descomponerse en monosacáridos para que puedan entrar en el metabolismo. Las quinasas juegan un papel importante en casi todas las rutas metabólicas. La figura de la izquierda muestra la segunda fase de la glucólisis, que contiene dos reacciones importantes catalizadas por quinasas. El enlace anhídrido en 1,3 bisfosfoglicerato es inestable y tiene una alta energía. La 1,3-bisfosfoglicerato quinasa requiere ADP para llevar a cabo su reacción produciendo 3-fosfoglicerato y ATP. En el paso final de la glucólisis, la piruvato quinasa transfiere un grupo fosforilo del fosfoenolpiruvato al ADP, generando ATP y piruvato.
La hexocinasa es la enzima más común que utiliza la glucosa cuando ingresa por primera vez a la célula. Convierte la D-glucosa en glucosa-6-fosfato transfiriendo el fosfato gamma de un ATP a la posición C6. Este es un paso importante en la glucólisis porque atrapa la glucosa dentro de la célula debido a la carga negativa. En su forma desfosforilada, la glucosa puede moverse de un lado a otro de la membrana muy fácilmente. Las mutaciones en el gen de la hexoquinasa pueden conducir a una deficiencia de hexoquinasa que puede causar anemia hemolítica no esferocítica.
La fosfofructoquinasa, o PFK, cataliza la conversión de fructosa-6-fosfato en fructosa-1,6-bisfosfato y es un punto importante en la regulación de la glucólisis. Los altos niveles de ATP, H y citrato inhiben la PFK. Si los niveles de citrato son altos, significa que la glucólisis está funcionando a un ritmo óptimo. Los altos niveles de AMP estimulan la PFK. La enfermedad de Tarui, una enfermedad de almacenamiento de glucógeno que conduce a la intolerancia al ejercicio, se debe a una mutación en el gen PFK que reduce su actividad.
Otras quinasas
Las quinasas actúan sobre muchas otras moléculas además de las proteínas, los lípidos y los carbohidratos. Hay muchos que actúan sobre los nucleótidos (ADN y ARN), incluidos los que intervienen en la conversión de nucleótidos, como las cinasas de nucleósido-fosfato y las de nucleósido-difosfato. Otras moléculas pequeñas que son sustratos de quinasas incluyen creatina, fosfoglicerato, riboflavina, dihidroxiacetona, shikimato y muchas otras.
Riboflavina quinasa
La riboflavina quinasa cataliza la fosforilación de la riboflavina para crear mononucleótido de flavina (FMN). Tiene un mecanismo de unión ordenado donde la riboflavina debe unirse a la quinasa antes de unirse a la molécula de ATP. Los cationes divalentes ayudan a coordinar el nucleótido. El mecanismo general se muestra en la siguiente figura.
 Mecanismo de la riboflavina quinasa.
Mecanismo de la riboflavina quinasa.
La riboflavina quinasa juega un papel importante en las células, ya que FMN es un cofactor importante. FMN también es un precursor del dinucleótido de flavina y adenina (FAD), un cofactor redox utilizado por muchas enzimas, incluidas muchas en el metabolismo. De hecho, existen algunas enzimas que son capaces de llevar a cabo tanto la fosforilación de riboflavina a FMN, como la reacción de FMN a FAD. La riboflavina quinasa puede ayudar a prevenir un accidente cerebrovascular y posiblemente podría usarse como tratamiento en el futuro. También está implicado en la infección, cuando se estudia en ratones.
Timidina quinasa
La timidina quinasa es una de las muchas nucleósidos quinasas que son responsables de la fosforilación de nucleósidos. Fosforila la timidina para crear monofosfato de timidina (dTMP). Esta quinasa usa una molécula de ATP para suministrar el fosfato a la timidina, como se muestra a continuación. Esta transferencia de un fosfato de un nucleótido a otro por la timidina quinasa, así como por otros nucleósidos y nucleótidos quinasas, funciona para ayudar a controlar el nivel de cada uno de los diferentes nucleótidos.
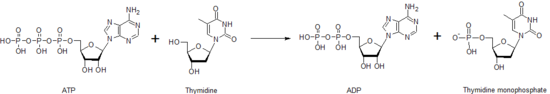 Reacción global catalizada por la timidina quinasa.
Reacción global catalizada por la timidina quinasa.
Después de la creación de la molécula de dTMP, otra quinasa, la timidilato quinasa, puede actuar sobre la dTMP para crear la forma de difosfato, dTDP. La nucleósido difosfato quinasa cataliza la producción de trifosfato de timidina, dTTP, que se utiliza en la síntesis de ADN. Debido a esto, la actividad de la timidina cinasa está estrechamente relacionada con el ciclo celular y se utiliza como marcador tumoral en química clínica. Por lo tanto, en algún momento se puede utilizar para predecir el pronóstico del paciente. Los pacientes con mutaciones en el gen de la timidina quinasa pueden tener cierto tipo de síndrome de agotamiento del ADN mitocondrial, una enfermedad que conduce a la muerte en la primera infancia.
Contenido relacionado
Evaporación
Unión internacional de Química Pura Aplicada
Plástico