Quimioterapia
La quimioterapia (a menudo abreviada como quimio y, a veces, CTX o CTx) es un tipo de tratamiento contra el cáncer que usa uno o más medicamentos contra el cáncer (agentes quimioterapéuticos o agentes alquilantes) como parte de un régimen de quimioterapia estandarizado. La quimioterapia se puede administrar con una intención curativa (que casi siempre involucra combinaciones de medicamentos) o puede tener como objetivo prolongar la vida o reducir los síntomas (quimioterapia paliativa). La quimioterapia es una de las principales categorías de la disciplina médica dedicada específicamente a la farmacoterapia del cáncer, que se denomina oncología médica.
El término quimioterapia ha llegado a connotar el uso no específico de venenos intracelulares para inhibir la mitosis (división celular) o inducir daños en el ADN, razón por la cual la inhibición de la reparación del ADN puede aumentar la quimioterapia. La connotación de la palabra quimioterapia excluye agentes más selectivos que bloquean las señales extracelulares (transducción de señales). El desarrollo de terapias con dianas genéticas o moleculares específicas, que inhiben las señales promotoras del crecimiento de las hormonas endocrinas clásicas (principalmente estrógenos para el cáncer de mama y andrógenos para el cáncer de próstata) ahora se denominan terapias hormonales. Por el contrario, otras inhibiciones de las señales de crecimiento como las asociadas con las tirosina quinasas receptoras se denominan terapia dirigida.
Es importante destacar que el uso de medicamentos (ya sea quimioterapia, terapia hormonal o terapia dirigida) constituye una terapia sistémica para el cáncer, ya que se introducen en el torrente sanguíneo y, por lo tanto, en principio pueden tratar el cáncer en cualquier localización anatómica del cuerpo. La terapia sistémica a menudo se usa junto con otras modalidades que constituyen terapia local (es decir, tratamientos cuya eficacia se limita al área anatómica donde se aplican) para el cáncer, como la radioterapia, la cirugía o la terapia de hipertermia.
Los agentes quimioterapéuticos tradicionales son citotóxicos porque interfieren con la división celular (mitosis), pero las células cancerosas varían ampliamente en su susceptibilidad a estos agentes. En gran medida, se puede pensar en la quimioterapia como una forma de dañar o estresar las células, lo que puede conducir a la muerte celular si se inicia la apoptosis. Muchos de los efectos secundarios de la quimioterapia se pueden atribuir al daño a las células normales que se dividen rápidamente y, por lo tanto, son sensibles a los medicamentos antimitóticos: células en la médula ósea, el tracto digestivo y los folículos pilosos. Esto da como resultado los efectos secundarios más comunes de la quimioterapia: mielosupresión (disminución de la producción de células sanguíneas, por lo tanto también inmunosupresión), mucositis (inflamación del revestimiento del tracto digestivo) y alopecia (pérdida de cabello). Debido al efecto sobre las células inmunitarias (especialmente los linfocitos), los medicamentos quimioterapéuticos a menudo encuentran uso en una serie de enfermedades que resultan de la hiperactividad dañina del sistema inmunitario contra sí mismo (la llamada autoinmunidad). Estos incluyen artritis reumatoide, lupus eritematoso sistémico, esclerosis múltiple, vasculitis y muchos otros.
Estrategias de tratamiento
| Tipo de cáncer | Drogas | Acrónimos |
|---|---|---|
| Cáncer de mama | Ciclofosfamida, metotrexato, 5-fluorouracil, vinorelbina | CMF |
| Doxorrubicina, ciclofosfamida | AC | |
| Linfoma de Hodgkin | Docetaxel, doxorubicina, ciclofosfamida | TAC |
| Doxorrubicina, bleomycin, vinblastine, dacarbazine | ABVD | |
| Mustina, vincristina, procarbazina, prednisolona | MOPP | |
| Linfoma de no Hodgkin | Ciclofosfamida, doxorrubicina, vincristina, prednisolona | CHOP, R-CVP |
| Tumor de células germinales | Bleomycin, etoposide, cisplatino | BEP |
| Cáncer de estómago | Epirubicina, cisplatino, 5-fluorouracil | ECF |
| Epirubicina, cisplatino, capecitabina | ECX | |
| Cáncer de vejiga | Methotrexate, vincristina, doxorubicina, cisplatino | MVAC |
| Cáncer de pulmón | Ciclofosfamida, doxorrubicina, vincristina, vinorelbina | CAV |
| Cáncer colorrectal | 5-fluorouracil, ácido folónico, oxaliplatina | FOLFOX |
| Cáncer de páncreas | Gemcitabina, 5-fluorouracil | FOLFOX |
| Cáncer de hueso | Doxorubicina, cisplatino, metotrexato, ifosfamida, etoposide | MAP/MAPIE |
Hay una serie de estrategias en la administración de fármacos quimioterapéuticos que se utilizan en la actualidad. La quimioterapia se puede administrar con una intención curativa o puede tener como objetivo prolongar la vida o paliar los síntomas.
- La quimioterapia de inducción es el tratamiento de primera línea del cáncer con un medicamento quimioterapéutico. Este tipo de quimioterapia se utiliza para la intención curativa.
- La quimioterapia de modalidad combinada es el uso de fármacos con otros tratamientos de cáncer, como cirugía, radioterapia o hipertermiaterapia.
- La quimioterapia de consolidación se administra después de la remisión para prolongar el tiempo libre de enfermedades y mejorar la supervivencia general. El fármaco que se administra es el mismo que el fármaco que logró la remisión.
- La quimioterapia de intensificación es idéntica a la quimioterapia de consolidación, pero un medicamento diferente al que se utiliza la quimioterapia de inducción.
- La quimioterapia combinada consiste en tratar simultáneamente a una persona con varios medicamentos diferentes. Los fármacos difieren en su mecanismo y efectos secundarios. La mayor ventaja es minimizar las posibilidades de que la resistencia se desarrolle a cualquier agente. Además, los medicamentos se pueden utilizar a menudo en dosis más bajas, reduciendo la toxicidad.
- La quimioterapia neoadyuvante se administra antes de un tratamiento local como la cirugía, y está diseñada para reducir el tumor primario. También se administra para cánceres con un alto riesgo de enfermedad micrometastática.
- La quimioterapia adyuvante se administra después de un tratamiento local (radioterapia o cirugía). Se puede utilizar cuando hay poca evidencia de cáncer presente, pero hay riesgo de recurrencia. También es útil matar a cualquier célula cancerosa que se haya diseminado a otras partes del cuerpo. Estas micrometasas se pueden tratar con quimioterapia adyuvante y pueden reducir las tasas de recaída causadas por estas células diseminadas.
- La quimioterapia de mantenimiento es un tratamiento repetido de dosis bajas para prolongar la remisión.
- La quimioterapia o quimioterapia paliativa se administra sin intención curativa, pero simplemente para disminuir la carga tumoral y aumentar la esperanza de vida. Para estos regímenes, en general, se espera un mejor perfil de toxicidad.
Todos los regímenes de quimioterapia requieren que el receptor sea capaz de someterse al tratamiento. El estado funcional se usa a menudo como una medida para determinar si una persona puede recibir quimioterapia o si se requiere una reducción de la dosis. Debido a que solo una fracción de las células de un tumor muere con cada tratamiento (muerte fraccionada), se deben administrar dosis repetidas para continuar reduciendo el tamaño del tumor. Los regímenes de quimioterapia actuales aplican el tratamiento farmacológico en ciclos, con la frecuencia y duración de los tratamientos limitada por la toxicidad.
Eficiencia
La eficacia de la quimioterapia depende del tipo de cáncer y del estadio. La efectividad general varía desde ser curativo para algunos tipos de cáncer, como algunas leucemias, hasta ser ineficaz, como en algunos tumores cerebrales, y ser innecesario en otros, como la mayoría de los cánceres de piel no melanoma.
Dosificación

La dosificación de la quimioterapia puede ser difícil: si la dosis es demasiado baja, será ineficaz contra el tumor, mientras que, en dosis excesivas, la toxicidad (efectos secundarios) será intolerable para la persona que la recibe. El método estándar para determinar la dosis de quimioterapia se basa en el área de superficie corporal (ASC) calculada. El BSA generalmente se calcula con una fórmula matemática o un nomograma, utilizando el peso y la altura del receptor, en lugar de medir directamente el área del cuerpo. Esta fórmula se derivó originalmente en un estudio de 1916 e intentó traducir las dosis medicinales establecidas con animales de laboratorio a dosis equivalentes para humanos. El estudio solo incluyó a nueve sujetos humanos. Cuando se introdujo la quimioterapia en la década de 1950, se adoptó la fórmula BSA como el estándar oficial para la dosificación de la quimioterapia a falta de una mejor opción.
Se ha cuestionado la validez de este método para calcular dosis uniformes porque la fórmula solo tiene en cuenta el peso y la altura del individuo. La absorción y eliminación de fármacos están influenciadas por múltiples factores, que incluyen la edad, el sexo, el metabolismo, el estado de la enfermedad, la función de los órganos, las interacciones entre fármacos, la genética y la obesidad, que tienen un gran impacto en la concentración real del fármaco en la persona. 39; s del torrente sanguíneo. Como resultado, existe una gran variabilidad en la concentración del fármaco quimioterapéutico sistémico en personas que reciben dosis de BSA, y se ha demostrado que esta variabilidad es más de diez veces mayor para muchos fármacos. En otras palabras, si dos personas reciben la misma dosis de un fármaco en función de la BSA, la concentración de ese fármaco en el torrente sanguíneo de una persona puede ser 10 veces superior o inferior a la de la otra persona. Esta variabilidad es típica con muchos medicamentos de quimioterapia dosificados por BSA y, como se muestra a continuación, se demostró en un estudio de 14 medicamentos de quimioterapia comunes.
El resultado de esta variabilidad farmacocinética entre las personas es que muchas personas no reciben la dosis correcta para lograr una eficacia óptima del tratamiento con efectos secundarios tóxicos mínimos. Algunas personas tienen una sobredosis, mientras que otras tienen una dosis insuficiente. Por ejemplo, en un ensayo clínico aleatorizado, los investigadores encontraron que el 85 % de los pacientes con cáncer colorrectal metastásico tratados con 5-fluorouracilo (5-FU) no recibieron la dosis terapéutica óptima cuando se les administró la dosis estándar de BSA: el 68 % recibió una dosis insuficiente y el 17 % recibió sobredosis
Ha habido controversia sobre el uso de BSA para calcular las dosis de quimioterapia para personas obesas. Debido a su BSA más alto, los médicos a menudo reducen arbitrariamente la dosis prescrita por la fórmula de BSA por temor a una sobredosis. En muchos casos, esto puede resultar en un tratamiento subóptimo.
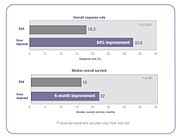
Varios estudios clínicos han demostrado que cuando la dosis de quimioterapia se individualiza para lograr una exposición sistémica óptima al fármaco, se mejoran los resultados del tratamiento y se reducen los efectos secundarios tóxicos. En el estudio clínico de 5-FU citado anteriormente, las personas cuya dosis se ajustó para lograr una exposición objetivo predeterminada lograron una mejora del 84 % en la tasa de respuesta al tratamiento y una mejora de seis meses en la supervivencia general (SG) en comparación con las que recibieron dosis de BSA.
En el mismo estudio, los investigadores compararon la incidencia de toxicidades comunes de grado 3/4 asociadas con el 5-FU entre las personas con dosis ajustada y las personas que recibieron dosis por BSA. La incidencia de grados debilitantes de diarrea se redujo del 18 % en el grupo de dosis de BSA al 4 % en el grupo de dosis ajustada y se eliminaron los efectos secundarios hematológicos graves. Debido a la toxicidad reducida, los pacientes ajustados a la dosis pudieron ser tratados durante períodos de tiempo más prolongados. Las personas que recibieron dosis de BSA fueron tratadas durante un total de 680 meses, mientras que las personas en el grupo de dosis ajustada fueron tratadas durante un total de 791 meses. Completar el curso del tratamiento es un factor importante para lograr mejores resultados del tratamiento.
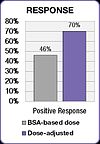
Se encontraron resultados similares en un estudio en el que participaron personas con cáncer colorrectal que habían sido tratadas con el popular régimen FOLFOX. La incidencia de diarrea grave se redujo del 12 % en el grupo de pacientes que recibieron la dosis de BSA al 1,7 % en el grupo de dosis ajustada, y la incidencia de mucositis grave se redujo del 15 % al 0,8 %.
El estudio FOLFOX también demostró una mejora en los resultados del tratamiento. La respuesta positiva aumentó del 46 % en el grupo de dosis de BSA al 70 % en el grupo de dosis ajustada. La supervivencia libre de progresión (PFS) y la supervivencia general (OS) medianas mejoraron en seis meses en el grupo de dosis ajustada.
Un enfoque que puede ayudar a los médicos a individualizar la dosis de quimioterapia es medir los niveles del fármaco en el plasma sanguíneo a lo largo del tiempo y ajustar la dosis de acuerdo con una fórmula o algoritmo para lograr una exposición óptima. Con una exposición objetivo establecida para optimizar la eficacia del tratamiento con toxicidades minimizadas, la dosificación se puede personalizar para lograr la exposición objetivo y resultados óptimos para cada persona. Dicho algoritmo se utilizó en los ensayos clínicos citados anteriormente y resultó en resultados de tratamiento significativamente mejorados.
Los oncólogos ya están individualizando las dosis de algunos medicamentos contra el cáncer en función de la exposición. La dosificación de carboplatino y busulfán se basa en los resultados de los análisis de sangre para calcular la dosis óptima para cada persona. También se encuentran disponibles análisis de sangre simples para optimizar la dosis de metotrexato, 5-FU, paclitaxel y docetaxel.
El nivel de albúmina sérica inmediatamente antes de la administración de quimioterapia es un predictor de pronóstico independiente de supervivencia en varios tipos de cáncer.
Tipos
Agentes alquilantes
Los agentes alquilantes son el grupo quimioterapéutico más antiguo que se usa en la actualidad. Originalmente derivado del gas mostaza usado en la Primera Guerra Mundial, ahora hay muchos tipos de agentes alquilantes en uso. Reciben este nombre debido a su capacidad para alquilar muchas moléculas, incluidas proteínas, ARN y ADN. Esta capacidad de unirse covalentemente al ADN a través de su grupo alquilo es la causa principal de sus efectos anticancerígenos. El ADN está formado por dos hebras y las moléculas pueden unirse dos veces a una hebra de ADN (entrecruzamiento intrahebra) o pueden unirse una vez a ambas hebras (entrecruzamiento entre hebras). Si la célula intenta replicar el ADN entrecruzado durante la división celular o intenta repararlo, las hebras de ADN pueden romperse. Esto conduce a una forma de muerte celular programada llamada apoptosis. Los agentes alquilantes funcionarán en cualquier punto del ciclo celular y, por lo tanto, se conocen como fármacos independientes del ciclo celular. Por esta razón, el efecto sobre la célula depende de la dosis; la fracción de células que mueren es directamente proporcional a la dosis de fármaco.
Los subtipos de agentes alquilantes son las mostazas nitrogenadas, nitrosoureas, tetrazinas, aziridinas, cisplatinos y derivados, y agentes alquilantes no clásicos. Las mostazas nitrogenadas incluyen mecloretamina, ciclofosfamida, melfalán, clorambucilo, ifosfamida y busulfán. Las nitrosoureas incluyen N-nitroso-N-metilurea (MNU), carmustina (BCNU), lomustina (CCNU) y semustina (MeCCNU), fotemustina y estreptozotocina. Las tetrazinas incluyen dacarbazina, mitozolomida y temozolomida. Las aziridinas incluyen tiotepa, mitomicina y diazicuona (AZQ). El cisplatino y sus derivados incluyen cisplatino, carboplatino y oxaliplatino. Deterioran la función celular al formar enlaces covalentes con los grupos amino, carboxilo, sulfhidrilo y fosfato en moléculas biológicamente importantes. Los agentes alquilantes no clásicos incluyen procarbazina y hexametilmelamina.
Antimetabolitos
Los antimetabolitos son un grupo de moléculas que impiden la síntesis de ADN y ARN. Muchos de ellos tienen una estructura similar a los componentes básicos del ADN y el ARN. Los bloques de construcción son los nucleótidos; una molécula que comprende una nucleobase, un azúcar y un grupo fosfato. Las nucleobases se dividen en purinas (guanina y adenina) y pirimidinas (citosina, timina y uracilo). Los antimetabolitos se asemejan a bases nitrogenadas o nucleósidos (un nucleótido sin el grupo fosfato), pero tienen grupos químicos alterados. Estos fármacos ejercen su efecto bloqueando las enzimas necesarias para la síntesis de ADN o incorporándose al ADN o al ARN. Al inhibir las enzimas involucradas en la síntesis de ADN, previenen la mitosis porque el ADN no puede duplicarse. Además, después de la incorporación incorrecta de las moléculas en el ADN, puede producirse daño en el ADN y se induce la muerte celular programada (apoptosis). A diferencia de los agentes alquilantes, los antimetabolitos dependen del ciclo celular. Esto significa que solo funcionan durante una parte específica del ciclo celular, en este caso la fase S (la fase de síntesis de ADN). Por esta razón, a una determinada dosis, el efecto se estabiliza y, proporcionalmente, no se produce más muerte celular con dosis mayores. Los subtipos de antimetabolitos son los antifolatos, fluoropirimidinas, análogos de desoxinucleósidos y tiopurinas.
Los antifolatos incluyen metotrexato y pemetrexed. El metotrexato inhibe la dihidrofolato reductasa (DHFR), una enzima que regenera el tetrahidrofolato a partir del dihidrofolato. Cuando la enzima es inhibida por metotrexato, los niveles celulares de coenzimas de folato disminuyen. Estos son necesarios para la producción de timidilato y purina, que son esenciales para la síntesis de ADN y la división celular. El pemetrexed es otro antimetabolito que afecta la producción de purinas y pirimidinas y, por lo tanto, también inhibe la síntesis de ADN. Principalmente inhibe la enzima timidilato sintasa, pero también tiene efectos sobre DHFR, aminoimidazol carboxamida ribonucleótido formiltransferasa y glicinamida ribonucleótido formiltransferasa. Las fluoropirimidinas incluyen fluorouracilo y capecitabina. El fluorouracilo es un análogo de la nucleobase que se metaboliza en las células para formar al menos dos productos activos; Monofosfato de 5-fluorouridina (FUMP) y 5-fosfato de 5-fluoro-2'-desoxiuridina (fdUMP). FUMP se incorpora al ARN y fdUMP inhibe la enzima timidilato sintasa; ambos conducen a la muerte celular. La capecitabina es un profármaco del 5-fluorouracilo que se descompone en las células para producir el fármaco activo. Los análogos de desoxinucleósidos incluyen citarabina, gemcitabina, decitabina, azacitidina, fludarabina, nelarabina, cladribina, clofarabina y pentostatina. Las tiopurinas incluyen tioguanina y mercaptopurina.
Agentes antimicrotúbulos
Los agentes antimicrotúbulos son sustancias químicas derivadas de plantas que bloquean la división celular al impedir la función de los microtúbulos. Los microtúbulos son una estructura celular importante compuesta por dos proteínas, α-tubulina y β-tubulina. Son estructuras huecas en forma de varilla que se requieren para la división celular, entre otras funciones celulares. Los microtúbulos son estructuras dinámicas, lo que significa que están permanentemente en estado de montaje y desmontaje. Los alcaloides de la vinca y los taxanos son los dos grupos principales de agentes antimicrotúbulos, y aunque ambos grupos de fármacos causan disfunción de los microtúbulos, sus mecanismos de acción son completamente opuestos: los alcaloides de la vinca impiden el ensamblaje de los microtúbulos, mientras que los taxanos impiden su desmontaje. Al hacerlo, pueden inducir una catástrofe mitótica en las células cancerosas. A continuación, se produce la detención del ciclo celular, lo que induce la muerte celular programada (apoptosis). Estos medicamentos también pueden afectar el crecimiento de los vasos sanguíneos, un proceso esencial que utilizan los tumores para crecer y hacer metástasis.
Los alcaloides de la vinca se derivan de la vincapervinca de Madagascar, Catharanthus roseus, anteriormente conocida como Vinca rosea. Se unen a sitios específicos en tubulina, inhibiendo el ensamblaje de tubulina en microtúbulos. Los alcaloides originales de la vinca son productos naturales que incluyen vincristina y vinblastina. Tras el éxito de estos fármacos, se produjeron alcaloides semisintéticos de la vinca: vinorelbina (utilizada en el tratamiento del cáncer de pulmón de células no pequeñas), vindesina y vinflunina. Estos fármacos son específicos del ciclo celular. Se unen a las moléculas de tubulina en la fase S y evitan la formación adecuada de microtúbulos necesarios para la fase M.
Los taxanos son fármacos naturales y semisintéticos. El primer fármaco de su clase, el paclitaxel, se extrajo originalmente de Taxus brevifolia, el tejo del Pacífico. Ahora bien, este fármaco y otro de esta clase, el docetaxel, se producen de forma semisintética a partir de una sustancia química que se encuentra en la corteza de otro tejo, Taxus baccata.
La podofilotoxina es un lignano antineoplásico obtenido principalmente de la manzana de mayo americana (Podophyllum peltatum) y de la manzana de mayo del Himalaya (Sinopodophyllum hexandrum). Tiene actividad anti-microtúbulos, y su mecanismo es similar al de los alcaloides de la vinca en que se unen a la tubulina, inhibiendo la formación de microtúbulos. La podofilotoxina se utiliza para producir otros dos fármacos con diferentes mecanismos de acción: etopósido y tenipósido.
Inhibidores de la topoisomerasa
Los inhibidores de la topoisomerasa son fármacos que afectan la actividad de dos enzimas: la topoisomerasa I y la topoisomerasa II. Cuando la hélice de doble cadena del ADN se desenrolla, durante la replicación o la transcripción del ADN, por ejemplo, el ADN adyacente sin abrir se enrolla más apretado (superenrollamiento), como si se abriera en el medio de una cuerda retorcida. El estrés causado por este efecto es ayudado en parte por las enzimas topoisomerasas. Producen roturas de cadena simple o doble en el ADN, lo que reduce la tensión en la cadena de ADN. Esto permite que se produzca el desenrollado normal del ADN durante la replicación o la transcripción. La inhibición de la topoisomerasa I o II interfiere con ambos procesos.
Dos inhibidores de la topoisomerasa I, el irinotecán y el topotecán, se derivan semisintéticamente de la camptotecina, que se obtiene del árbol ornamental chino Camptotheca acuminata. Los fármacos que se dirigen a la topoisomerasa II se pueden dividir en dos grupos. Los venenos de la topoisomerasa II provocan un aumento de los niveles de enzimas unidas al ADN. Esto impide la replicación y la transcripción del ADN, provoca roturas de la cadena de ADN y conduce a la muerte celular programada (apoptosis). Estos agentes incluyen etopósido, doxorrubicina, mitoxantrona y tenipósido. El segundo grupo, los inhibidores catalíticos, son fármacos que bloquean la actividad de la topoisomerasa II y, por lo tanto, impiden la síntesis y traducción del ADN porque el ADN no puede desenrollarse correctamente. Este grupo incluye novobiocina, merbarona y aclarubicina, que también tienen otros mecanismos de acción significativos.
Antibióticos citotóxicos
Los antibióticos citotóxicos son un grupo variado de fármacos que tienen diversos mecanismos de acción. El tema común que comparten en su indicación de quimioterapia es que interrumpen la división celular. El subgrupo más importante son las antraciclinas y las bleomicinas; otros ejemplos destacados incluyen mitomicina C y actinomicina.
Entre las antraciclinas, la doxorrubicina y la daunorrubicina fueron las primeras, y se obtuvieron de la bacteria Streptomyces peucetius. Los derivados de estos compuestos incluyen epirrubicina e idarrubicina. Otros fármacos utilizados clínicamente en el grupo de las antraciclinas son la pirarrubicina, la aclarubicina y la mitoxantrona. Los mecanismos de las antraciclinas incluyen la intercalación del ADN (las moléculas se insertan entre las dos cadenas de ADN), la generación de radicales libres altamente reactivos que dañan las moléculas intercelulares y la inhibición de la topoisomerasa.
La actinomicina es una molécula compleja que intercala el ADN e impide la síntesis del ARN.
La bleomicina, un glicopéptido aislado de Streptomyces verticillus, también se intercala en el ADN, pero produce radicales libres que dañan el ADN. Esto ocurre cuando la bleomicina se une a un ion metálico, se reduce químicamente y reacciona con el oxígeno.
La mitomicina es un antibiótico citotóxico con la capacidad de alquilar el ADN.
Entrega

La mayor parte de la quimioterapia se administra por vía intravenosa, aunque varios agentes se pueden administrar por vía oral (p. ej., melfalán, busulfán, capecitabina). Según una revisión sistemática reciente (2016), las terapias orales presentan desafíos adicionales para que los pacientes y los equipos de atención mantengan y respalden el cumplimiento de los planes de tratamiento.
Existen muchos métodos intravenosos de administración de fármacos, conocidos como dispositivos de acceso vascular. Estos incluyen el dispositivo de infusión con alas, el catéter venoso periférico, el catéter de línea media, el catéter central de inserción periférica (PICC), el catéter venoso central y el puerto implantable. Los dispositivos tienen diferentes aplicaciones en cuanto a la duración del tratamiento de quimioterapia, el método de administración y los tipos de agentes quimioterapéuticos.
Dependiendo de la persona, el cáncer, la etapa del cáncer, el tipo de quimioterapia y la dosis, la quimioterapia intravenosa puede administrarse como paciente hospitalizado o ambulatorio. Para la administración de quimioterapia intravenosa continua, frecuente o prolongada, se pueden insertar quirúrgicamente varios sistemas en la vasculatura para mantener el acceso. Los sistemas comúnmente utilizados son la línea Hickman, el Port-a-Cath y la línea PICC. Estos tienen un menor riesgo de infección, son mucho menos propensos a la flebitis o la extravasación y eliminan la necesidad de la inserción repetida de cánulas periféricas.
La perfusión aislada de extremidades (usada a menudo en el melanoma) o la infusión aislada de quimioterapia en el hígado o el pulmón se han usado para tratar algunos tumores. El objetivo principal de estos enfoques es administrar una dosis muy alta de quimioterapia en los sitios del tumor sin causar un daño sistémico abrumador. Estos enfoques pueden ayudar a controlar metástasis solitarias o limitadas, pero por definición no son sistémicos y, por lo tanto, no tratan metástasis distribuidas o micrometástasis.
Las quimioterapias tópicas, como el 5-fluorouracilo, se usan para tratar algunos casos de cáncer de piel no melanoma.
Si el cáncer tiene afectación del sistema nervioso central, o con enfermedad meníngea, se puede administrar quimioterapia intratecal.
Efectos adversos
Las técnicas de quimioterapia tienen una variedad de efectos secundarios que dependen del tipo de medicamentos utilizados. Los medicamentos más comunes afectan principalmente a las células del cuerpo que se dividen rápidamente, como las células sanguíneas y las células que recubren la boca, el estómago y los intestinos. Las toxicidades relacionadas con la quimioterapia pueden ocurrir de forma aguda después de la administración, en cuestión de horas o días, o de forma crónica, de semanas a años.
En muchos casos, se observó un aumento en la tolerabilidad/reducción de los efectos secundarios y una mayor eficacia terapéutica a través del ayuno a corto plazo en los días de terapia, tanto en experimentos con humanos como con animales.
Inmunosupresión y mielosupresión
Prácticamente todos los regímenes quimioterapéuticos pueden causar depresión del sistema inmunitario, a menudo paralizando la médula ósea y provocando una disminución de glóbulos blancos, glóbulos rojos y plaquetas. La anemia y la trombocitopenia pueden requerir una transfusión de sangre. La neutropenia (una disminución del recuento de granulocitos de neutrófilos por debajo de 0,5 x 109/litro) se puede mejorar con G-CSF sintético (factor estimulante de colonias de granulocitos, por ejemplo, filgrastim, lenograstim).
En la mielosupresión muy grave, que ocurre en algunos regímenes, casi todas las células madre de la médula ósea (células que producen glóbulos blancos y rojos) se destruyen, lo que significa alogénico o autólogo los trasplantes de células de médula ósea son necesarios. (En los BMT autólogos, las células se extraen de la persona antes del tratamiento, se multiplican y luego se vuelven a inyectar; en los BMT alógenos, la fuente es un donante). Sin embargo, algunas personas aún desarrollan enfermedades debido a esta interferencia con la médula ósea.
Aunque se recomienda a las personas que reciben quimioterapia que se laven las manos, eviten a las personas enfermas y tomen otras medidas para reducir las infecciones, aproximadamente el 85 % de las infecciones se deben a microorganismos naturales en el tracto gastrointestinal de la persona (incluidos los orales). cavidad) y la piel. Esto puede manifestarse como infecciones sistémicas, como sepsis, o como brotes localizados, como Herpes simplex, culebrilla u otros miembros de Herpesviridea. El riesgo de enfermedad y muerte se puede reducir tomando antibióticos comunes como quinolonas o trimetoprima/sulfametoxazol antes de que aparezca fiebre o signos de infección. Las quinolonas muestran una profilaxis eficaz principalmente con el cáncer hematológico. Sin embargo, en general, por cada cinco personas inmunodeprimidas después de la quimioterapia que toman un antibiótico, se puede prevenir una fiebre; por cada 34 que toman un antibiótico, se puede prevenir una muerte. A veces, los tratamientos de quimioterapia se posponen porque el sistema inmunitario está suprimido a un nivel críticamente bajo.
En Japón, el gobierno ha aprobado el uso de algunos hongos medicinales como Trametes versicolor, para contrarrestar la depresión del sistema inmunológico en personas que reciben quimioterapia.
Trilaciclib es un inhibidor de la cinasa dependiente de ciclina 4/6 aprobado para la prevención de la mielosupresión causada por la quimioterapia. El medicamento se administra antes de la quimioterapia para proteger la función de la médula ósea.
Enterocolitis neutropénica
Debido a la supresión del sistema inmunitario, la enterocolitis neutropénica (tiflitis) es una "complicación gastrointestinal de la quimioterapia potencialmente mortal". La tiflitis es una infección intestinal que puede manifestarse a través de síntomas que incluyen náuseas, vómitos, diarrea, distensión abdominal, fiebre, escalofríos o dolor y sensibilidad abdominal.
La tiflitis es una emergencia médica. Tiene un pronóstico muy malo y, a menudo, es fatal a menos que se reconozca rápidamente y se trate de manera agresiva. El éxito del tratamiento depende del diagnóstico temprano proporcionado por un alto índice de sospecha y el uso de tomografía computarizada, tratamiento no quirúrgico para casos no complicados y, a veces, hemicolectomía derecha electiva para prevenir la recurrencia.
Dolencias gastrointestinales
Náuseas, vómitos, anorexia, diarrea, calambres abdominales y estreñimiento son efectos secundarios comunes de los medicamentos quimioterapéuticos que matan las células que se dividen rápidamente. La desnutrición y la deshidratación pueden resultar cuando el receptor no come o bebe lo suficiente, o cuando la persona vomita con frecuencia debido al daño gastrointestinal. Esto puede resultar en una pérdida de peso rápida, o en ocasiones en un aumento de peso, si la persona come demasiado en un esfuerzo por aliviar las náuseas o la acidez estomacal. El aumento de peso también puede ser causado por algunos medicamentos esteroides. Con frecuencia, estos efectos secundarios se pueden reducir o eliminar con medicamentos antieméticos. La evidencia de certeza baja también indica que los probióticos pueden tener un efecto preventivo y de tratamiento de la diarrea relacionada con la quimioterapia sola y con radioterapia. Sin embargo, es apropiado un alto índice de sospecha, ya que la diarrea y la hinchazón también son síntomas de tiflitis, una emergencia médica muy grave y potencialmente mortal que requiere tratamiento inmediato.
Anemia
La anemia puede ser un resultado combinado causado por la quimioterapia mielosupresora y posibles causas relacionadas con el cáncer, como sangrado, destrucción de células sanguíneas (hemólisis), enfermedad hereditaria, disfunción renal, deficiencias nutricionales o anemia por enfermedad crónica. Los tratamientos para mitigar la anemia incluyen hormonas para aumentar la producción de sangre (eritropoyetina), suplementos de hierro y transfusiones de sangre. La terapia mielosupresora puede causar una tendencia a sangrar con facilidad, lo que lleva a la anemia. Los medicamentos que matan las células que se dividen rápidamente o las células sanguíneas pueden reducir la cantidad de plaquetas en la sangre, lo que puede provocar hematomas y sangrado. Los recuentos de plaquetas extremadamente bajos pueden aumentar temporalmente mediante transfusiones de plaquetas y se están desarrollando nuevos medicamentos para aumentar los recuentos de plaquetas durante la quimioterapia. A veces, los tratamientos de quimioterapia se posponen para permitir que se recuperen los recuentos de plaquetas.
La fatiga puede ser una consecuencia del cáncer o su tratamiento y puede durar meses o años después del tratamiento. Una causa fisiológica de la fatiga es la anemia, que puede ser causada por quimioterapia, cirugía, radioterapia, enfermedad primaria y metastásica o agotamiento nutricional. Se ha encontrado que el ejercicio aeróbico es beneficioso para reducir la fatiga en personas con tumores sólidos.
Náuseas y vómitos
Las náuseas y los vómitos son dos de los efectos secundarios relacionados con el tratamiento del cáncer más temidos por las personas con cáncer y sus familias. En 1983, Coates et al. encontró que las personas que recibían quimioterapia clasificaron las náuseas y los vómitos como el primer y segundo efecto secundario más grave, respectivamente. Hasta el 20% de las personas que recibieron agentes altamente emetogénicos en esta era pospusieron o incluso rechazaron tratamientos potencialmente curativos. Las náuseas y los vómitos inducidos por quimioterapia (NVIQ) son comunes con muchos tratamientos y algunas formas de cáncer. Desde la década de 1990, se han desarrollado y comercializado varias clases novedosas de antieméticos, convirtiéndose en un estándar casi universal en los regímenes de quimioterapia y ayudando a controlar con éxito estos síntomas en muchas personas. La mediación eficaz de estos síntomas desagradables ya veces incapacitantes da como resultado una mayor calidad de vida para el receptor y ciclos de tratamiento más eficientes, debido a una menor interrupción del tratamiento debido a una mejor tolerancia y una mejor salud general.
Pérdida de cabello
La pérdida de cabello (alopecia) puede ser causada por quimioterapia que destruye las células que se dividen rápidamente; otros medicamentos pueden hacer que el cabello se adelgace. En la mayoría de los casos, estos son efectos temporales: el cabello suele volver a crecer unas semanas después del último tratamiento, pero a veces con un cambio de color, textura, grosor o estilo. A veces, el cabello tiene una tendencia a rizarse después de volver a crecer, lo que resulta en "rizos de quimioterapia". La caída severa del cabello ocurre con mayor frecuencia con medicamentos como doxorrubicina, daunorrubicina, paclitaxel, docetaxel, ciclofosfamida, ifosfamida y etopósido. El adelgazamiento o la caída del cabello permanentes pueden resultar de algunos regímenes de quimioterapia estándar.
La caída del cabello inducida por la quimioterapia se produce por un mecanismo no androgénico y puede manifestarse como alopecia total, efluvio telógeno o, con menos frecuencia, alopecia areata. Suele asociarse a tratamiento sistémico por la alta tasa mitótica de los folículos pilosos, y más reversible que la androgénica, aunque pueden darse casos permanentes. La quimioterapia induce la caída del cabello en las mujeres con más frecuencia que en los hombres.
El enfriamiento del cuero cabelludo ofrece un medio para prevenir la caída del cabello tanto permanente como temporal; sin embargo, se han planteado preocupaciones acerca de este método.
Neoplasia secundaria
Puede ocurrir el desarrollo de una neoplasia secundaria después de un tratamiento exitoso con quimioterapia o radioterapia. La neoplasia secundaria más común es la leucemia mieloide aguda secundaria, que se desarrolla principalmente después del tratamiento con agentes alquilantes o inhibidores de la topoisomerasa. Los sobrevivientes de cáncer infantil tienen más de 13 veces más probabilidades de contraer una neoplasia secundaria durante los 30 años posteriores al tratamiento que la población general. No todo este aumento puede atribuirse a la quimioterapia.
Infertilidad
Algunos tipos de quimioterapia son gonadotóxicos y pueden causar infertilidad. Las quimioterapias de alto riesgo incluyen la procarbazina y otros fármacos alquilantes como la ciclofosfamida, la ifosfamida, el busulfán, el melfalán, el clorambucilo y la clormetina. Los medicamentos con riesgo medio incluyen doxorrubicina y análogos de platino como cisplatino y carboplatino. Por otro lado, las terapias con bajo riesgo de gonadotoxicidad incluyen derivados de plantas como vincristina y vinblastina, antibióticos como bleomicina y dactinomicina y antimetabolitos como metotrexato, mercaptopurina y 5-fluorouracilo.
La infertilidad femenina por quimioterapia parece ser secundaria a insuficiencia ovárica prematura por pérdida de folículos primordiales. Esta pérdida no es necesariamente un efecto directo de los agentes quimioterapéuticos, sino que podría deberse a una mayor tasa de iniciación del crecimiento para reemplazar los folículos en desarrollo dañados.
Las personas pueden elegir entre varios métodos de preservación de la fertilidad antes de la quimioterapia, incluida la crioconservación de semen, tejido ovárico, ovocitos o embriones. Como más de la mitad de los pacientes con cáncer son ancianos, este efecto adverso solo es relevante para una minoría de pacientes. Un estudio en Francia entre 1999 y 2011 arrojó que la congelación de embriones antes de la administración de agentes gonadotóxicos a las hembras provocó un retraso del tratamiento en el 34% de los casos, y un nacimiento vivo en el 27% de los casos supervivientes que querían quedar embarazadas, con el tiempo de seguimiento varía entre 1 y 13 años.
Los posibles agentes protectores o atenuantes incluyen los análogos de GnRH, donde varios estudios han demostrado un efecto protector in vivo en humanos, pero algunos estudios no muestran tal efecto. La esfingosina-1-fosfato (S1P) ha mostrado un efecto similar, pero su mecanismo de inhibición de la vía apoptótica de la esfingomielina también puede interferir con la acción de apoptosis de los fármacos de quimioterapia.
En la quimioterapia como régimen de acondicionamiento en el trasplante de células madre hematopoyéticas, un estudio de personas condicionadas con ciclofosfamida sola para la anemia aplásica grave llegó al resultado de que la recuperación ovárica se produjo en todas las mujeres menores de 26 años en el momento del trasplante, pero solo en cinco de 16 mujeres mayores de 26 años.
Teratogenicidad
La quimioterapia es teratogénica durante el embarazo, especialmente durante el primer trimestre, hasta el punto de que generalmente se recomienda el aborto si se encuentra un embarazo en este período durante la quimioterapia. La exposición en el segundo y tercer trimestre generalmente no aumenta el riesgo teratogénico y los efectos adversos sobre el desarrollo cognitivo, pero puede aumentar el riesgo de diversas complicaciones del embarazo y mielosupresión fetal.
En los varones que se han sometido previamente a quimioterapia o radioterapia, no parece haber un aumento de defectos genéticos o malformaciones congénitas en los hijos concebidos después de la terapia. El uso de tecnologías de reproducción asistida y técnicas de micromanipulación podría aumentar este riesgo. En las mujeres que previamente han recibido quimioterapia, los abortos espontáneos y las malformaciones congénitas no aumentan en las concepciones posteriores. Sin embargo, cuando la fertilización in vitro y la criopreservación de embriones se practican entre o poco después del tratamiento, existen posibles riesgos genéticos para los ovocitos en crecimiento y, por lo tanto, se recomienda que los bebés sean evaluados.
Neuropatía periférica
Entre el 30 y el 40 % de las personas que se someten a quimioterapia experimentan neuropatía periférica inducida por quimioterapia (CIPN, por sus siglas en inglés), una afección progresiva, duradera y a menudo irreversible que causa dolor, hormigueo, entumecimiento y sensibilidad al frío, que comienza en las manos y los pies y a veces progresando a los brazos y las piernas. Los medicamentos de quimioterapia asociados con la CIPN incluyen talidomida, epotilonas, alcaloides de la vinca, taxanos, inhibidores del proteosoma y medicamentos a base de platino. La aparición de CIPN, y en qué medida, está determinada por la elección del fármaco, la duración del uso, la cantidad total consumida y si la persona ya tiene neuropatía periférica. Aunque los síntomas son principalmente sensoriales, en algunos casos se ven afectados los nervios motores y el sistema nervioso autónomo. La CIPN a menudo sigue a la primera dosis de quimioterapia y aumenta en gravedad a medida que continúa el tratamiento, pero esta progresión generalmente se estabiliza al finalizar el tratamiento. Los medicamentos a base de platino son la excepción; con estos medicamentos, la sensación puede continuar deteriorándose durante varios meses después del final del tratamiento. Algunos CIPN parecen ser irreversibles. El dolor a menudo se puede controlar con medicamentos u otro tratamiento, pero el entumecimiento suele ser resistente al tratamiento.
Deterioro cognitivo
Algunas personas que reciben quimioterapia reportan fatiga o problemas neurocognitivos no específicos, como la incapacidad para concentrarse; esto a veces se denomina deterioro cognitivo posterior a la quimioterapia, conocido como "quimiocerebro" en las redes sociales y populares.
Síndrome de lisis tumoral
En tumores particularmente grandes y cánceres con recuentos elevados de glóbulos blancos, como linfomas, teratomas y algunas leucemias, algunas personas desarrollan el síndrome de lisis tumoral. La rápida descomposición de las células cancerosas provoca la liberación de sustancias químicas desde el interior de las células. Después de esto, se encuentran altos niveles de ácido úrico, potasio y fosfato en la sangre. Los niveles altos de fosfato inducen hipoparatiroidismo secundario, lo que resulta en niveles bajos de calcio en la sangre. Esto causa daño renal y los altos niveles de potasio pueden causar arritmia cardíaca. Aunque la profilaxis está disponible y, a menudo, se inicia en personas con tumores grandes, este es un efecto secundario peligroso que puede provocar la muerte si no se trata.
Daño a órganos
La cardiotoxicidad (daño cardíaco) es especialmente importante con el uso de fármacos de antraciclina (doxorrubicina, epirrubicina, idarrubicina y doxorrubicina liposomal). Lo más probable es que la causa de esto se deba a la producción de radicales libres en la célula y al posterior daño del ADN. Otros agentes quimioterapéuticos que causan cardiotoxicidad, pero con menor incidencia, son la ciclofosfamida, el docetaxel y la clofarabina.
Muchos fármacos citotóxicos pueden causar hepatotoxicidad (daño hepático). La susceptibilidad de un individuo al daño hepático puede verse alterada por otros factores como el propio cáncer, la hepatitis viral, la inmunosupresión y la deficiencia nutricional. El daño hepático puede consistir en daño a las células hepáticas, síndrome hepático sinusoidal (obstrucción de las venas del hígado), colestasis (donde la bilis no fluye del hígado al intestino) y fibrosis hepática.
La nefrotoxicidad (daño renal) puede ser causada por el síndrome de lisis tumoral y también por los efectos directos de la eliminación del fármaco por los riñones. Diferentes medicamentos afectarán diferentes partes del riñón y la toxicidad puede ser asintomática (solo se observa en análisis de sangre u orina) o puede causar una lesión renal aguda.
La ototoxicidad (daño en el oído interno) es un efecto secundario común de los medicamentos a base de platino que puede producir síntomas como mareos y vértigo. Se ha descubierto que los niños tratados con análogos de platino corren el riesgo de desarrollar pérdida de audición.
Otros efectos secundarios
Los efectos secundarios menos comunes incluyen piel roja (eritema), piel seca, uñas dañadas, boca seca (xerostomía), retención de líquidos e impotencia sexual. Algunos medicamentos pueden desencadenar reacciones alérgicas o pseudoalérgicas.
Los agentes quimioterapéuticos específicos se asocian con toxicidades específicas de órganos, incluidas enfermedades cardiovasculares (p. ej., doxorrubicina), enfermedad pulmonar intersticial (p. ej., bleomicina) y, en ocasiones, neoplasias secundarias (p. ej., terapia con MOPP para la enfermedad de Hodgkin).
El síndrome mano-pie es otro efecto secundario de la quimioterapia citotóxica.
Los problemas nutricionales también se observan con frecuencia en pacientes con cáncer en el momento del diagnóstico y durante el tratamiento con quimioterapia. La investigación sugiere que en los niños y jóvenes que se someten a un tratamiento contra el cáncer, la nutrición parenteral puede ayudar a aumentar el peso y aumentar la ingesta de calorías y proteínas, en comparación con la nutrición enteral.
Limitaciones
La quimioterapia no siempre funciona, e incluso cuando es útil, es posible que no destruya completamente el cáncer. Con frecuencia, las personas no comprenden sus limitaciones. En un estudio de personas a las que se les había diagnosticado cáncer incurable en etapa 4, más de dos tercios de las personas con cáncer de pulmón y más de cuatro quintas partes de las personas con cáncer colorrectal todavía creían que la quimioterapia probablemente curaría su cáncer.
La barrera hematoencefálica plantea un obstáculo para la administración de quimioterapia al cerebro. Esto se debe a que el cerebro tiene un sistema extenso para protegerlo de los químicos dañinos. Los transportadores de fármacos pueden bombear fármacos desde el cerebro y las células de los vasos sanguíneos del cerebro hacia el líquido cefalorraquídeo y la circulación sanguínea. Estos transportadores bombean la mayoría de los medicamentos de quimioterapia, lo que reduce su eficacia para el tratamiento de tumores cerebrales. Solo los agentes alquilantes lipofílicos pequeños, como la lomustina o la temozolomida, pueden atravesar esta barrera hematoencefálica.
Los vasos sanguíneos de los tumores son muy diferentes de los que se observan en los tejidos normales. A medida que un tumor crece, las células tumorales más alejadas de los vasos sanguíneos pierden oxígeno (hipoxia). Para contrarrestar esto, envían una señal para que crezcan nuevos vasos sanguíneos. La vasculatura tumoral recién formada está mal formada y no proporciona un suministro de sangre adecuado a todas las áreas del tumor. Esto conduce a problemas con la administración de medicamentos porque el sistema circulatorio administrará muchos medicamentos al tumor.
Resistencia
La resistencia es una de las principales causas de fracaso del tratamiento con fármacos quimioterapéuticos. Existen algunas causas posibles de resistencia en el cáncer, una de las cuales es la presencia de pequeñas bombas en la superficie de las células cancerosas que mueven activamente la quimioterapia desde el interior de la célula hacia el exterior. Las células cancerosas producen grandes cantidades de estas bombas, conocidas como glicoproteína p, para protegerse de la quimioterapia. La investigación sobre glicoproteína p y otras bombas de eflujo de quimioterapia similares está actualmente en curso. Se están investigando medicamentos para inhibir la función de la glicoproteína p, pero debido a la toxicidad y las interacciones con los medicamentos contra el cáncer, su desarrollo ha sido difícil. Otro mecanismo de resistencia es la amplificación de genes, un proceso en el que las células cancerosas producen múltiples copias de un gen. Esto supera el efecto de los fármacos que reducen la expresión de los genes implicados en la replicación. Con más copias del gen, el fármaco no puede evitar toda la expresión del gen y, por lo tanto, la célula puede restaurar su capacidad proliferativa. Las células cancerosas también pueden causar defectos en las vías celulares de apoptosis (muerte celular programada). Como la mayoría de los medicamentos de quimioterapia matan las células cancerosas de esta manera, la apoptosis defectuosa permite la supervivencia de estas células, haciéndolas resistentes. Muchos medicamentos de quimioterapia también causan daños en el ADN, que pueden repararse mediante enzimas en la célula que llevan a cabo la reparación del ADN. La regulación al alza de estos genes puede superar el daño del ADN y prevenir la inducción de la apoptosis. Pueden ocurrir mutaciones en genes que producen proteínas diana de fármacos, como la tubulina, que impiden que los fármacos se unan a la proteína, lo que genera resistencia a este tipo de fármacos. Los medicamentos utilizados en la quimioterapia pueden inducir estrés celular, lo que puede destruir una célula cancerosa; sin embargo, bajo ciertas condiciones, el estrés de las células puede inducir cambios en la expresión génica que permiten la resistencia a varios tipos de fármacos. En el cáncer de pulmón, se cree que el factor de transcripción NFκB desempeña un papel en la resistencia a la quimioterapia, a través de vías inflamatorias.
Citotóxicos y terapias dirigidas
Las terapias dirigidas son una clase relativamente nueva de medicamentos contra el cáncer que pueden superar muchos de los problemas observados con el uso de citotóxicos. Se dividen en dos grupos: molécula pequeña y anticuerpos. La toxicidad masiva observada con el uso de citotóxicos se debe a la falta de especificidad celular de los fármacos. Matarán cualquier célula, tumoral o normal, que se divida rápidamente. Las terapias dirigidas están diseñadas para afectar las proteínas celulares o los procesos que utilizan las células cancerosas. Esto permite una dosis alta para los tejidos cancerosos con una dosis relativamente baja para otros tejidos. Aunque los efectos secundarios suelen ser menos graves que los que se observan con los quimioterapéuticos citotóxicos, pueden ocurrir efectos potencialmente mortales. Inicialmente, se suponía que las terapias dirigidas eran únicamente selectivas para una proteína. Ahora está claro que a menudo hay una variedad de objetivos proteicos a los que el fármaco puede unirse. Un objetivo de ejemplo para la terapia dirigida es la proteína BCR-ABL1 producida a partir del cromosoma Filadelfia, una lesión genética que se encuentra comúnmente en la leucemia mielógena crónica y en algunos pacientes con leucemia linfoblástica aguda. Esta proteína de fusión tiene actividad enzimática que puede ser inhibida por imatinib, un fármaco de molécula pequeña.
Mecanismo de acción
El cáncer es el crecimiento descontrolado de células junto con un comportamiento maligno: invasión y metástasis (entre otras características). Es causada por la interacción entre la susceptibilidad genética y los factores ambientales. Estos factores conducen a acumulaciones de mutaciones genéticas en oncogenes (genes que controlan la tasa de crecimiento de las células) y genes supresores de tumores (genes que ayudan a prevenir el cáncer), lo que le da a las células cancerosas sus características malignas, como el crecimiento descontrolado.
En un sentido amplio, la mayoría de los fármacos quimioterapéuticos actúan alterando la mitosis (división celular) y atacando eficazmente las células que se dividen rápidamente. Como estos fármacos dañan las células, se denominan citotóxicos. Previenen la mitosis por varios mecanismos, incluido el daño del ADN y la inhibición de la maquinaria celular involucrada en la división celular. Una teoría de por qué estos medicamentos matan las células cancerosas es que inducen una forma programada de muerte celular conocida como apoptosis.
Como la quimioterapia afecta la división celular, los tumores con altas tasas de crecimiento (como la leucemia mielógena aguda y los linfomas agresivos, incluida la enfermedad de Hodgkin) son más sensibles a la quimioterapia, ya que una mayor proporción de las células objetivo se someten a división en cualquier momento. Los tumores malignos con tasas de crecimiento más lentas, como los linfomas indolentes, tienden a responder a la quimioterapia de forma mucho más modesta. Los tumores heterogéneos también pueden mostrar sensibilidades variables a los agentes de quimioterapia, según las poblaciones subclonales dentro del tumor.
Las células del sistema inmunitario también realizan contribuciones cruciales a los efectos antitumorales de la quimioterapia. Por ejemplo, los fármacos quimioterapéuticos oxaliplatino y ciclofosfamida pueden hacer que las células tumorales mueran de una manera que sea detectable por el sistema inmunitario (llamada muerte celular inmunogénica), que moviliza las células inmunitarias con funciones antitumorales. Los medicamentos quimioterapéuticos que causan la muerte de células tumorales inmunogénicas del cáncer pueden hacer que los tumores que no responden sean sensibles a la terapia de punto de control inmunitario.
Otros usos
Algunos medicamentos de quimioterapia se usan en enfermedades distintas del cáncer, como los trastornos autoinmunes y la discrasia de células plasmáticas no cancerosas. En algunos casos se suelen utilizar a dosis más bajas, lo que significa que los efectos secundarios se minimizan, mientras que en otros casos se utilizan dosis similares a las utilizadas para tratar el cáncer. El metotrexato se usa en el tratamiento de la artritis reumatoide (AR), la psoriasis, la espondilitis anquilosante y la esclerosis múltiple. Se cree que la respuesta antiinflamatoria que se observa en la AR se debe a los aumentos de adenosina, que provoca inmunosupresión; efectos sobre las vías de la enzima inmunorreguladora ciclooxigenasa-2; reducción de citocinas proinflamatorias; y propiedades antiproliferativas. Aunque el metotrexato se usa para tratar tanto la esclerosis múltiple como la espondilitis anquilosante, su eficacia en estas enfermedades aún es incierta. La ciclofosfamida a veces se usa para tratar la nefritis lúpica, un síntoma común del lupus eritematoso sistémico. La dexametasona junto con bortezomib o melfalán se usa comúnmente como tratamiento para la amiloidosis AL. Recientemente, la bortezomid en combinación con ciclofosfamida y dexametasona también se ha mostrado prometedora como tratamiento para la amiloidosis AL. Otros medicamentos utilizados para tratar el mieloma, como la lenalidomida, se han mostrado prometedores en el tratamiento de la amiloidosis AL.
Los medicamentos de quimioterapia también se usan en regímenes de acondicionamiento antes del trasplante de médula ósea (trasplante de células madre hematopoyéticas). Los regímenes de acondicionamiento se utilizan para suprimir el sistema inmunitario del receptor a fin de permitir que se injerte un trasplante. La ciclofosfamida es un fármaco citotóxico común que se usa de esta manera y, a menudo, se usa junto con la irradiación corporal total. Los medicamentos quimioterapéuticos se pueden usar en dosis altas para eliminar de forma permanente las células de la médula ósea del receptor (acondicionamiento mieloablativo) o en dosis más bajas que evitarán la pérdida permanente de la médula ósea (acondicionamiento no mieloablativo y de intensidad reducida). Cuando se usa en un entorno no oncológico, el tratamiento todavía se llama "quimioterapia" y, a menudo, se realiza en los mismos centros de tratamiento que se usan para las personas con cáncer.
Exposición ocupacional y manejo seguro
En la década de 1970, los medicamentos antineoplásicos (quimioterapia) se identificaron como peligrosos y, desde entonces, la Sociedad Estadounidense de Farmacéuticos del Sistema de Salud (ASHP) ha introducido el concepto de medicamentos peligrosos después de publicar una recomendación en 1983 con respecto al manejo de medicamentos peligrosos. La adaptación de las reglamentaciones federales se produjo cuando la Administración de Salud y Seguridad Ocupacional de EE. UU. (OSHA) publicó por primera vez sus pautas en 1986 y luego las actualizó en 1996, 1999 y, más recientemente, en 2006.
El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha estado realizando una evaluación en el lugar de trabajo desde entonces con respecto a estos medicamentos. La exposición laboral a los fármacos antineoplásicos se ha relacionado con múltiples efectos sobre la salud, incluida la infertilidad y posibles efectos cancerígenos. El informe de alerta de NIOSH ha informado de algunos casos, como uno en el que a una farmacéutica se le diagnosticó carcinoma papilar de células de transición. Doce años antes de que a la farmacéutica le diagnosticaran la afección, había trabajado durante 20 meses en un hospital donde se encargaba de preparar múltiples fármacos antineoplásicos. La farmacéutica no tenía ningún otro factor de riesgo de cáncer, por lo que su cáncer se atribuyó a la exposición a los fármacos antineoplásicos, aunque en la literatura no se ha establecido una relación de causa y efecto. Otro caso ocurrió cuando se cree que un mal funcionamiento en el gabinete de bioseguridad expuso al personal de enfermería a medicamentos antineoplásicos. Las investigaciones revelaron evidencia de biomarcadores genotóxicos dos y nueve meses después de esa exposición.
Vías de exposición
Los fármacos antineoplásicos generalmente se administran por vía intravenosa, intramuscular, intratecal o subcutánea. En la mayoría de los casos, antes de administrar el medicamento al paciente, varios trabajadores deben prepararlo y manipularlo. Cualquier trabajador que participe en la manipulación, preparación o administración de medicamentos, o en la limpieza de objetos que hayan estado en contacto con medicamentos antineoplásicos, está potencialmente expuesto a medicamentos peligrosos. Los trabajadores de la salud están expuestos a los medicamentos en diferentes circunstancias, como cuando los farmacéuticos y los técnicos de farmacia preparan y manipulan medicamentos antineoplásicos y cuando las enfermeras y los médicos administran los medicamentos a los pacientes. Además, quienes son responsables de desechar los medicamentos antineoplásicos en los establecimientos de salud también corren el riesgo de exposición.
Se cree que la exposición dérmica es la principal vía de exposición debido al hecho de que se han encontrado cantidades significativas de agentes antineoplásicos en los guantes usados por los trabajadores de la salud que preparan, manipulan y administran los agentes. Otra ruta notable de exposición es la inhalación de las drogas' vapores Múltiples estudios han investigado la inhalación como vía de exposición y, aunque las muestras de aire no han mostrado niveles peligrosos, sigue siendo una vía potencial de exposición. La ingestión mano a boca es una vía de exposición menos probable en comparación con otras debido a las normas higiénicas exigidas en las instituciones de salud. Sin embargo, sigue siendo una ruta potencial, especialmente en el lugar de trabajo, fuera de un instituto de salud. Uno también puede estar expuesto a estas drogas peligrosas a través de inyecciones por pinchazos de agujas. La investigación realizada en esta área ha establecido que la exposición ocupacional ocurre al examinar la evidencia en múltiples muestras de orina de los trabajadores de la salud.
Peligros
Los medicamentos peligrosos exponen a los trabajadores de la salud a graves riesgos para la salud. Muchos estudios muestran que los medicamentos antineoplásicos pueden tener muchos efectos secundarios en el sistema reproductivo, como pérdida fetal, malformación congénita e infertilidad. Los trabajadores de la salud que están expuestos a medicamentos antineoplásicos en muchas ocasiones tienen resultados reproductivos adversos, como abortos espontáneos, mortinatos y malformaciones congénitas. Además, los estudios han demostrado que la exposición a estos medicamentos provoca irregularidades en el ciclo menstrual. Los medicamentos antineoplásicos también pueden aumentar el riesgo de problemas de aprendizaje entre los hijos de los trabajadores de la salud que están expuestos a estas sustancias peligrosas.
Además, estos fármacos tienen efectos cancerígenos. En las últimas cinco décadas, múltiples estudios han demostrado los efectos cancerígenos de la exposición a fármacos antineoplásicos. De manera similar, se han realizado estudios de investigación que vinculan a los agentes alquilantes con humanos que desarrollan leucemias. Los estudios han informado un riesgo elevado de cáncer de mama, cáncer de piel no melanoma y cáncer de recto entre las enfermeras que están expuestas a estos medicamentos. Otras investigaciones revelaron que existe un efecto genotóxico potencial de los medicamentos antineoplásicos para los trabajadores en entornos de atención médica.
Manipulación segura en entornos sanitarios
A partir de 2018, no se establecieron límites de exposición ocupacional para los medicamentos antineoplásicos, es decir, OSHA o la Conferencia Estadounidense de Higienistas Industriales Gubernamentales (ACGIH) no han establecido pautas de seguridad en el lugar de trabajo.
Preparación
NIOSH recomienda usar un gabinete ventilado diseñado para disminuir la exposición de los trabajadores. Además, recomienda la capacitación de todo el personal, el uso de gabinetes, la implementación de una evaluación inicial de la técnica del programa de seguridad y el uso de guantes y batas de protección al abrir envases de medicamentos, manipular viales o etiquetar. Al usar equipo de protección personal, se deben inspeccionar los guantes en busca de defectos físicos antes de usarlos y siempre usar guantes dobles y batas protectoras. Los trabajadores de la salud también deben lavarse las manos con agua y jabón antes y después de trabajar con medicamentos antineoplásicos, cambiarse los guantes cada 30 minutos o cada vez que se pinchen y desecharlos inmediatamente en un contenedor de desechos de quimioterapia.
Las batas utilizadas deben ser batas desechables de polipropileno recubierto de polietileno. Al usar batas, las personas deben asegurarse de que las batas estén cerradas y tengan mangas largas. Cuando se realiza la preparación, el producto final debe sellarse completamente en una bolsa de plástico.
El trabajador de la salud también debe limpiar todos los contenedores de desechos dentro del gabinete ventilado antes de sacarlos del gabinete. Finalmente, los trabajadores deben quitarse toda la ropa de protección y colocarla en una bolsa para su eliminación dentro del gabinete ventilado.
Administración
Los medicamentos solo deben administrarse utilizando dispositivos médicos de protección, como listas de agujas y sistemas y técnicas cerrados, como el cebado de tubos intravenosos por parte del personal de farmacia dentro de un gabinete ventilado. Los trabajadores siempre deben usar equipo de protección personal, como guantes dobles, gafas protectoras y batas protectoras, al abrir la bolsa exterior y ensamblar el sistema de administración para administrar el medicamento al paciente, y al desechar todo el material utilizado en la administración de los medicamentos.
Los trabajadores del hospital nunca deben quitar los tubos de una bolsa intravenosa que contenga un fármaco antineoplásico y, al desconectar los tubos del sistema, deben asegurarse de que se hayan enjuagado completamente. Después de retirar la bolsa IV, los trabajadores deben colocarla junto con otros artículos desechables directamente en el contenedor amarillo de desechos de quimioterapia con la tapa cerrada. El equipo de protección debe retirarse y colocarse en un contenedor desechable para desechos de quimioterapia. Una vez hecho esto, se deben colocar en bolsas dobles los desechos de la quimioterapia antes o después de quitarse los guantes interiores. Además, siempre se debe lavar las manos con agua y jabón antes de abandonar el lugar de administración del medicamento.
Formación de empleados
Todos los empleados cuyos trabajos en centros de salud los expongan a medicamentos peligrosos deben recibir capacitación. La capacitación debe incluir al personal de envío y recepción, personal de limpieza, farmacéuticos, asistentes y todas las personas involucradas en el transporte y almacenamiento de medicamentos antineoplásicos. Estas personas deben recibir información y capacitación para informarles sobre los peligros de las drogas presentes en sus áreas de trabajo. Deben estar informados y capacitados sobre las operaciones y los procedimientos en sus áreas de trabajo donde pueden encontrar peligros, los diferentes métodos utilizados para detectar la presencia de drogas peligrosas y cómo se liberan los peligros, y los peligros físicos y para la salud de las drogas, incluida su reproducción. y potencial de riesgo cancerígeno. Además, deben ser informados y capacitados sobre las medidas que deben tomar para evitar y protegerse de estos peligros. Esta información debe proporcionarse cuando los trabajadores de la salud entren en contacto con los medicamentos, es decir, realicen la asignación inicial en un área de trabajo con medicamentos peligrosos. Además, también se debe proporcionar capacitación cuando surgen nuevos peligros, así como cuando se introducen nuevos medicamentos, procedimientos o equipos.
Limpieza y eliminación de residuos
Al realizar la limpieza y descontaminación del área de trabajo donde se usan medicamentos antineoplásicos, se debe asegurar que haya suficiente ventilación para evitar la acumulación de concentraciones de medicamentos en el aire. Al limpiar la superficie de trabajo, los trabajadores del hospital deben usar agentes de desactivación y limpieza antes y después de cada actividad, así como al final de sus turnos. La limpieza debe realizarse siempre con guantes de doble protección y batas desechables. Después de que los empleados terminen de limpiar, deben desechar los artículos utilizados en la actividad en un contenedor amarillo para desechos de quimioterapia mientras aún usan guantes protectores. Después de quitarse los guantes, deben lavarse bien las manos con agua y jabón. Todo lo que entre en contacto o tenga rastros de los medicamentos antineoplásicos, como agujas, viales vacíos, jeringas, batas y guantes, debe colocarse en el contenedor de desechos de quimioterapia.
Control de derrames
Debe existir una política escrita en caso de derrame de productos antineoplásicos. La política debe abordar la posibilidad de varios tamaños de derrames, así como el procedimiento y el equipo de protección personal requerido para cada tamaño. Un trabajador capacitado debe manejar un derrame grande y siempre desechar todos los materiales de limpieza en el contenedor de desechos químicos de acuerdo con las reglamentaciones de la EPA, no en un contenedor amarillo de desechos de quimioterapia.
Seguimiento ocupacional
Debe establecerse un programa de vigilancia médica. En caso de exposición, los profesionales de la salud ocupacional deben solicitar un historial detallado y realizar un examen físico completo. Deben analizar la orina del trabajador potencialmente expuesto mediante una tira reactiva de orina o un examen microscópico, principalmente en busca de sangre, ya que se sabe que varios medicamentos antineoplásicos causan daño a la vejiga.
La mutagenicidad urinaria es un marcador de exposición a fármacos antineoplásicos que Falck y sus colegas utilizaron por primera vez en 1979 y utiliza ensayos de mutagenicidad bacteriana. Además de ser inespecífica, la prueba puede verse influida por factores extraños como la ingesta dietética y el tabaquismo y, por lo tanto, se usa con moderación. Sin embargo, la prueba desempeñó un papel importante en el cambio del uso de cabinas de flujo horizontal a cabinas de seguridad biológica de flujo vertical durante la preparación de fármacos antineoplásicos porque las primeras exponían a los trabajadores de la salud a altos niveles de fármacos. Esto cambió el manejo de las drogas y redujo efectivamente el control de los trabajadores. exposición a fármacos antineoplásicos.
Los biomarcadores de exposición a fármacos antineoplásicos suelen incluir platino en orina, metotrexato, ciclofosfamida e ifosfamida en orina, y el metabolito urinario de 5-fluorouracilo. Además de esto, existen otros fármacos que se utilizan para medir las drogas directamente en la orina, aunque rara vez se utilizan. Una medición de estos fármacos directamente en la orina es un signo de altos niveles de exposición y de que se está absorbiendo el fármaco por inhalación o por vía dérmica.
Agentes disponibles
Existe una extensa lista de agentes antineoplásicos. Se han utilizado varios esquemas de clasificación para subdividir los medicamentos utilizados para el cáncer en varios tipos diferentes.
Historia
El primer uso de medicamentos de molécula pequeña para tratar el cáncer fue a principios del siglo XX, aunque los químicos específicos que se usaron por primera vez no estaban destinados originalmente para ese propósito. El gas mostaza se usó como agente de guerra química durante la Primera Guerra Mundial y se descubrió que era un potente supresor de la hematopoyesis (producción de sangre). Una familia similar de compuestos conocidos como mostazas de nitrógeno se estudió más durante la Segunda Guerra Mundial en la Escuela de Medicina de Yale. Se razonó que un agente que dañara los glóbulos blancos de rápido crecimiento podría tener un efecto similar sobre el cáncer. Por lo tanto, en diciembre de 1942, a varias personas con linfomas avanzados (cánceres del sistema linfático y de los ganglios linfáticos) se les administró el medicamento por vía intravenosa, en lugar de inhalar el gas irritante. Su mejoría, aunque temporal, fue notable. Al mismo tiempo, durante una operación militar en la Segunda Guerra Mundial, luego de un ataque aéreo alemán en el puerto italiano de Bari, varios cientos de personas quedaron expuestas accidentalmente al gas mostaza, que había sido transportado allí por las fuerzas aliadas para prepararse para posibles represalias en el evento. del uso alemán de la guerra química. Más tarde se descubrió que los sobrevivientes tenían recuentos de glóbulos blancos muy bajos. Después de que terminó la Segunda Guerra Mundial y se desclasificaron los informes, las experiencias convergieron y llevaron a los investigadores a buscar otras sustancias que pudieran tener efectos similares contra el cáncer. El primer fármaco de quimioterapia que se desarrolló a partir de esta línea de investigación fue la mostina. Desde entonces, se han desarrollado muchos otros medicamentos para tratar el cáncer, y el desarrollo de medicamentos se ha convertido en una industria multimillonaria, aunque los principios y las limitaciones de la quimioterapia descubiertos por los primeros investigadores aún se aplican.
El término quimioterapia
La palabra quimioterapia sin un modificador generalmente se refiere al tratamiento del cáncer, pero su significado histórico era más amplio. El término fue acuñado a principios del siglo XX por Paul Ehrlich en el sentido de cualquier uso de productos químicos para tratar cualquier enfermedad (quimio- + -terapia), como el uso de antibióticos (quimioterapia antibacteriana). Ehrlich no se mostró optimista de que se encontrarían fármacos de quimioterapia efectivos para el tratamiento del cáncer. El primer agente quimioterapéutico moderno fue la arsfenamina, un compuesto de arsénico descubierto en 1907 y utilizado para tratar la sífilis. Esto fue seguido más tarde por las sulfonamidas (sulfonamidas) y la penicilina. En el uso actual, el sentido "cualquier tratamiento de la enfermedad con medicamentos" a menudo se expresa con la palabra farmacoterapia.
Ventas
Los 10 medicamentos contra el cáncer más vendidos (en términos de ingresos) de 2013:
| No. | 2013 Global Sales | INN | Nombres comerciales | Titular de autorización de comercialización | Indicaciones |
|---|---|---|---|---|---|
| 1 | 7.780 millones de dólares | Rituximab | Rituxan, MabThera | Roche, Pharmstandard | linfoma no Hodgkin, CLL |
| 2 | 6.750 millones de dólares | Bevacizumab | Avastin | Roche | Cáncer de colorrectal, pulmonar, ovario y cerebro |
| 3 | 6.56 millones de dólares | Trastuzumab | Herceptin | Roche | Cáncer de mama, esófago y estómago |
| 4 | 4.69 millones de dólares | Imatinib | Gleevec | Novartis | Leucemia, cáncer de IG |
| 5 | 1.009 millones de dólares | Lenalidomide | Revlimid | Celgene, Pharmstandard | Múltiple mieloma, linfoma de células del manto |
| 6 | 2.700 millones de dólares | Pemetrexed | Alimta | Eli Lilly | Cáncer de pulmón |
| 7 | 2.600 millones de dólares | Bortezomib | Velcade | Johnson, Takeda, Pharmstandard | mieloma múltiple |
| 8 | 1.880 millones de dólares | Cetuximab | Erbitux | Merck KGaA, Bristol-Myers Squibb | Cáncer de colon y cabeza y cuello |
| 9 | 1.730 millones de dólares | Leuprorelin | Lupron, Eligard | AbbVie y Takeda; Sanofi y Astellas Pharma | Cáncer de próstata y ovario |
| 10 | 1.700 millones de dólares | Abiraterone | Zytiga | Johnson | Cáncer de próstata |
Investigación
Terapias dirigidas
Los vehículos de administración especialmente dirigidos tienen como objetivo aumentar los niveles efectivos de quimioterapia para las células tumorales mientras reducen los niveles efectivos para otras células. Esto debería dar como resultado un aumento de la destrucción del tumor o una reducción de la toxicidad o ambos.
Conjugados anticuerpo-fármaco
Los conjugados de fármaco-anticuerpo (ADC) comprenden un anticuerpo, un fármaco y un conector entre ellos. El anticuerpo se dirigirá a una proteína expresada preferentemente en las células tumorales (conocida como antígeno tumoral) o en células que el tumor puede utilizar, como las células endoteliales de los vasos sanguíneos. Se unen al antígeno tumoral y se internalizan, donde el enlazador libera el fármaco en la célula. Estos vehículos de administración especialmente dirigidos varían en su estabilidad, selectividad y elección del objetivo, pero, en esencia, todos tienen como objetivo aumentar la dosis efectiva máxima que se puede administrar a las células tumorales. La toxicidad sistémica reducida significa que también se pueden usar en personas que están más enfermas y que pueden transportar nuevos agentes quimioterapéuticos que habrían sido demasiado tóxicos para administrarse a través de enfoques sistémicos tradicionales.
El primer fármaco aprobado de este tipo fue gemtuzumab ozogamicina (Mylotarg), lanzado por Wyeth (ahora Pfizer). El medicamento fue aprobado para tratar la leucemia mieloide aguda. Otros dos medicamentos, trastuzumab emtansine y brentuximab vedotin, se encuentran en ensayos clínicos avanzados, y al último se le otorgó una aprobación acelerada para el tratamiento del linfoma de Hodgkin refractario y el linfoma anaplásico de células grandes sistémico.
Nanopartículas
Las nanopartículas son partículas de tamaño de 1 a 1000 nanómetros (nm) que pueden promover la selectividad tumoral y ayudar a administrar fármacos de baja solubilidad. Las nanopartículas se pueden orientar de forma pasiva o activa. La focalización pasiva explota la diferencia entre los vasos sanguíneos tumorales y los vasos sanguíneos normales. Los vasos sanguíneos en los tumores tienen "fugas" porque tienen brechas de 200 a 2000 nm, que permiten que las nanopartículas escapen al tumor. La orientación activa utiliza moléculas biológicas (anticuerpos, proteínas, ADN y ligandos de receptores) para dirigir preferentemente las nanopartículas a las células tumorales. Hay muchos tipos de sistemas de suministro de nanopartículas, como sílice, polímeros, liposomas y partículas magnéticas. Las nanopartículas hechas de material magnético también se pueden usar para concentrar agentes en los sitios del tumor usando un campo magnético aplicado externamente. Han surgido como un vehículo útil en la administración magnética de fármacos para agentes poco solubles como el paclitaxel.
Electroquimioterapia
La electroquimioterapia es el tratamiento combinado en el que la inyección de un fármaco quimioterapéutico es seguida por la aplicación local de pulsos eléctricos de alto voltaje en el tumor. El tratamiento permite que los medicamentos quimioterapéuticos, que de otro modo no pueden o apenas atraviesan la membrana de las células (como la bleomicina y el cisplatino), ingresen a las células cancerosas. Por tanto, se consigue una mayor eficacia del tratamiento antitumoral.
La electroquimioterapia clínica se ha utilizado con éxito para el tratamiento de tumores cutáneos y subcutáneos independientemente de su origen histológico. El método ha sido reportado como seguro, simple y altamente efectivo en todos los informes sobre el uso clínico de la electroquimioterapia. De acuerdo con el proyecto ESOPE (European Standard Operating Procedures of Electrochemotherapy), se elaboraron los Standard Operating Procedures (SOP) para electroquimioterapia, basados en la experiencia de los principales centros oncológicos europeos en electroquimioterapia. Recientemente, se han desarrollado nuevas modalidades de electroquimioterapia para el tratamiento de tumores internos mediante procedimientos quirúrgicos, vías endoscópicas o enfoques percutáneos para acceder al área de tratamiento.
Terapia de hipertermia
La terapia de hipertermia es un tratamiento térmico para el cáncer que puede ser una herramienta poderosa cuando se usa en combinación con quimioterapia (termoquimioterapia) o radiación para el control de una variedad de cánceres. El calor se puede aplicar localmente en el sitio del tumor, lo que dilatará los vasos sanguíneos del tumor, lo que permitirá que entre más medicamento quimioterapéutico en el tumor. Además, la membrana de la célula tumoral se volverá más porosa, lo que permitirá que más medicamento quimioterapéutico ingrese a la célula tumoral.
También se ha demostrado que la hipertermia ayuda a prevenir o revertir la "quimiorresistencia." La resistencia a la quimioterapia a veces se desarrolla con el tiempo a medida que los tumores se adaptan y pueden superar la toxicidad del medicamento de quimioterapia. "Superar la quimiorresistencia se ha estudiado ampliamente en el pasado, especialmente usando células resistentes a CDDP. Con respecto al beneficio potencial de que las células resistentes a los medicamentos puedan ser reclutadas para una terapia eficaz mediante la combinación de quimioterapia con hipertermia, fue importante demostrar que la quimiorresistencia contra varios medicamentos contra el cáncer (p. ej., mitomicina C, antraciclinas, BCNU, melfalán), incluido el CDDP, podría revertirse. al menos parcialmente por la adición de calor.
Otros animales
La quimioterapia se usa en medicina veterinaria de manera similar a como se usa en medicina humana.
Contenido relacionado
Síndrome X frágil
Hipócrates
Síndrome de Down