Química del organopaladio
Química del organopaladio es una rama de la química organometálica que se ocupa de los compuestos orgánicos del paladio y sus reacciones. El paladio se utiliza a menudo como catalizador en la reducción de alquenos y alquinos con hidrógeno. Este proceso implica la formación de un enlace covalente paladio-carbono. El paladio también destaca en las reacciones de acoplamiento carbono-carbono, como se demuestra en las reacciones en tándem.
Cronología de la química del organopaladio
- 1873 - A. N. Zaitsev reporta reducción de benzofenona sobre el palladio con hidrógeno.
- 1894 - Phillips informa que el cloruro palladium(II) reduce al metal palladio por contacto con etileno.
- 1907 - La tecnología Autoclave introducida por Vladimir Ipatieff hace posible realizar hidrógeno de alta presión.
- 1956 - En el proceso de Wacker el etileno y el oxígeno reaccionan al acetaldehído con catalizador PdCl2/CuCl2
- 1957 - Tetrakis(triphenylphosphine)palladium(0) es reportado por Malatesta y Angoletta.
- 1972 - La reacción Heck es una reacción de acoplamiento de una halogenida con un olefin. Los intermediarios Pd(0) están implicados.
- 1973 - La alquilación allílica asimétrica Trost es una sustitución nucleófila.
- 1975 - El acoplamiento Sonogashira es una reacción de acoplamiento de alquinos terminales con aryl o halides vinilo.
- 1994 - La amnación de Buchwald-Hartwig con capitalización Pd-catalyzed para las reacciones de formación de bonos C-N.

Palladium(II)
Complejos de alquenos
A diferencia de Ni(II), pero similar a Pt(II), los halides Pd(II) forman una variedad de complejos de alkene. El ejemplo principal es dichloro(1,5‐cyclooctadiene)palladium. En este complejo, el diene es fácilmente desplazado, lo que lo convierte en un precursor favorable a los catalizadores. En el proceso industrialmente importante de Wacker, el etileno se convierte en acetaldehído mediante ataque nucleófilo de hidroxido en un intermedio Pd(II)-etileno seguido de la formación de un complejo de alcohol vinilo. Los ligandos Fullerene también se unen con palladium(II).

El acetato de paladio (II) y compuestos relacionados son reactivos comunes porque los carboxilatos son buenos grupos salientes con propiedades básicas. Por ejemplo, se ha demostrado que el trifluoroacetato de paladio es eficaz en la descarboxilación aromática:
Complejos de alilo
El complejo icónico de esta serie es el dímero de cloruro de alilpaladio (APC). Los compuestos alílicos con grupos salientes adecuados reaccionan con sales de paladio (II) para formar complejos pi-alílicos que tienen hapticidad 3. Estos intermedios también reaccionan con nucleófilos, por ejemplo, carbaniones derivados de ésteres de malonato o con aminas en aminación alílica, como se muestra a continuación.
Los intermedios de alilpaladio también aparecen en la alquilación alílica asimétrica de Trost y en el reordenamiento de Carroll y una variación oxo en la oxidación de Saegusa.
Complejos unidos por enlaces sigma de paladio-carbono
Varios grupos orgánicos pueden unirse al paladio y formar complejos estables con enlaces sigma. La estabilidad de los enlaces en términos de energía de disociación del enlace sigue la tendencia: Pd-Alquinilo > Pd-Vinilo ≈ Pd-Arilo> Pd-Alquilo y la longitud del enlace metal-carbono cambia en la dirección opuesta: Pd-Alquinilo < Pd-Vinilo ≈ Pd-Arilo < Pd-alquilo.
Compuestos de paladio(0)
Los compuestos de Pd(0) cerovalentes incluyen tris(dibencilidenacetona)dipaladio(0) y tetrakis(trifenilfosfina)paladio(0). Estos complejos reaccionan con halocarbono R-X en adición oxidativa a intermedios R-Pd-X con enlaces covalentes Pd-C. Esta química forma la base de una gran clase de reacciones orgánicas llamadas reacciones de acoplamiento (ver reacciones de acoplamiento catalizadas por paladio). Un ejemplo es la reacción de Sonogashira:
Organopaladio(IV)
El primer compuesto organopalladio(IV) se describió en 1986. Este complejo es Me3Pd(IV)(I)bpy (bpy = bidentado 2,2&# 39;-ligando de bipiridina) Se sintetizó mediante adición oxidativa de yoduro de metilo a Me2Pd(II)bpy.
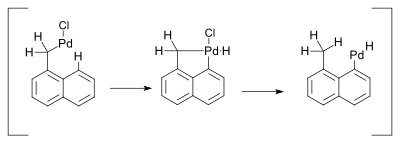
Los compuestos de paladio deben su reactividad a la facilidad de interconversión entre los intermediarios de Pd(0) y paladio(II). Sin embargo, no hay pruebas concluyentes de la implicación de las conversiones de Pd(II) a Pd(IV) en reacciones organometálicas mediadas por paladio. En 2000 se describió una reacción que invocaba tal mecanismo y se refería a una reacción de Heck. Esta reacción estuvo acompañada de un desplazamiento de 1,5 hidrógeno en presencia de aminas:
Se previó que el cambio de hidruro tendría lugar a través de un metalaciclo de Pd(IV):
En un trabajo relacionado, el intermediario asociado con el cambio de hidruro sigue siendo Pd(II):
y en otro trabajo (una síntesis novedosa de indoles con dos migraciones de Pd) se postulan equilibrios entre diferentes paladaciclos:
y en ciertos acoplamientos intramoleculares se demostró valor sintético independientemente del estado de oxidación:
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar