Proteólisis
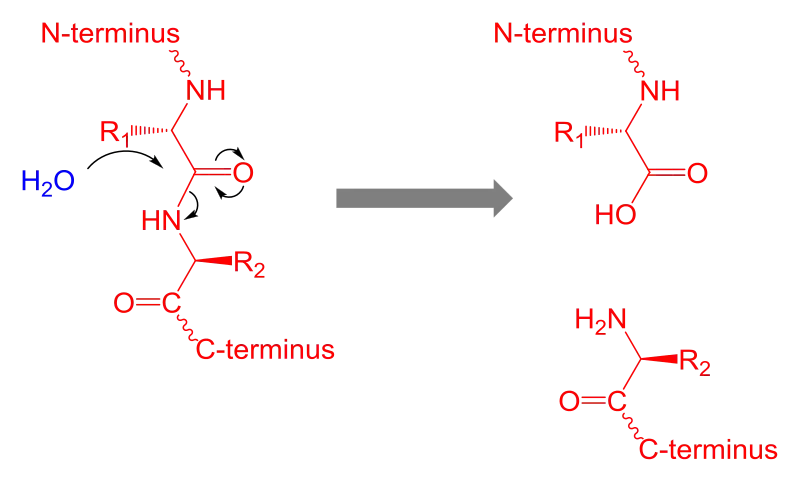
La proteólisis es la descomposición de las proteínas en polipéptidos o aminoácidos más pequeños. Sin catalizar, la hidrólisis de los enlaces peptídicos es extremadamente lenta y lleva cientos de años. La proteólisis normalmente es catalizada por enzimas celulares llamadas proteasas, pero también puede ocurrir por digestión intramolecular.
La proteólisis en organismos sirve para muchos propósitos; por ejemplo, las enzimas digestivas descomponen las proteínas de los alimentos para proporcionar aminoácidos al organismo, mientras que el procesamiento proteolítico de una cadena polipeptídica después de su síntesis puede ser necesario para la producción de una proteína activa. También es importante en la regulación de algunos procesos fisiológicos y celulares, incluida la apoptosis, así como en la prevención de la acumulación de proteínas mal plegadas o no deseadas en las células. En consecuencia, la anomalía en la regulación de la proteólisis puede causar enfermedades.
La proteólisis también se puede utilizar como herramienta analítica para estudiar proteínas en el laboratorio, y también se puede utilizar en la industria, por ejemplo, en el procesamiento de alimentos y la eliminación de manchas.
Funciones biológicas
Procesamiento proteolítico postraduccional
La proteólisis limitada de un polipéptido durante o después de la traducción en la síntesis de proteínas a menudo ocurre para muchas proteínas. Esto puede implicar la eliminación de la metionina N-terminal, el péptido señal y/o la conversión de una proteína inactiva o no funcional en una activa. El precursor de la forma funcional final de la proteína se denomina proproteína y estas proproteínas pueden sintetizarse primero como preproproteína. Por ejemplo, la albúmina se sintetiza primero como preproalbúmina y contiene un péptido señal no escindido. Esto forma la proalbúmina después de que se escinde el péptido señal, y un procesamiento adicional para eliminar el propéptido de 6 residuos N-terminal produce la forma madura de la proteína.
Eliminación de metionina N-terminal
La metionina iniciadora (y, en procariotas, fMet) puede eliminarse durante la traducción de la proteína naciente. Para E. coli, fMet se elimina eficazmente si el segundo residuo es pequeño y no está cargado, pero no si el segundo residuo es voluminoso y está cargado. Tanto en procariotas como en eucariotas, el residuo N-terminal expuesto puede determinar la vida media de la proteína de acuerdo con la regla del N-terminal.
Eliminación de la secuencia de la señal
Las proteínas que se dirigen a un orgánulo en particular o para la secreción tienen un péptido señal N-terminal que dirige la proteína a su destino final. Este péptido señal se elimina por proteólisis después de su transporte a través de una membrana.
Escisión de poliproteínas
Algunas proteínas y la mayoría de las hormonas polipeptídicas eucarióticas se sintetizan como un polipéptido precursor grande conocido como poliproteína que requiere escisión proteolítica en cadenas polipeptídicas individuales más pequeñas. La poliproteína pro-opiomelanocortina (POMC) contiene muchas hormonas polipeptídicas. Sin embargo, el patrón de escisión de POMC puede variar entre diferentes tejidos, produciendo diferentes conjuntos de hormonas polipeptídicas a partir de la misma poliproteína.
Muchos virus también producen sus proteínas inicialmente como una sola cadena polipeptídica que se tradujo a partir de un ARNm policistrónico. Este polipéptido se escinde posteriormente en cadenas polipeptídicas individuales. Los nombres comunes de la poliproteína incluyen gag (antígeno de grupo específico) en retrovirus y ORF1ab en Nidovirales. El último nombre se refiere al hecho de que una secuencia resbaladiza en el ARNm que codifica el polipéptido provoca un cambio de marco ribosómico, lo que da lugar a dos longitudes diferentes de cadenas peptídicas (a y ab) en una proporción aproximadamente fija.
Escisión de proteínas precursoras
Muchas proteínas y hormonas se sintetizan en forma de sus precursores: zimógenos, proenzimas y prehormonas. Estas proteínas se escinden para formar sus estructuras activas finales. La insulina, por ejemplo, se sintetiza como preproinsulina, que produce proinsulina después de que se ha escindido el péptido señal. Luego, la proinsulina se escinde en dos posiciones para producir dos cadenas polipeptídicas unidas por dos enlaces disulfuro. La eliminación de dos residuos C-terminales de la cadena B produce la insulina madura. El plegamiento de proteínas se produce en la forma de proinsulina de cadena sencilla que facilita la formación de los enlaces disulfuro interpeptídicos finales y el enlace disulfuro intrapeptídico final, que se encuentran en la estructura nativa de la insulina.
Las proteasas en particular se sintetizan en forma inactiva para que puedan almacenarse de manera segura en las células y listas para liberarse en cantidad suficiente cuando sea necesario. Esto es para garantizar que la proteasa se active solo en la ubicación o el contexto correctos, ya que la activación inapropiada de estas proteasas puede ser muy destructiva para un organismo. La proteólisis del zimógeno produce una proteína activa; por ejemplo, cuando el tripsinógeno se escinde para formar tripsina, se produce un ligero reordenamiento de la estructura de la proteína que completa el sitio activo de la proteasa, activando así la proteína.
Por lo tanto, la proteólisis puede ser un método para regular los procesos biológicos al convertir proteínas inactivas en activas. Un buen ejemplo es la cascada de coagulación de la sangre en la que un evento inicial desencadena una cascada de activación proteolítica secuencial de muchas proteasas específicas, lo que da como resultado la coagulación de la sangre. El sistema del complemento de la respuesta inmunitaria también implica una activación e interacción proteolítica secuencial compleja que da como resultado un ataque a los patógenos invasores.
Degradación de proteínas
La degradación de proteínas puede tener lugar intracelular o extracelularmente. En la digestión de los alimentos, las enzimas digestivas pueden liberarse en el medio ambiente para la digestión extracelular mediante la cual la escisión proteolítica descompone las proteínas en péptidos y aminoácidos más pequeños para que puedan ser absorbidos y utilizados. En los animales, el alimento puede procesarse extracelularmente en órganos o intestinos especializados, pero en muchas bacterias el alimento puede internalizarse mediante fagocitosis. La degradación microbiana de la proteína en el medio ambiente puede ser regulada por la disponibilidad de nutrientes. Por ejemplo, la limitación de los elementos principales en las proteínas (carbono, nitrógeno y azufre) induce la actividad proteolítica en el hongo Neurospora crassa, así como en las comunidades de organismos del suelo.
Las proteínas en las células se dividen en aminoácidos. Esta degradación intracelular de proteínas cumple múltiples funciones: elimina las proteínas dañadas y anormales y evita su acumulación. También sirve para regular los procesos celulares mediante la eliminación de enzimas y proteínas reguladoras que ya no se necesitan. A continuación, los aminoácidos pueden reutilizarse para la síntesis de proteínas.
Lisosoma y proteasoma
La degradación intracelular de la proteína se puede lograr de dos maneras: proteólisis en el lisosoma o un proceso dependiente de la ubiquitina que dirige las proteínas no deseadas al proteasoma. La vía de autofagia-lisosomal normalmente es un proceso no selectivo, pero puede volverse selectivo tras la inanición por lo que las proteínas con la secuencia peptídica KFERQ o similar se descomponen selectivamente. El lisosoma contiene una gran cantidad de proteasas como las catepsinas.
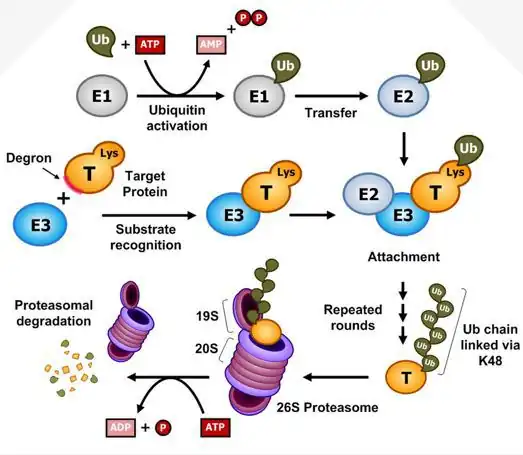
El proceso mediado por ubiquitina es selectivo. Las proteínas marcadas para la degradación están unidas covalentemente a la ubiquitina. Muchas moléculas de ubiquitina pueden unirse en tándem a una proteína destinada a la degradación. La proteína poliubiquinada está dirigida a un complejo de proteasa dependiente de ATP, el proteasoma. La ubiquitina se libera y se reutiliza, mientras que la proteína objetivo se degrada.
Tasa de degradación de proteínas intracelulares

Diferentes proteínas se degradan a diferentes velocidades. Las proteínas anormales se degradan rápidamente, mientras que la velocidad de degradación de las proteínas normales puede variar mucho según sus funciones. Las enzimas en importantes puntos de control metabólico pueden degradarse mucho más rápido que aquellas enzimas cuya actividad es en gran medida constante en todas las condiciones fisiológicas. Una de las proteínas que se degrada con mayor rapidez es la ornitina descarboxilasa, que tiene una vida media de 11 minutos. Por el contrario, otras proteínas como la actina y la miosina tienen una vida media de un mes o más, mientras que, en esencia, la hemoglobina dura toda la vida de un eritrocito.
La regla del extremo N puede determinar parcialmente la vida media de una proteína, y las proteínas con segmentos ricos en prolina, ácido glutámico, serina y treonina (las llamadas proteínas PEST) tienen una vida media corta. Otros factores que se sospecha que afectan la tasa de degradación incluyen la tasa de desaminación de glutamina y asparagina y la oxidación de cisteína, histidina y metionina, la ausencia de ligandos estabilizadores, la presencia de carbohidratos o grupos fosfato unidos, la presencia de un grupo α-amino libre, la carga negativa de la proteína, y la flexibilidad y estabilidad de la proteína. Las proteínas con mayores grados de desorden intrínseco también tienden a tener una vida media celular corta, y se han propuesto segmentos desordenados para facilitar el inicio eficaz de la degradación por parte del proteasoma.
La tasa de proteólisis también puede depender del estado fisiológico del organismo, como su estado hormonal y su estado nutricional. En tiempos de inanición, aumenta la tasa de degradación de proteínas.
Digestión
En la digestión humana, las proteínas de los alimentos se descomponen en cadenas peptídicas más pequeñas mediante enzimas digestivas como la pepsina, la tripsina, la quimotripsina y la elastasa, y en aminoácidos mediante diversas enzimas como la carboxipeptidasa, la aminopeptidasa y la dipeptidasa. Es necesario descomponer las proteínas en pequeños péptidos (tripéptidos y dipéptidos) y aminoácidos para que puedan ser absorbidos por los intestinos, y los tripéptidos y dipéptidos absorbidos también se descomponen en aminoácidos intracelularmente antes de ingresar al torrente sanguíneo.Diferentes enzimas tienen diferente especificidad por su sustrato; la tripsina, por ejemplo, escinde el enlace peptídico después de un residuo cargado positivamente (arginina y lisina); la quimotripsina escinde el enlace después de un residuo aromático (fenilalanina, tirosina y triptófano); la elastasa rompe el enlace después de un pequeño residuo no polar como la alanina o la glicina.
Con el fin de prevenir la activación inapropiada o prematura de las enzimas digestivas (pueden, por ejemplo, desencadenar la autodigestión pancreática que causa pancreatitis), estas enzimas se secretan como zimógeno inactivo. El precursor de la pepsina, el pepsinógeno, es secretado por el estómago y se activa solo en el ambiente ácido que se encuentra en el estómago. El páncreas secreta los precursores de varias proteasas como la tripsina y la quimotripsina. El zimógeno de la tripsina es el tripsinógeno, que es activado por una proteasa muy específica, la enteroquinasa, secretada por la mucosa del duodeno. La tripsina, una vez activada, también puede escindir otros tripsinógenos así como los precursores de otras proteasas como la quimotripsina y la carboxipeptidasa para activarlos.
En bacterias, se usa una estrategia similar de emplear un zimógeno o prezimógeno inactivo. La subtilisina, que es producida por Bacillus subtilis, se produce como preprosubtilisina y se libera solo si el péptido señal se escinde y se ha producido una activación proteolítica autocatalítica.
Regulación celular
La proteólisis también participa en la regulación de muchos procesos celulares mediante la activación o desactivación de enzimas, factores de transcripción y receptores, por ejemplo, en la biosíntesis de colesterol o la mediación de la señalización de trombina a través de receptores activados por proteasa.
Algunas enzimas en importantes puntos de control metabólico, como la ornitina descarboxilasa, están reguladas completamente por su tasa de síntesis y su tasa de degradación. Otras proteínas degradadas rápidamente incluyen los productos proteicos de los protooncogenes, que desempeñan un papel central en la regulación del crecimiento celular.
Regulación del ciclo celular
Las ciclinas son un grupo de proteínas que activan las quinasas involucradas en la división celular. La degradación de las ciclinas es el paso clave que gobierna la salida de la mitosis y el progreso hacia el siguiente ciclo celular. Las ciclinas se acumulan en el curso del ciclo celular y luego desaparecen abruptamente justo antes de la anafase de la mitosis. Las ciclinas se eliminan a través de una vía proteolítica mediada por ubiquitina.
Apoptosis
Las caspasas son un grupo importante de proteasas implicadas en la apoptosis o muerte celular programada. Los precursores de la caspasa, la procaspasa, pueden activarse por proteólisis a través de su asociación con un complejo proteico que forma apoptosoma, o por la granzima B, oa través de las vías del receptor de muerte.
Autoproteólisis
La autoproteólisis tiene lugar en algunas proteínas, por lo que el enlace peptídico se escinde en una reacción intramolecular autocatalizada. A diferencia de los zimógenos, estas proteínas autoproteolíticas participan en una reacción de "recambio único" y no catalizan otras reacciones posteriores a la escisión. Los ejemplos incluyen la escisión del enlace Asp-Pro en un subconjunto de dominios del factor von Willebrand tipo D (VWD) y el dominio de autoprocesamiento FrpC de Neisseria meningitidis, la escisión del enlace Asn-Pro en la proteína FlhB de Salmonella, la proteína Yersinia YscU, así como escisión del enlace Gly-Ser en un subconjunto de dominios de proteína de esperma de erizo de mar, enteroquinasa y agrina (SEA). En algunos casos, la escisión autoproteolítica es promovida por la tensión conformacional del enlace peptídico.
Proteólisis y enfermedades
La actividad proteolítica anormal está asociada con muchas enfermedades. En la pancreatitis, la fuga de proteasas y su activación prematura en el páncreas da como resultado la autodigestión del páncreas. Las personas con diabetes mellitus pueden tener una mayor actividad lisosomal y la degradación de algunas proteínas puede aumentar significativamente. Las enfermedades inflamatorias crónicas, como la artritis reumatoide, pueden implicar la liberación de enzimas lisosomales en el espacio extracelular que degradan los tejidos circundantes. La proteólisis anormal puede dar lugar a muchas enfermedades neurológicas relacionadas con la edad, como el Alzheimer, debido a la generación y eliminación ineficaz de péptidos que se agregan en las células.
Las proteasas pueden estar reguladas por antiproteasas o inhibidores de proteasas, y el desequilibrio entre proteasas y antiproteasas puede dar lugar a enfermedades, por ejemplo, en la destrucción de tejidos pulmonares en el enfisema provocado por fumar tabaco. Se cree que fumar aumenta los neutrófilos y los macrófagos en el pulmón que liberan una cantidad excesiva de enzimas proteolíticas como la elastasa, de modo que ya no pueden ser inhibidas por serpinas como la α 1 -antitripsina, lo que da como resultado la descomposición de los tejidos conectivos en el pulmón. Otras proteasas y sus inhibidores también pueden estar involucradas en esta enfermedad, por ejemplo, las metaloproteinasas de matriz (MMP) y los inhibidores tisulares de metaloproteinasas (TIMP).
Otras enfermedades relacionadas con la proteólisis aberrante incluyen distrofia muscular, trastornos degenerativos de la piel, enfermedades respiratorias y gastrointestinales y malignidad.
Procesos no enzimáticos
Los esqueletos de proteínas son muy estables en agua a pH neutro y temperatura ambiente, aunque la tasa de hidrólisis de diferentes enlaces peptídicos puede variar. La vida media de un enlace peptídico en condiciones normales puede oscilar entre 7 y 350 años, incluso más para los péptidos protegidos por un extremo modificado o dentro del interior de la proteína. Sin embargo, la tasa de hidrólisis puede incrementarse significativamente por extremos de pH y calor. La escisión espontánea de proteínas también puede implicar la catálisis por zinc en serina y treonina.
Los ácidos minerales fuertes pueden hidrolizar fácilmente los enlaces peptídicos de una proteína (hidrólisis ácida). La forma estándar de hidrolizar una proteína o un péptido en sus aminoácidos constituyentes para el análisis es calentarlo a 105 °C durante unas 24 horas en ácido clorhídrico 6M. Sin embargo, algunas proteínas son resistentes a la hidrólisis ácida. Un ejemplo bien conocido es la ribonucleasa A, que se puede purificar tratando extractos crudos con ácido sulfúrico caliente para que otras proteínas se degraden mientras que la ribonucleasa A se deja intacta.
Ciertos productos químicos causan proteólisis solo después de residuos específicos, y estos pueden usarse para descomponer selectivamente una proteína en polipéptidos más pequeños para análisis de laboratorio. Por ejemplo, el bromuro de cianógeno escinde el enlace peptídico después de una metionina. Se pueden utilizar métodos similares para escindir específicamente los enlaces peptídicos de triptofanilo, aspartilo, cisteinilo y asparaginilo. Pueden usarse ácidos tales como ácido trifluoroacético y ácido fórmico para la escisión.
Al igual que otras biomoléculas, las proteínas también se pueden descomponer solo con calor intenso. A 250 °C, el enlace peptídico puede hidrolizarse fácilmente y su vida media se reduce a aproximadamente un minuto. La proteína también se puede descomponer sin hidrólisis mediante pirólisis; pequeños compuestos heterocíclicos pueden comenzar a formarse tras la degradación. Por encima de los 500 °C también pueden formarse hidrocarburos aromáticos policíclicos, lo que es de interés en el estudio de la generación de carcinógenos en el humo del tabaco y la cocción a altas temperaturas.
Aplicaciones de laboratorio
La proteólisis también se utiliza en aplicaciones de investigación y diagnóstico:
- Escisión de la proteína de fusión para que se puedan eliminar el compañero de fusión y la etiqueta de proteína utilizados en la expresión y purificación de la proteína. Las proteasas utilizadas tienen un alto grado de especificidad, como la trombina, la enteroquinasa y la proteasa TEV, de modo que solo se puede escindir la secuencia diana.
- Inactivación completa de la actividad enzimática indeseable o eliminación de proteínas no deseadas. Por ejemplo, la proteinasa K, una proteinasa de amplio espectro estable en urea y SDS, se usa a menudo en la preparación de ácidos nucleicos para eliminar contaminantes de nucleasas no deseados que, de otro modo, podrían degradar el ADN o el ARN.
- Inactivación parcial, o cambio de funcionalidad, de proteína específica. Por ejemplo, el tratamiento de la ADN polimerasa I con subtilisina produce el fragmento Klenow, que conserva su función polimerasa pero carece de actividad 5'-exonucleasa.
- Digestión de proteínas en solución para análisis de proteomas por cromatografía líquida-espectrometría de masas (LC-MS). Esto también se puede hacer mediante digestión en gel de proteínas después de la separación mediante electroforesis en gel para la identificación mediante espectrometría de masas.
- Análisis de la estabilidad del dominio plegado bajo una amplia gama de condiciones.
- Aumento de la tasa de éxito de los proyectos de cristalización
- Producción de proteína digerida utilizada en medios de crecimiento para cultivar bacterias y otros organismos, por ejemplo, triptona en caldo de lisogenia.
Enzimas proteasas
Las proteasas se pueden clasificar según el grupo catalítico involucrado en su sitio activo.
- cisteína proteasa
- Serina proteasa
- treonina proteasa
- proteasa aspártica
- Proteasa glutámica
- metaloproteasa
- Péptido liasa de asparagina
Venenos
Ciertos tipos de veneno, como los producidos por serpientes venenosas, también pueden causar proteólisis. Estos venenos son, de hecho, fluidos digestivos complejos que comienzan su trabajo fuera del cuerpo. Los venenos proteolíticos causan una amplia gama de efectos tóxicos, incluidos efectos que son:
- citotóxico (destructor de células)
- hemotóxico (destructor de la sangre)
- miotóxico (destructor de músculos)
- hemorrágico (sangrado)
Contenido relacionado
Proceso de Haber
Sustrato
Agente reductor