Proceso solvay
El proceso Solvay o proceso amoniaco-sosa es el principal proceso industrial para la producción de carbonato de sodio (carbonato de sodio, Na2CO 3). El proceso de amoníaco-sosa fue desarrollado en su forma moderna por el químico belga Ernest Solvay durante la década de 1860. Los ingredientes para ello son fáciles de conseguir y económicos: salmuera (del interior o del mar) y piedra caliza (de canteras). La producción mundial de carbonato de sodio en 2005 se estimó en 42 millones de toneladas, lo que representa más de seis kilogramos (13 libras) por año por cada persona en la Tierra. Las plantas químicas de Solvay producen ahora aproximadamente las tres cuartas partes de este suministro, y el resto se extrae de depósitos naturales. Este método reemplazó al proceso Leblanc.
Historia
El nombre "ceniza de soda" se basa en el principal método histórico de obtención de álcali, que era utilizar agua para extraerlo de las cenizas de determinadas plantas. Los incendios de leña produjeron potasa y su ingrediente predominante, carbonato de potasio (K2CO3), mientras que las cenizas de estas plantas especiales produjeron "ceniza de sosa" y su ingrediente predominante carbonato de sodio (Na2CO3). La palabra "refresco" (del latín medio) originalmente se refería a ciertas plantas que crecen en solubles en sal; se descubrió que de las cenizas de estas plantas se obtenía la útil carbonato de sodio alcalino. El cultivo de estas plantas alcanzó un nivel de desarrollo particularmente alto en el siglo XVIII en España, donde las plantas recibieron el nombre de barrilla (o "barilla" en inglés). Las cenizas de algas también producen carbonato de sodio y fueron la base de una enorme industria en Escocia en el siglo XVIII. El álcali también se extraía de los lechos de los lagos secos en Egipto.
A finales del siglo XVIII, estas fuentes eran insuficientes para satisfacer la creciente demanda europea de álcalis para las industrias del jabón, los textiles y el vidrio. En 1791, el médico francés Nicolas Leblanc desarrolló un método para fabricar carbonato de sodio utilizando sal, piedra caliza, ácido sulfúrico y carbón. Aunque el proceso Leblanc llegó a dominar la producción de álcali a principios del siglo XIX, el coste de sus insumos y sus subproductos contaminantes (incluido el gas cloruro de hidrógeno) hicieron evidente que estaba lejos de ser una solución ideal.
Se ha informado que en 1811 el físico francés Augustin Jean Fresnel descubrió que el bicarbonato de sodio precipita cuando se burbujea dióxido de carbono a través de salmueras que contienen amoníaco, que es la reacción química central del proceso Solvay. El descubrimiento no fue publicado. Como ha señalado Desmond Reilly, “La historia de la evolución del proceso amonio-sosa es un ejemplo interesante de la manera en que se puede hacer un descubrimiento y luego dejarlo de lado y no aplicarlo durante un tiempo considerable”. " La consideración seria de esta reacción como base de un proceso industrial data de la patente británica concedida en 1834 a H. G. Dyar y J. Hemming. Hubo varios intentos de reducir esta reacción a la práctica industrial, con distinto éxito.
En 1861, el químico industrial belga Ernest Solvay centró su atención en el problema; aparentemente desconocía en gran medida el extenso trabajo anterior. Su solución fue una torre de absorción de gas de 24 metros (79 pies) en la que el dióxido de carbono burbujeaba a través de un flujo descendente de salmuera. Esto, junto con una recuperación y reciclaje eficientes del amoníaco, resultó eficaz. En 1864, Solvay y su hermano Alfred obtuvieron respaldo financiero y construyeron una planta en Couillet, hoy un suburbio de la ciudad belga de Charleroi. El nuevo proceso resultó más económico y menos contaminante que el método Leblanc, y su uso se extendió. En 1874, los Solvay ampliaron sus instalaciones con una planta nueva y más grande en Nancy, Francia.
Ese mismo año, Ludwig Mond visitó Solvay en Bélgica y adquirió los derechos para utilizar la nueva tecnología. Él y John Brunner formaron la firma Brunner, Mond & Co., y construyó una planta Solvay en Winnington, cerca de Northwich, Cheshire, Inglaterra. La instalación comenzó a funcionar en 1874. Mond contribuyó decisivamente a que el proceso Solvay fuera un éxito comercial. Hizo varios ajustes entre 1873 y 1880 para eliminar subproductos que podrían ralentizar o detener el proceso.
En 1884, los hermanos Solvay otorgaron licencias a los estadounidenses William B. Cogswell y Rowland Hazard para producir carbonato de sodio en los EE. UU. y formaron una empresa conjunta (Solvay Process Company) para construir y operar una planta en Solvay, Nueva York.

En la década de 1890, las plantas de proceso Solvay producían la mayor parte de la carbonato de sodio del mundo.
En 1938 se descubrieron grandes depósitos del mineral trona cerca del río Green en Wyoming, de los que se puede extraer carbonato de sodio a un precio más bajo que el producido mediante el proceso. La planta original de Solvay en Nueva York cerró en 1986 y fue reemplazada en Estados Unidos por una fábrica en Green River. En el resto del mundo, el proceso Solvay sigue siendo la principal fuente de carbonato de sodio.
Química
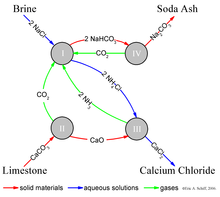

El proceso Solvay produce carbonato de sodio (predominantemente carbonato de sodio (Na2CO3)) a partir de salmuera (como fuente de cloruro de sodio (NaCl)) y de piedra caliza (como fuente de carbonato cálcico (CaCO3)). El proceso general es:
La implementación real de esta reacción global y general es compleja. Se puede dar una descripción simplificada utilizando las cuatro reacciones químicas diferentes que interactúan ilustradas en la figura. En el primer paso del proceso, el dióxido de carbono (CO2) pasa a través de una solución acuosa concentrada de cloruro de sodio (sal de mesa, NaCl) y amoníaco (NH3).
- ---(I)
En la práctica industrial, la reacción se lleva a cabo haciendo pasar salmuera concentrada (agua salada) a través de dos torres. En el primero, el amoníaco burbujea a través de la salmuera y es absorbido por ésta. En el segundo, el dióxido de carbono burbujea a través de la salmuera amoniacal y el bicarbonato de sodio (bicarbonato de sodio) precipita de la solución. Tenga en cuenta que, en una solución básica, NaHCO3 es menos soluble en agua que el cloruro de sodio. El amoníaco (NH3) amortigua la solución a un pH básico (alto); sin amoníaco, un subproducto de ácido clorhídrico acidificaría la solución y detendría la precipitación. En este caso, el NH3 junto con la salmuera amoniacal actúan como aguas madre.
El "catalizador" de amoníaco necesario; para la reacción (I) se recupera en una etapa posterior y se consume relativamente poco amoníaco. El dióxido de carbono necesario para la reacción (I) se produce calentando ("calcinación") la piedra caliza a 950-1100 °C y mediante la calcinación del bicarbonato de sodio (ver más abajo). El carbonato de calcio (CaCO3) de la piedra caliza se convierte parcialmente en cal viva (óxido de calcio (CaO)) y dióxido de carbono:
- ---(II)
El bicarbonato de sodio (NaHCO3) que precipita en la reacción (I) se filtra de la solución caliente de cloruro de amonio (NH4Cl) y la solución Luego se hace reaccionar con la cal viva (óxido de calcio (CaO)) sobrante del calentamiento de la piedra caliza en el paso (II).
- ---(III)
El CaO constituye una solución básica fuerte. El amoníaco de la reacción (III) se recicla de nuevo a la solución de salmuera inicial de la reacción (I).
El precipitado de bicarbonato de sodio (NaHCO3) de la reacción (I) se convierte luego en el producto final, carbonato de sodio (bicarbonato de sodio: Na2CO 3), por calcinación (160-230 °C), produciendo agua y dióxido de carbono como subproductos:
- ---(IV)
El dióxido de carbono del paso (IV) se recupera para su reutilización en el paso (I). Cuando se diseña y opera correctamente, una planta Solvay puede recuperar casi todo su amoníaco y consume sólo pequeñas cantidades de amoníaco adicional para compensar las pérdidas. Los únicos insumos importantes al proceso Solvay son la sal, la piedra caliza y la energía térmica, y su único subproducto importante es el cloruro de calcio, que a veces se vende como sal para carreteras.
Después de la invención del Haber y otros nuevos procesos de producción de amoníaco en las décadas de 1910 y 1920, su precio bajó y hubo menos necesidad de recuperarlo. Entonces, en el proceso Solvay modificado desarrollado por el químico chino Hou Debang en la década de 1930, los primeros pasos son los mismos que los del proceso Solvay, pero el CaCl2 se reemplaza por cloruro de amonio (NH4< /sub>Cl). En lugar de tratar la solución restante con cal, se bombean dióxido de carbono y amoníaco a la solución, luego se agrega cloruro de sodio hasta que la solución se satura a 40 °C. A continuación, la solución se enfría a 10 °C. El cloruro de amonio precipita y se elimina mediante filtración y la solución se recicla para producir más carbonato de sodio. El proceso de Hou elimina la producción de cloruro de calcio. El subproducto cloruro de amonio puede refinarse, usarse como fertilizante y puede tener mayor valor comercial que el CaCl2, reduciendo así la extensión de los lechos de desechos.
Más detalles sobre la implementación industrial de este proceso están disponibles en el informe elaborado para la Asociación Europea de Productores de Ceniza de Soda.
Subproductos y residuos
El principal subproducto del proceso Solvay es el cloruro de calcio (CaCl2) en solución acuosa. El proceso también tiene otros desechos y subproductos. No toda la piedra caliza que se calcina se convierte en cal viva y dióxido de carbono (en la reacción II); el carbonato de calcio residual y otros componentes de la piedra caliza se convierten en desechos. Además, la salmuera utilizada en el proceso suele purificarse para eliminar los iones de magnesio y calcio, normalmente para formar carbonatos (MgCO3, CaCO3); de lo contrario, estas impurezas provocarían incrustaciones en los distintos recipientes y torres de reacción. Estos carbonatos son productos de desecho adicionales.
En plantas del interior, como la de Solvay, Nueva York, los subproductos se han depositado en "lechos de desechos"; el peso del material depositado en estos lechos de desechos superó al de la carbonato de sodio producido en aproximadamente un 50%. Estos lechos de desechos han provocado la contaminación del agua, principalmente por calcio y cloruro. Los lechos de desechos en Solvay, Nueva York, aumentaron sustancialmente la salinidad en el cercano lago Onondaga, que solía estar entre los lagos más contaminados de los EE. UU. y es un sitio de contaminación de superfondo. A medida que estos lechos de desechos envejecen, comienzan a sustentar comunidades de plantas que han sido objeto de varios estudios científicos.
En lugares costeros, como los de Saurashtra, Gujarat, India, la solución de CaCl2 puede descargarse directamente al mar, aparentemente sin causar daños ambientales sustanciales (aunque pequeñas cantidades de metales pesados en ella puede ser un problema), la principal preocupación es que el lugar de descarga se encuentra dentro del Parque Nacional Marino del Golfo de Kutch, que sirve como hábitat para arrecifes de coral, pastos marinos y comunidades de algas marinas. En Osborne, Australia del Sur, ahora se utiliza un estanque de sedimentación para eliminar el 99 % del CaCl2, ya que la descarga anterior estaba sedimentando el canal de envío. En Rosignano Solvay, en Toscana, Italia, los residuos de piedra caliza producidos por la fábrica de Solvay han cambiado el paisaje, produciendo el "Spiagge Bianche" ("Playas Blancas"). Un informe publicado en 1999 por el Programa de las Naciones Unidas para el Medio Ambiente (PNUMA) incluía a Spiagge Bianche entre los puntos prioritarios de contaminación en las zonas costeras del mar Mediterráneo.
Secuestro de carbono y proceso Solvay
Se han propuesto variaciones en el proceso Solvay para el secuestro de carbono. Una idea es hacer reaccionar el dióxido de carbono, producido quizás por la combustión de carbón, para formar carbonatos sólidos (como el bicarbonato de sodio) que podrían almacenarse permanentemente, evitando así la emisión de dióxido de carbono a la atmósfera. El proceso Solvay podría modificarse para obtener la reacción general:
- 2 NaCl + CaCO3 + CO
2 + H
2O → 2NaHCO3 + CaCl2
Se han propuesto variaciones en el proceso Solvay para convertir las emisiones de dióxido de carbono en carbonatos de sodio, pero el secuestro de carbono mediante carbonatos de calcio o magnesio parece más prometedor. Sin embargo, la cantidad de dióxido de carbono consumida por la humanidad en comparación con la cantidad que puede utilizarse para el secuestro de carbono con calcio o magnesio es muy baja. Además, la variación del proceso Solvay probablemente agregará un paso adicional de consumo de energía, lo que aumentará las emisiones de dióxido de carbono a menos que se utilicen fuentes de energía neutras en carbono como la energía hidroeléctrica, nuclear, eólica o solar.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar




