Presión osmótica
La presión osmótica es la presión mínima que debe aplicarse a una solución para evitar el flujo hacia el interior de su disolvente puro a través de una membrana semipermeable. También se define como la medida de la tendencia de una disolución a absorber un disolvente puro por ósmosis. La presión osmótica potencial es la presión osmótica máxima que podría desarrollarse en una solución si fuera separada de su disolvente puro por una membrana semipermeable.
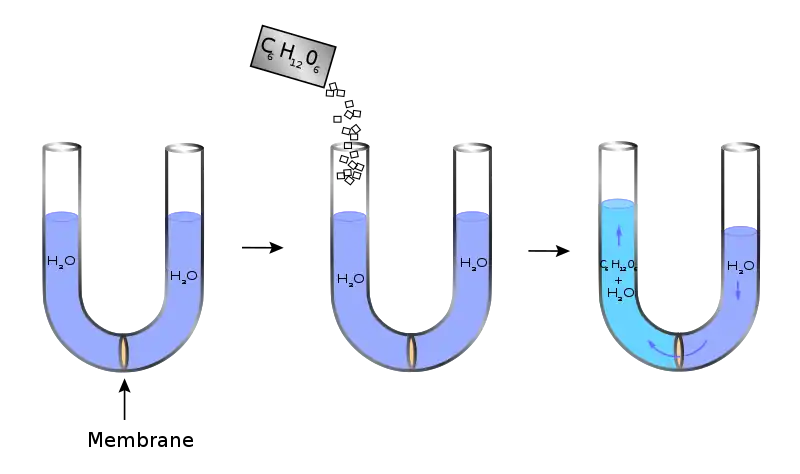
La ósmosis ocurre cuando dos soluciones que contienen diferentes concentraciones de soluto son separadas por una membrana selectivamente permeable. Las moléculas de solvente pasan preferentemente a través de la membrana desde la solución de baja concentración a la solución con mayor concentración de soluto. La transferencia de moléculas de solvente continuará hasta que se logre el equilibrio.
Teoría y medición
Jacobus van 't Hoff encontró una relación cuantitativa entre la presión osmótica y la concentración de soluto, expresada en la siguiente ecuación:
donde 

Para soluciones más concentradas, la ecuación de van 't Hoff se puede extender como una serie de potencias en la concentración de soluto, c. En una primera aproximación,
donde 
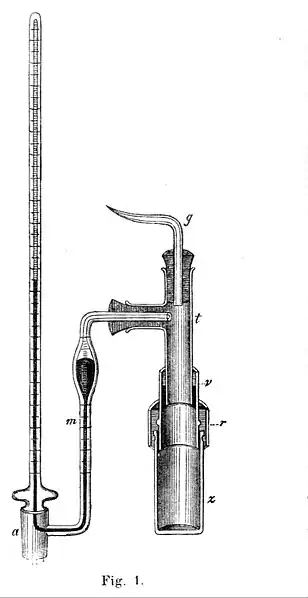
La celda de Pfeffer fue desarrollada para la medición de la presión osmótica.
Aplicaciones
La medición de la presión osmótica se puede utilizar para la determinación de los pesos moleculares.
La presión osmótica es un factor importante que afecta a las células biológicas. La osmorregulación es el mecanismo de homeostasis de un organismo para alcanzar el equilibrio en la presión osmótica.
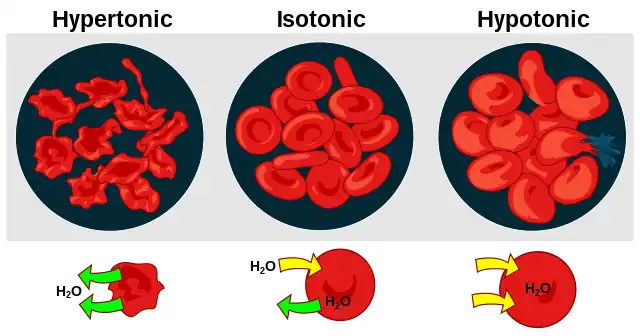
- La hipertonicidad es la presencia de una solución que hace que las células se encojan.
- La hipotonicidad es la presencia de una solución que hace que las células se hinchen.
- Isotonicidad es la presencia de una solución que no produce cambios en el volumen celular.
Cuando una célula biológica se encuentra en un ambiente hipotónico, el interior de la célula acumula agua, el agua fluye a través de la membrana celular hacia la célula, lo que hace que se expanda. En las células vegetales, la pared celular restringe la expansión, lo que resulta en una presión sobre la pared celular desde adentro llamada presión de turgencia. La presión de turgencia permite que las plantas herbáceas se mantengan erguidas. También es el factor determinante de cómo las plantas regulan la apertura de sus estomas. En las células animales, la presión osmótica excesiva puede provocar citólisis.
La presión osmótica es la base del filtrado ("ósmosis inversa"), un proceso comúnmente utilizado en la purificación del agua. El agua a purificar se coloca en una cámara y se somete a una cantidad de presión superior a la presión osmótica ejercida por el agua y los solutos disueltos en ella. Parte de la cámara se abre a una membrana diferencialmente permeable que deja pasar las moléculas de agua, pero no las partículas de soluto. La presión osmótica del agua del océano es de aproximadamente 27 atm. La ósmosis inversa desaliniza el agua dulce del agua salada del océano.
Derivación de la fórmula de van 't Hoff
Considere el sistema en el punto en que ha alcanzado el equilibrio. La condición para esto es que el potencial químico del solvente (ya que solo él puede fluir libremente hacia el equilibrio) en ambos lados de la membrana sea igual. El compartimiento que contiene el solvente puro tiene un potencial químico de 




Aquí, la diferencia de presión de los dos compartimentos 
Para encontrar 
Podemos escribir el lado izquierdo como:
donde 


donde 
Si el líquido es incompresible, el volumen molar es constante, 

El coeficiente de actividad es una función de la concentración y la temperatura, pero en el caso de mezclas diluidas, suele estar muy cerca de 1,0, por lo que
La fracción molar de soluto, 





La fracción molar 





Para soluciones acuosas de sales, se debe tener en cuenta la ionización. Por ejemplo, 1 mol de NaCl se ioniza a 2 moles de iones.
Contenido relacionado
Huevo (biología)
Género (biología)
Sinapsis química









