Peróxido de acetona
El
peróxido de acetona (también llamado APEX y madre de Satán) es un peróxido orgánico y un explosivo primario. Se produce mediante la reacción de acetona y peróxido de hidrógeno para producir una mezcla de formas de monómero lineal y dímero, trímero y tetrámero cíclico. El dímero se conoce como diperóxido de diacetona (DADP). El trímero se conoce como triperóxido de triacetona (TATP) o peróxido de acetona tricíclico (TCAP). El peróxido de acetona toma la forma de un polvo cristalino blanco con un olor distintivo parecido al de la lejía (cuando es impuro) o un olor parecido al de la fruta cuando es puro, y puede explotar poderosamente si se lo somete a calor, fricción, electricidad estática, ácido sulfúrico concentrado y rayos UV fuertes. radiación o shock. Hasta aproximadamente 2015, los detectores de explosivos no estaban configurados para detectar explosivos no nitrogenados, ya que la mayoría de los explosivos utilizados antes de 2015 estaban basados en nitrógeno. El TATP, al no contener nitrógeno, se ha utilizado como explosivo preferido en varios ataques terroristas con bombas desde 2001.
Historia
El peróxido de acetona (específicamente, triperóxido de triacetona) fue descubierto en 1895 por el químico alemán Richard Wolffenstein. Wolffenstein combinó acetona y peróxido de hidrógeno, y luego dejó reposar la mezcla durante una semana a temperatura ambiente, tiempo durante el cual precipitó una pequeña cantidad de cristales, que tenían un punto de fusión de 97 °C (207 °F).
En 1899 Adolf von Baeyer y Victor Villiger describieron la primera síntesis del dímero y describieron el uso de ácidos para la síntesis de ambos peróxidos. Baeyer y Villiger prepararon el dímero combinando persulfato de potasio en éter dietílico con acetona, enfriando. Después de separar la capa de éter, el producto se purificó y se encontró que fundía a 132-133 °C (270-271 °F). Descubrieron que el trímero se podía preparar añadiendo ácido clorhídrico a una mezcla fría de acetona y peróxido de hidrógeno. Al utilizar la depresión de los puntos de congelación para determinar los pesos moleculares de los compuestos, también determinaron que la forma de peróxido de acetona que habían preparado con persulfato de potasio era un dímero, mientras que el peróxido de acetona que se había preparado con ácido clorhídrico era un trímero., como el complejo de Wolffenstein.
El trabajo sobre esta metodología y sobre los diversos productos obtenidos fue investigado más a fondo a mediados del siglo XX por Milas y Golubović.
Química
El nombre químico, peróxido de acetona se usa más comúnmente para referirse al trímero cíclico, el producto de una reacción entre dos precursores, peróxido de hidrógeno y acetona, en una adición nucleofílica catalizada por ácido, aunque Son posibles otras formas monoméricas y diméricas adicionales.
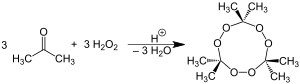
En concreto, dos dímeros, uno cíclico (C6H12O4) y otro de cadena abierta (C6H14O4), así como un monómero de dihidroperóxido abierto (C3H8O 4), también se puede formar; bajo un conjunto particular de condiciones de concentración de reactivo y catalizador ácido, el trímero cíclico es el producto primario. También se ha descrito una forma tetramérica, aunque en condiciones catalíticas diferentes. Se ha cuestionado la síntesis de peróxido de acetona tetramérico. En condiciones neutras, se informa que la reacción produce el peróxido orgánico monomérico.
La ruta más común para TATP casi puro es H2O2/acetona/HCl en proporciones molares de 1:1:0,25, utilizando peróxido de hidrógeno al 30 %. Este producto contiene muy poco o nada de DADP con algunos rastros muy pequeños de compuestos clorados. El producto que contiene una gran fracción de DADP se puede obtener a partir de 50 % de H2O2 utilizando altas cantidades de concentración. ácido sulfúrico como catalizador o alternativamente con 30% de H2O2 y cantidades masivas de HCl como catalizador.
El producto elaborado con ácido clorhídrico se considera más estable que el elaborado con ácido sulfúrico. Se sabe que las trazas de ácido sulfúrico atrapadas dentro de los cristales formados de peróxido de acetona provocan inestabilidad. De hecho, el ácido sulfúrico atrapado puede inducir la detonación a temperaturas tan bajas como 50 °C (122 °F). Este es el mecanismo más probable detrás de las explosiones accidentales de peróxido de acetona que ocurren durante el secado en superficies calientes.
El triperóxido de triacetona se forma en 2-propanol al permanecer durante largos períodos de tiempo en presencia de aire.

Los peróxidos orgánicos en general son explosivos sensibles y peligrosos, y todas las formas de peróxido de acetona son sensibles a la iniciación. TATP se descompone explosivamente; El examen de la descomposición explosiva del TATP en el borde mismo del frente de detonación predice "la formación de acetona y ozono como principales productos de descomposición y no de los productos de oxidación intuitivamente esperados". La descomposición explosiva del TATP en el borde mismo del frente de detonación crea muy poco calor; El análisis computacional anterior sugiere que la descomposición de TATP es una explosión entrópica. Sin embargo, esta hipótesis ha sido cuestionada por no ajustarse a las mediciones reales. La afirmación de una explosión entrópica se ha relacionado con los acontecimientos que se produjeron justo detrás del frente de detonación. Los autores del estudio de 2004 de Dubnikova et al. Un estudio confirma que una reacción redox final (combustión) de ozono, oxígeno y especies reactivas en agua, diversos óxidos e hidrocarburos tiene lugar aproximadamente 180 ps después de la reacción inicial, aproximadamente un micras de la onda de detonación. Los cristales detonantes de TATP finalmente alcanzan una temperatura de 2300 K (2030 °C; 3680 °F) y una presión de 80 kbar. La energía final de detonación es de aproximadamente 2800 kJ/kg (medida en helio), suficiente para elevar brevemente la temperatura de los productos gaseosos a 2000 °C (3630 °F). El volumen de gases a STP es de 855 L/kg para TATP y 713 L/kg para DADP (medido en helio).
Se informa que la forma tetramérica de peróxido de acetona, preparada en condiciones neutras usando un catalizador de estaño en presencia de un quelante o inhibidor general de la química radical, es más estable químicamente, aunque sigue siendo un explosivo primario muy peligroso. Su síntesis ha sido cuestionada.

Tanto TATP como DADP son propensos a perder masa por sublimación. DADP tiene un peso molecular más bajo y una presión de vapor más alta. Esto significa que DADP es más propenso a la sublimación que TATP. Esto puede provocar un crecimiento peligroso de cristales cuando los vapores se depositan si los cristales se han almacenado en un recipiente con tapa roscada. Este proceso de sublimación y deposición repetidas también da como resultado un cambio en el tamaño de los cristales mediante la maduración de Ostwald.
Se pueden utilizar varios métodos para el análisis de trazas de TATP, incluida la cromatografía de gases/espectrometría de masas (GC/MS), la cromatografía líquida de alto rendimiento/espectrometría de masas (HPLC/MS) y la HPLC con derivatización poscolumna.
El peróxido de acetona es soluble en tolueno, cloroformo, acetona, diclorometano y metanol. La recristalización de explosivos primarios puede producir cristales grandes que detonan espontáneamente debido a la tensión interna.
Usos industriales
Los peróxidos de cetona, incluidos el peróxido de acetona y el peróxido de metiletilcetona, encuentran aplicación como iniciadores de reacciones de polimerización, por ejemplo, resinas de silicona o poliéster, en la fabricación de compuestos reforzados con fibra de vidrio. Para estos usos, los peróxidos suelen estar en forma de una solución diluida en un disolvente orgánico; El peróxido de metiletilcetona es más común para este propósito, ya que es estable en almacenamiento.
El peróxido de acetona se utiliza como agente blanqueador de harina para blanquear y "madurar" harina.
Los peróxidos de acetona son subproductos no deseados de algunas reacciones de oxidación, como las utilizadas en la síntesis de fenol. Debido a su naturaleza explosiva, su presencia en procesos químicos y muestras químicas crea situaciones potencialmente peligrosas. Es posible que se produzcan accidentes en laboratorios ilícitos de MDMA. Se utilizan numerosos métodos para reducir su apariencia, incluido cambiar el pH a más alcalino, ajustar la temperatura de reacción o agregar inhibidores de su producción. Por ejemplo, el peróxido de triacetona es el principal contaminante que se encuentra en el éter diisopropílico como resultado de la oxidación fotoquímica en el aire.
Uso en artefactos explosivos improvisados
TATP se ha utilizado en ataques con bombas y suicidas y en artefactos explosivos improvisados, incluidos los atentados de Londres del 7 de julio de 2005, donde cuatro atacantes suicidas mataron a 52 personas e hirieron a más de 700. Fue uno de los explosivos utilizados por el & #34;zapato bomber" Richard Reid en su fallido intento de bomba en un zapato en 2001 y fue utilizado por los terroristas suicidas en los ataques de París de noviembre de 2015, los atentados de Bruselas de 2016, el atentado del Manchester Arena, el ataque de Bruselas de junio de 2017, el atentado de Parsons Green, los atentados de Surabaya y la Pascua de Sri Lanka de 2019. bombardeos. La policía de Hong Kong afirma haber encontrado 2 kg (4,4 lb) de TATP entre armas y materiales de protesta en julio de 2019, cuando se llevaban a cabo protestas masivas contra una propuesta de ley que permitía la extradición a China continental.
La sobrepresión de la onda de choque TATP es el 70% de la del TNT, el impulso de fase positiva es el 55% del equivalente de TNT. El TATP a 0,4 g/cm3 tiene aproximadamente un tercio del brillo del TNT (1,2 g/cm3) medido mediante la prueba de Hess.
TATP es atractivo para los terroristas porque se prepara fácilmente a partir de ingredientes disponibles en el comercio minorista, como decolorante para el cabello y quitaesmalte. También pudo evadir la detección porque es uno de los pocos explosivos potentes que no contiene nitrógeno y, por lo tanto, podía pasar sin ser detectado a través de escáneres de detección de explosivos estándar, que hasta ahora estaban diseñados para detectar explosivos nitrogenados. En 2016, los detectores de explosivos se modificaron para poder detectar TATP y se desarrollaron nuevos tipos.
En la Unión Europea se han adoptado medidas legislativas para limitar la venta de peróxido de hidrógeno concentrado al 12% o más.
Una desventaja clave es la alta susceptibilidad del TATP a la detonación accidental, causando lesiones y muertes entre los fabricantes ilegales de bombas, lo que ha llevado a que se haga referencia al TATP como la "Madre de Satán". TATP se encontró en la explosión accidental que precedió a los atentados terroristas de 2017 en Barcelona y alrededores.
La síntesis de TATP a gran escala a menudo se ve traicionada por olores excesivos a lejía o afrutados. Este olor puede incluso penetrar en la ropa y el cabello en cantidades bastante perceptibles, como se informó en los atentados de Bruselas de 2016.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar