Paramagnetismo
paramagnetismo es una forma de magnetismo en la que algunos materiales son atraídos débilmente por un campo magnético aplicado externamente y forman campos magnéticos internos inducidos en la dirección del campo magnético aplicado. En contraste con este comportamiento, los materiales diamagnéticos son repelidos por los campos magnéticos y forman campos magnéticos inducidos en la dirección opuesta a la del campo magnético aplicado. Los materiales paramagnéticos incluyen la mayoría de los elementos químicos y algunos compuestos; tienen una permeabilidad magnética relativa ligeramente superior a 1 (es decir, una pequeña susceptibilidad magnética positiva) y, por lo tanto, son atraídos por los campos magnéticos. El momento magnético inducido por el campo aplicado es lineal en la intensidad del campo y bastante débil. Por lo general, requiere una balanza analítica sensible para detectar el efecto y las mediciones modernas en materiales paramagnéticos a menudo se realizan con un magnetómetro SQUID.
El paramagnetismo se debe a la presencia de electrones desapareados en el material, por lo que la mayoría de los átomos con orbitales atómicos incompletos son paramagnéticos, aunque existen excepciones como el cobre. Debido a su espín, los electrones desapareados tienen un momento dipolar magnético y actúan como pequeños imanes. Un campo magnético externo hace que los electrones' gira para alinearse paralelamente al campo, provocando una atracción neta. Los materiales paramagnéticos incluyen aluminio, oxígeno, titanio y óxido de hierro (FeO). Por lo tanto, en química se usa una regla general simple para determinar si una partícula (átomo, ion o molécula) es paramagnética o diamagnética: si todos los electrones en la partícula están emparejados, entonces la sustancia hecha de esta partícula es diamagnética; si tiene electrones desapareados, entonces la sustancia es paramagnética.
A diferencia de los ferroimanes, los paraimanes no retienen ninguna magnetización en ausencia de un campo magnético aplicado externamente porque el movimiento térmico aleatoriza las orientaciones de espín. (Algunos materiales paramagnéticos retienen el desorden de espín incluso en el cero absoluto, lo que significa que son paramagnéticos en el estado fundamental, es decir, en ausencia de movimiento térmico). Por lo tanto, la magnetización total cae a cero cuando se elimina el campo aplicado. Incluso en presencia del campo, solo hay una pequeña magnetización inducida porque solo una pequeña fracción de los espines estará orientada por el campo. Esta fracción es proporcional a la intensidad del campo y esto explica la dependencia lineal. La atracción que experimentan los materiales ferromagnéticos es no lineal y mucho más fuerte, por lo que se observa fácilmente, por ejemplo, en la atracción entre un imán de nevera y el hierro de la propia nevera.
Relación con los espines de los electrones
Los átomos o moléculas constituyentes de materiales paramagnéticos tienen momentos magnéticos permanentes (dipolos), incluso en ausencia de un campo aplicado. El momento permanente generalmente se debe al giro de electrones no apareados en orbitales de electrones atómicos o moleculares (ver Momento magnético). En el paramagnetismo puro, los dipolos no interactúan entre sí y se orientan aleatoriamente en ausencia de un campo externo debido a la agitación térmica, lo que da como resultado un momento magnético neto cero. Cuando se aplica un campo magnético, los dipolos tenderán a alinearse con el campo aplicado, dando como resultado un momento magnético neto en la dirección del campo aplicado. En la descripción clásica, se puede entender que esta alineación ocurre debido a que un campo aplicado proporciona un par en los momentos magnéticos, que intenta alinear los dipolos paralelos al campo aplicado. Sin embargo, los verdaderos orígenes de la alineación solo pueden entenderse a través de las propiedades mecánicas cuánticas del espín y el momento angular.
Si hay suficiente intercambio de energía entre los dipolos vecinos, estos interactuarán y pueden alinearse o antialinearse espontáneamente y formar dominios magnéticos, lo que resultará en ferromagnetismo (imanes permanentes) o antiferromagnetismo, respectivamente. El comportamiento paramagnético también se puede observar en materiales ferromagnéticos que están por encima de su temperatura de Curie y en antiferromagnetos por encima de su temperatura de Néel. A estas temperaturas, la energía térmica disponible simplemente supera la energía de interacción entre los espines.
En general, los efectos paramagnéticos son bastante pequeños: la susceptibilidad magnética es del orden de 10−3 a 10−5 para la mayoría de los paramagnetos, pero puede ser tan alta como 10−1 para paramagnetos sintéticos como ferrofluidos.
Deslocalización
| Material | Susceptibilidad magnética, χ χ v{displaystyle chi _{v} [10]; 5 -]
(unidades de ISI) |
|---|---|
| Tungsten | 6.8 |
| Caesio | 5.1 |
| Aluminio | 2.2 |
| Litio | 1.4 |
| Magnesio | 1.2 |
| Sodium | 0.72 |
En los materiales conductores, los electrones están deslocalizados, es decir, viajan a través del sólido más o menos como electrones libres. La conductividad puede entenderse en una imagen de estructura de bandas como resultado del llenado incompleto de las bandas de energía. En un conductor no magnético ordinario, la banda de conducción es idéntica para los electrones que giran hacia arriba y hacia abajo. Cuando se aplica un campo magnético, la banda de conducción se divide en una banda de giro hacia arriba y otra de giro hacia abajo debido a la diferencia en la energía potencial magnética para los electrones de giro hacia arriba y hacia abajo. Dado que el nivel de Fermi debe ser idéntico para ambas bandas, esto significa que habrá un pequeño excedente del tipo de giro en la banda que se movió hacia abajo. Este efecto es una forma débil de paramagnetismo conocida como paramagnetismo de Pauli.
El efecto siempre compite con una respuesta diamagnética de signo opuesto debido a todos los electrones del núcleo de los átomos. Las formas más fuertes de magnetismo generalmente requieren electrones localizados en lugar de itinerantes. Sin embargo, en algunos casos puede resultar una estructura de bandas en la que hay dos subbandas deslocalizadas con estados de espines opuestos que tienen energías diferentes. Si una subbanda se llena preferentemente sobre la otra, una puede tener un orden ferromagnético itinerante. Esta situación generalmente solo ocurre en bandas (d-) relativamente estrechas, que están mal deslocalizadas.
Electrones S y p
Por lo general, una fuerte deslocalización en un sólido debido a una gran superposición con funciones de onda vecinas significa que habrá una gran velocidad de Fermi; esto significa que la cantidad de electrones en una banda es menos sensible a los cambios en la energía de esa banda, lo que implica un magnetismo débil. Esta es la razón por la que los metales de tipo s y p suelen ser paramagnéticos de Pauli o, como en el caso del oro, incluso diamagnéticos. En el último caso, la contribución diamagnética de los electrones internos de la capa cerrada simplemente gana al débil término paramagnético de los electrones casi libres.
Electrones D y f
Los efectos magnéticos más fuertes normalmente solo se observan cuando hay electrones d o f involucrados. En particular, estos últimos suelen estar fuertemente localizados. Además, el tamaño del momento magnético en un átomo de lantánido puede ser bastante grande, ya que puede transportar hasta 7 electrones desapareados en el caso del gadolinio (III) (de ahí su uso en resonancia magnética). Los altos momentos magnéticos asociados con los lantánidos es una de las razones por las que los imanes superfuertes suelen estar basados en elementos como el neodimio o el samario.
Localización molecular
La imagen de arriba es una generalización ya que se refiere a materiales con una red extendida en lugar de una estructura molecular. La estructura molecular también puede conducir a la localización de electrones. Aunque generalmente hay razones energéticas por las que una estructura molecular resulta tal que no exhibe orbitales parcialmente llenos (es decir, espines no apareados), algunos restos de capa no cerrados ocurren en la naturaleza. El oxígeno molecular es un buen ejemplo. Incluso en el sólido congelado contiene moléculas dirradicalarias que dan como resultado un comportamiento paramagnético. Los espines no apareados residen en orbitales derivados de las funciones de onda p del oxígeno, pero la superposición se limita al vecino en las moléculas de O2. Las distancias a otros átomos de oxígeno en la red siguen siendo demasiado grandes para dar lugar a la deslocalización y los momentos magnéticos siguen sin emparejarse.
Teoría
El teorema de Bohr-Van Leeuwen demuestra que no puede haber diamagnetismo o paramagnetismo en un sistema puramente clásico. La respuesta paramagnética tiene entonces dos posibles orígenes cuánticos, ya sea provenientes de momentos magnéticos permanentes de los iones o del movimiento espacial de los electrones de conducción dentro del material. Ambas descripciones se dan a continuación.
Ley de Curie
Para niveles bajos de magnetización, la magnetización de paramagnetes sigue lo que se conoce como la ley de Curie, al menos aproximadamente. Esta ley indica que la susceptibilidad, χ χ {displaystyle chi }, de materiales paramagnéticos es inversamente proporcional a su temperatura, es decir, que los materiales se vuelven más magnéticos a temperaturas inferiores. La expresión matemática es:
- M{displaystyle mathbf {M} es la magnetización resultante, medida en amperios/meter (A/m),
- χ χ {displaystyle chi } es el volumen de susceptibilidad magnética (indimensionable),
- H{displaystyle H. es el campo magnético auxiliar (A/m),
- T{displaystyle T} es temperatura absoluta, medida en kelvins (K),
- C{displaystyle C} es una constante Curie específica para materiales (K).
La ley de Curie es válida bajo las condiciones comúnmente encontradas de baja magnetización (μBH ≲ kBT), pero no se aplica en el régimen de campo alto/baja temperatura donde ocurre la saturación de la magnetización (μBH ≳ kBT) y los dipolos magnéticos están todos alineados con el aplicado campo. Cuando los dipolos están alineados, aumentar el campo externo no aumentará la magnetización total ya que no puede haber más alineación.
Para un ion paramagnético con momentos magnéticos que no interactúan con momento angular J, la constante de Curie está relacionada con los iones individuales' momentos magnéticos,
donde n es el número de átomos por unidad de volumen. El parámetro μeff se interpreta como el momento magnético efectivo por ion paramagnético. Si se utiliza un tratamiento clásico con momentos magnéticos moleculares representados como dipolos magnéticos discretos, μ, surgirá una expresión de la Ley de Curie de la misma forma con μ apareciendo en lugar de μef.
La ley de Curie puede derivarse considerando una sustancia con momentos magnéticos no interactores con impulso angular J. Si las contribuciones orbitales al momento magnético son insignificantes (un caso común), entonces en lo siguiente J = S. Si aplicamos un campo magnético a lo que elegimos llamar al z-eje, los niveles energéticos de cada centro paramagnético experimentarán la división Zeeman de sus niveles energéticos, cada uno con un z-componente etiquetado por MJ (o simplemente MS para el caso magnético sólo de giro). Aplicando estadísticas semiclásicas de Boltzmann, la magnetización de tal sustancia es
Donde μ μ MJ{displaystyle mu _{M_{J}} es z-componente del momento magnético para cada nivel de Zeeman, así que μ μ MJ=MJgJμ μ B− − μ μ B{displaystyle mu ¿Qué? _{mathrm {B}-mu _{mathrm {B} se llama el imán Bohr y gJ es el factor Landé, que reduce al factor g-electrónico libre, gS cuandoJ=S. (en este tratamiento, asumimos que x- y Sí.-componentes de la magnetización, promediados sobre todas las moléculas, cancelan porque el campo aplicado a lo largo del z-eje les deja orientados al azar.) La energía de cada nivel Zeeman es EMJ=− − MJgJμ μ BH{displaystyle E_{M_{J}=-M_{J}g_{J}mu _{mathrm {B}H}. Para temperaturas superiores a unos pocos K, MJgJμ μ BH/kBT≪ ≪ 1{displaystyle M_{J}g_{J}mu _{mathrm {B}H/k_{mathrm {B}Tll 1}, y podemos aplicar la aproximación eMJgJμ μ BH/kBT≃ ≃ 1+MJgJμ μ BH/kBT{displaystyle E^{M_{J}g_{J}mu} _{mathrm {B}H/k_{mathrm {B}T;}simeq 1+M_{J}g_{J}mu _{mathrm {B}H/k_{mathrm {B}T;}:
Cuando las contribuciones del momento angular orbital al momento magnético son pequeñas, como ocurre con la mayoría de los radicales orgánicos o con los complejos de metales de transición octaédricos con d3 o d5 de espín alto configuraciones, el momento magnético efectivo toma la forma (con factor g ge = 2.0023... ≈ 2),
Cuando la constante de Curie es nula, los efectos de segundo orden que combinan el estado fundamental con los estados excitados también pueden dar lugar a una susceptibilidad paramagnética independiente de la temperatura, conocida como susceptibilidad de Van Vleck.
Paramagnetismo de Pauli
Para algunos metales alcalinos y metales nobles, electrones de conducción son débilmente interactuando y deslocalizados en el espacio formando un gas Fermi. Para estos materiales una contribución a la respuesta magnética proviene de la interacción entre los giros electrones y el campo magnético conocido como paramagnetismo Pauli. Para un pequeño campo magnético H{displaystyle mathbf {H}, la energía adicional por electrones de la interacción entre un giro electrones y el campo magnético es dada por:
- Δ Δ E=− − μ μ 0H⋅ ⋅ μ μ e=− − μ μ 0H⋅ ⋅ ()− − geμ μ B▪ ▪ S)=± ± μ μ 0μ μ BH,{displaystyle Delta E=-mu _{0}mathbf {H} cdot {boldsymbol {mu} }_{e}=-mu ¿Por qué? {B}} {hbar}mathbf {S}right)=pm mu _{0}mu _{mathrm Sí.
Donde μ μ 0{displaystyle mu _{0}} es la permeabilidad del vacío, μ μ e{displaystyle {boldsymbol {mu} ♪♪ es el momento magnético de electrones, μ μ B{displaystyle mu _{rm {B}} es el imán Bohr, ▪ ▪ {displaystyle hbar } es la constante de Planck reducido, y el factor g cancela con la vuelta S=± ± ▪ ▪ /2{displaystyle mathbf {S} =pm hbar /2}. El ± ± {displaystyle pm } indica que el signo es positivo (negativo) cuando el componente de giro de electrones en la dirección H{displaystyle mathbf {H} es paralelo (antiparalelo) al campo magnético.
Para temperaturas bajas con respecto a la temperatura fermi TF{displaystyle T_{rm {F}} (cerca de 10)4 kelvins for metals), la densidad número de electrones n↑ ↑ {displaystyle No. ()n↓ ↓ {displaystyle No.) señalando paralelo (antiparalelo) al campo magnético se puede escribir como:
- n↑ ↑ .. ne2− − μ μ 0μ μ B2g()EF)H;()n↓ ↓ .. ne2+μ μ 0μ μ B2g()EF)H),{displaystyle ################################################################################################################################################################################################################################################################ ♫approx {frac {n_{e}{2}-{frac} {fnMicrosoft Sans Serif} _{mathrm {B}} {2}}g(E_{mathrm {F})Hquad;quad left(n_{downarrow }approx {frac} {n_{e}{2}+{frac} {fnMicrosoft Sans Serif} _{mathrm {B}}{2}g(E_{mathrm {F})Hright),}
con ne{displaystyle n_{e} la densidad total de electrónica libre y g()EF){displaystyle g(E_{mathrm {F})} la densidad electrónica de estados (número de estados por energía por volumen) en la energía fermi EF{displaystyle E_{mathrm {F}.
En esta aproximación, la magnetización se expresa como el momento magnético de un electrón multiplicado por la diferencia de densidades:
- M=μ μ B()n↓ ↓ − − n↑ ↑ )=μ μ 0μ μ B2g()EF)H,{displaystyle M=mu _{mathrm {B}(n_{downarrow ¿Qué? _{mathrm [B] } {2}g(E_{mathrm {F})H,}
lo que produce una susceptibilidad paramagnética positiva independiente de la temperatura:
- χ χ P=μ μ 0μ μ B2g()EF).{displaystyle chi _{mathrm {P}=mu ~ {0}mu}mu} _{mathrm {B}} {2}g(E_{mathrm {F}).}
La susceptibilidad paramagnética Pauli es un efecto macroscópico y tiene que ser contrastado con la susceptibilidad diamagnética de Landau que es igual a menos un tercio de los Pauli y también viene de electrones deslocalizados. La susceptibilidad de Pauli proviene de la interacción de la columna con el campo magnético mientras que la susceptibilidad de Landau proviene del movimiento espacial de los electrones y es independiente de la vuelta. En semiconductores dopados la relación entre las susceptibilidades de Landau y Pauli cambia como la masa efectiva de los portadores de carga mAlternativa Alternativa {displaystyle m^{*} puede diferir de la masa de electrones me{displaystyle m_{e}.
La respuesta magnética calculada para un gas de electrones no es la imagen completa, ya que se debe incluir la susceptibilidad magnética proveniente de los iones. Además, estas fórmulas pueden descomponerse para sistemas confinados que difieren del grueso, como puntos cuánticos, o para campos altos, como se demuestra en el efecto De Haas-Van Alphen.
El paramagnetismo de Pauli lleva el nombre del físico Wolfgang Pauli. Antes de la teoría de Pauli, la falta de un fuerte paramagnetismo de Curie en los metales era un problema abierto, ya que el modelo líder de Drude no podía explicar esta contribución sin el uso de estadísticas cuánticas. El paramagnetismo de Pauli y el diamagnetismo de Landau son esencialmente aplicaciones del modelo de espín y de electrones libres, el primero se debe al espín intrínseco de los electrones; el segundo se debe a su movimiento orbital.
Ejemplos de paramagnetos
Los materiales que se denominan "paramagnetos" son con mayor frecuencia aquellos que exhiben, al menos en un rango de temperatura apreciable, susceptibilidades magnéticas que se adhieren a las leyes de Curie o Curie-Weiss. En principio, cualquier sistema que contenga átomos, iones o moléculas con espines no apareados puede denominarse paramagneto, pero es necesario considerar cuidadosamente las interacciones entre ellos.
Sistemas con interacciones mínimas
La definición más estrecha sería: un sistema con giros no emparejados que no interactúan entre sí. En este sentido más estricto, el único paramagneto puro es un gas diluido de átomos de hidrógeno monoatómicos. Cada átomo tiene un electrón desapareado que no interactúa.
Un gas de átomos de litio ya posee dos electrones centrales emparejados que producen una respuesta diamagnética de signo opuesto. Estrictamente hablando, Li es un sistema mixto, por lo tanto, aunque se admite que el componente diamagnético es débil y, a menudo, se descuida. En el caso de elementos más pesados el aporte diamagnético cobra mayor importancia y en el caso del oro metálico domina las propiedades. El elemento hidrógeno prácticamente nunca se llama 'paramagnético' porque el gas monoatómico es estable solo a temperaturas extremadamente altas; Los átomos de H se combinan para formar H2 molecular y, al hacerlo, los momentos magnéticos se pierden (apagan), debido al par de espines. Por lo tanto, el hidrógeno es diamagnético y lo mismo ocurre con muchos otros elementos. Aunque la configuración electrónica de los átomos individuales (e iones) de la mayoría de los elementos contienen espines no apareados, no son necesariamente paramagnéticos, porque a temperatura ambiente la extinción es más la regla que la excepción. La tendencia de extinción es más débil para los electrones f porque los orbitales f (especialmente 4f) se contraen radialmente y se superponen solo débilmente con los orbitales de los átomos adyacentes. En consecuencia, los elementos lantánidos con orbitales 4f incompletamente llenos son paramagnéticos o están ordenados magnéticamente.
| Material | μeff/μB |
|---|---|
| [Cr(NH)3)6]Br3 | 3.77 |
| K3[Cr(CN)6] | 3.87 |
| K3[MoCl]6] | 3.79 |
| K4[V(CN)6] | 3.78 |
| [Mn(NH)3)6]Cl2 | 5.92 |
| (NH)4)2[Mn(SO)4)2]·6H2O | 5.92 |
| NH4[Fe(SO)4)2]·12H2O | 5.89 |
Por lo tanto, los paramagnetos de fase condensada solo son posibles si las interacciones de los espines que conducen a la extinción o al ordenamiento se mantienen a raya mediante el aislamiento estructural de los centros magnéticos. Hay dos clases de materiales para los que esto es válido:
- Materiales moleculares con un centro paramagnético aislado.
- Los buenos ejemplos son complejos de coordinación de d- o f-metales o proteínas con tales centros, por ejemplo mioglobina. En tales materiales la parte orgánica de la molécula actúa como un sobre blindando los giros de sus vecinos.
- Las pequeñas moléculas pueden ser estables en forma radical, oxígeno O2 es un buen ejemplo. Estos sistemas son muy raros porque tienden a ser bastante reactivas.
- Sistemas diluidos.
- Disolver una especie paramagnética en una celosía diamagnética a pequeñas concentraciones, por ejemplo. Nd3+ en CaCl2 separará los iones de neodimio en grandes distancias que no interactúan. Estos sistemas son de máxima importancia para lo que se puede considerar el método más sensible para estudiar sistemas paramagnéticos: EPR.
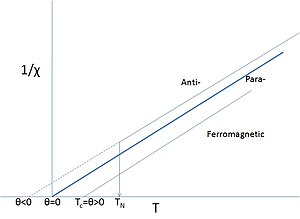
Sistemas con interacciones
Como se indicó anteriormente, muchos materiales que contienen elementos d o f retienen espines sin apagar. Las sales de tales elementos a menudo muestran un comportamiento paramagnético, pero a temperaturas lo suficientemente bajas, los momentos magnéticos pueden ordenarse. No es raro llamar a estos materiales 'paramagnetos', cuando se hace referencia a su comportamiento paramagnético por encima de sus puntos Curie o Néel, especialmente si dichas temperaturas son muy bajas o nunca se han medido correctamente. Incluso para el hierro no es raro decir que el hierro se convierte en un paramagneto por encima de su punto de Curie relativamente alto. En ese caso, el punto de Curie se ve como una transición de fase entre un ferromagnético y un "paramagnético". La palabra paramagnet ahora simplemente se refiere a la respuesta lineal del sistema a un campo aplicado, cuya dependencia de la temperatura requiere una versión modificada de la ley de Curie, conocida como la ley de Curie-Weiss:
- M=CT− − Silencio Silencio H{displaystyle mathbf {M} ={frac {C}{T-theta # Mathbf {H}
Esta ley modificada incluye un término θ que describe la interacción de intercambio que está presente aunque superada por el movimiento térmico. El signo de θ depende de si dominan las interacciones ferromagnéticas o antiferromagnéticas y rara vez es exactamente cero, excepto en los casos diluidos y aislados mencionados anteriormente.
Obviamente, la descripción paramagnética de Curie-Weiss arriba de TN o TC es una interpretación bastante diferente de la palabra "paramagnet" ya que no implica la ausencia de interacciones, sino que la estructura magnética es aleatoria en ausencia de un campo externo a estas temperaturas suficientemente altas. Incluso si θ está cerca de cero, esto no significa que no haya interacciones, solo que los ferromagnéticos alineados y los antiferromagnéticos antialineados se cancelan. Una complicación adicional es que las interacciones a menudo son diferentes en diferentes direcciones de la red cristalina (anisotropía), lo que lleva a estructuras magnéticas complicadas una vez ordenadas.
La aleatoriedad de la estructura también se aplica a los muchos metales que muestran una respuesta paramagnética neta en un amplio rango de temperatura. Sin embargo, no siguen una ley de tipo Curie en función de la temperatura; a menudo son más o menos independientes de la temperatura. Este tipo de comportamiento es de naturaleza itinerante y mejor llamado Pauli-paramagnetismo, pero no es inusual ver, por ejemplo, el metal aluminio llamado "paramagnet", aunque las interacciones son lo suficientemente fuertes como para dar este Elemento de muy buena conductividad eléctrica.
Superparaimanes
Algunos materiales muestran un comportamiento magnético inducido que sigue una ley de tipo Curie pero con valores excepcionalmente altos para las constantes de Curie. Estos materiales se conocen como superparaimanes. Se caracterizan por un fuerte tipo de acoplamiento ferromagnético o ferrimagnético en dominios de un tamaño limitado que se comportan de forma independiente entre sí. Las propiedades generales de un sistema de este tipo se asemejan a las de un paramagneto, pero están ordenadas a nivel microscópico. Los materiales muestran una temperatura de ordenación por encima de la cual el comportamiento vuelve al paramagnetismo ordinario (con interacción). Los ferrofluidos son un buen ejemplo, pero el fenómeno también puede ocurrir dentro de los sólidos, por ejemplo, cuando se introducen centros paramagnéticos diluidos en un medio itinerante fuerte de acoplamiento ferromagnético, como cuando se sustituye Fe en TlCu2Se2 o la aleación AuFe. Dichos sistemas contienen grupos acoplados ferromagnéticamente que se congelan a temperaturas más bajas. También se les llama microimanes.
Contenido relacionado
Blaise Pascual
Salto cuántico
Gravedad cuántica

















![{displaystyle M=n{bar {m}}={frac {n}{3k_{mathrm {B} }T}}left[g_{J}^{2}J(J+1)mu _{mathrm {B} }^{2}right]H,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/257d97112cc5f0ec19efdb3501671be22be79a85)