Etimología de los nombres de los elementos químicos
Este artículo enumera la etimología de los elementos químicos de la tabla... (leer más)
El óxido de plomo (II), también llamado monóxido de plomo, es el compuesto inorgánico con la fórmula molecular PbO. PbO se presenta en dos polimorfos: litharge que tiene una estructura cristalina tetragonal y masicot que tiene una estructura cristalina ortorrómbica. Las aplicaciones modernas para PbO se encuentran principalmente en vidrio industrial a base de plomo y cerámica industrial, incluidos los componentes informáticos. Es un óxido anfótero.
El PbO se puede preparar calentando plomo metálico en el aire a aproximadamente 600 °C (1100 °F). A esta temperatura también es el producto final de la descomposición de otros óxidos de plomo en el aire:
La descomposición térmica de nitrato de plomo (II) o carbonato de plomo (II) también da como resultado la formación de PbO:2 Pb(NO3)2→ 2 PbO + 4 NO2+ O2PbCO3→ PbO + CO2
El PbO se produce a gran escala como producto intermedio en la refinación de minerales de plomo en bruto en plomo metálico. El mineral de plomo habitual es la galena (sulfuro de plomo (II)). A una temperatura de alrededor de 1000 ° C (1800 ° F), el sulfuro se convierte en óxido:2 PbS + 3 O2→ 2 PbO + 2 SO 2
Según lo determinado por la cristalografía de rayos X, ambos polimorfos, tetragonales y ortorrómbicos, presentan un centro principal piramidal de cuatro coordenadas. En la forma tetragonal los cuatro enlaces plomo-oxígeno tienen la misma longitud, pero en la ortorrómbica dos son más cortos y dos más largos. La naturaleza piramidal indica la presencia de un par de electrones solitarios estereoquímicamente activos. Cuando el PbO se presenta en una estructura reticular tetragonal, se denomina litargirio; y cuando el PbO tiene estructura reticular ortorrómbica se denomina masicot. El PbO se puede cambiar de masicot a litargirio o viceversa mediante calefacción y refrigeración controladas. La forma tetragonal suele ser de color rojo o naranja, mientras que la ortorrómbica suele ser de color amarillo o naranja, pero el color no es un indicador muy fiable de la estructura.Las formas tetragonal y ortorrómbica de PbO ocurren naturalmente como minerales raros.
| celda unitaria | Embalaje | Embalaje | Embalaje | Coordinación de plomo | coordinación de oxígeno |
|---|---|---|---|---|---|
 | 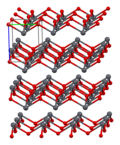 | 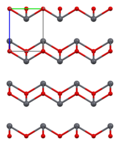 |  |  | 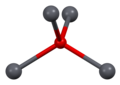 |
| 3 × 3 × 3 celdas unitarias | visto a lo largo del eje a | visto a lo largo del eje c | pirámide cuadrada | tetraédrico distorsionado |
El plomo metálico se obtiene reduciendo PbO con monóxido de carbono a alrededor de 1200 ° C (2200 ° F):PbO + CO → Pb + CO2
Las formas roja y amarilla de este material están relacionadas por un pequeño cambio en la entalpía:PbO (rojo) → PbO (amarillo) Δ H = 1,6 kJ/mol
El PbO es anfótero, lo que significa que reacciona tanto con ácidos como con bases. Con ácidos forma sales de Pba través de la intermediación de grupos oxo como [Pb6OH)6]. Con bases fuertes, el PbO se disuelve para formar sales de plumbita (también llamada plumbato (II)):PbO + H 2 O + OH→ [Pb(OH)3]
El tipo de plomo en el vidrio emplomado normalmente es PbO, y el PbO se usa ampliamente en la fabricación de vidrio. Según el vidrio, el beneficio de usar PbO en el vidrio puede ser uno o más: aumentar el índice de refracción del vidrio, disminuir la viscosidad del vidrio, aumentar la resistividad eléctrica del vidrio y aumentar la capacidad del vidrio para absorber Rayos X. Agregar PbO a la cerámica industrial (así como al vidrio) hace que los materiales sean más inertes magnética y eléctricamente (al aumentar su temperatura de Curie) y, a menudo, se usa para este propósito. Históricamente, el PbO también se usó ampliamente en esmaltes cerámicos para cerámica doméstica, y todavía se usa, pero ya no de manera extensiva. Otras aplicaciones menos dominantes incluyen la vulcanización del caucho y la producción de ciertos pigmentos y pinturas.El PbO se usa en el vidrio de los tubos de rayos catódicos para bloquear la emisión de rayos X, pero principalmente en el cuello y el embudo porque puede causar decoloración cuando se usa en la placa frontal. Se prefieren el óxido de estroncio y el óxido de bario para la placa frontal.
El consumo de plomo y, por lo tanto, el procesamiento de PbO, se correlaciona con la cantidad de automóviles, ya que sigue siendo el componente clave de las baterías de plomo-ácido para automóviles.
Una mezcla de PbO con glicerina fragua en un cemento duro e impermeable que se ha utilizado para unir los lados y fondos de vidrio plano de los acuarios, y también se usó una vez para sellar paneles de vidrio en marcos de ventanas. Es un componente de las pinturas con plomo.
El PbO era una de las materias primas de los huevos del siglo, un tipo de huevo conservado chino. pero ha sido reemplazado gradualmente debido a problemas de salud. Era una práctica sin escrúpulos en algunas fábricas pequeñas, pero se generalizó en China y obligó a muchos fabricantes honestos a etiquetar sus cajas como "sin plomo" después de que el escándalo se generalizara en 2013.
En forma de litargirio tetragonal en polvo, se puede mezclar con aceite de linaza y luego hervir para crear un apresto resistente a la intemperie que se usa para dorar. El litargirio le daría al apresto un color rojo oscuro que hacía que el pan de oro pareciera cálido y lustroso, mientras que el aceite de linaza impartía adherencia y una superficie de unión plana y duradera.
El PbO se usa en ciertas reacciones de condensación en síntesis orgánica.
PbO es el fotoconductor de entrada en un tubo de cámara de video llamado Plumbicon.
El óxido de plomo puede ser fatal si se ingiere o inhala. Provoca irritación en la piel, los ojos y las vías respiratorias. Afecta el tejido de las encías, el sistema nervioso central, los riñones, la sangre y el sistema reproductivo. Puede bioacumularse en plantas y en mamíferos.
Este artículo enumera la etimología de los elementos químicos de la tabla... (leer más)
El grupo 10, numerado según el estilo actual de la IUPAC, es el grupo de elementos químicos en la tabla periódica que consta de níquel paladio platino y... (leer más)
En química orgánica, el efecto anomérico o efecto Edward-Lemieux es un efecto estereoelectrónico que describe la tendencia de los sustituyentes... (leer más)