Núcleo atómico
El núcleo atómico es la región pequeña y densa que consta de protones y neutrones en el centro de un átomo, descubierta en 1911 por Ernest Rutherford basándose en el experimento de lámina de oro Geiger-Marsden de 1909. Después del descubrimiento del neutrón en 1932, Dmitri Ivanenko y Werner Heisenberg desarrollaron rápidamente modelos para un núcleo compuesto por protones y neutrones. Un átomo se compone de un núcleo cargado positivamente, con una nube de electrones cargados negativamente que lo rodea, unidos por la fuerza electrostática. Casi toda la masa de un átomo se encuentra en el núcleo, con una contribución muy pequeña de la nube de electrones. Los protones y los neutrones se unen para formar un núcleo por la fuerza nuclear.
El diámetro del núcleo está en el rango de1.70 fm (1,70 × 10 m) para el hidrógeno (el diámetro de un solo protón) hasta aproximadamente11,7 fm para uranio. Estas dimensiones son mucho más pequeñas que el diámetro del átomo mismo (núcleo + nube de electrones), por un factor de aproximadamente 26.634 (el radio atómico del uranio es de aproximadamente156 p. m. (156 × 10 m)) a aproximadamente 60 250 (el radio atómico del hidrógeno es de aproximadamente52:92 p. m.).
La rama de la física que se ocupa del estudio y la comprensión del núcleo atómico, incluida su composición y las fuerzas que lo unen, se denomina física nuclear.
Introducción
Historia
El núcleo fue descubierto en 1911, como resultado de los esfuerzos de Ernest Rutherford para probar el "modelo de budín de ciruelas" del átomo de Thomson.El electrón ya había sido descubierto por JJ Thomson. Sabiendo que los átomos son eléctricamente neutros, JJThomson postuló que también debe haber una carga positiva. En su modelo de budín de ciruelas, Thomson sugirió que un átomo constaba de electrones negativos dispersos al azar dentro de una esfera de carga positiva. Más tarde, Ernest Rutherford ideó un experimento con su compañero de investigación Hans Geiger y con la ayuda de Ernest Marsden, que involucró la desviación de partículas alfa (núcleos de helio) dirigidas a una delgada lámina de metal. Razonó que si el modelo de JJ Thomson fuera correcto, las partículas alfa cargadas positivamente pasarían fácilmente a través de la lámina con muy poca desviación en sus caminos, ya que la lámina debería actuar como eléctricamente neutra si las cargas negativas y positivas están tan íntimamente mezcladas como para formar parece neutral. Para su sorpresa, muchas de las partículas fueron desviadas en ángulos muy grandes. Debido a que la masa de una partícula alfa es aproximadamente 8000 veces mayor que la de un electrón, se hizo evidente que debe estar presente una fuerza muy fuerte para poder desviar las partículas alfa masivas y de rápido movimiento. Se dio cuenta de que el modelo del pudín de ciruelas no podía ser exacto y que las desviaciones de las partículas alfa solo podían explicarse si las cargas positivas y negativas estaban separadas entre sí y que la masa del átomo era un punto concentrado de carga positiva. Esto justificaba la idea de un átomo nuclear con un centro denso de carga y masa positivas. se hizo evidente que una fuerza muy fuerte debe estar presente si podía desviar las partículas alfa masivas y de rápido movimiento. Se dio cuenta de que el modelo del pudín de ciruelas no podía ser exacto y que las desviaciones de las partículas alfa solo podían explicarse si las cargas positivas y negativas estaban separadas entre sí y que la masa del átomo era un punto concentrado de carga positiva. Esto justificaba la idea de un átomo nuclear con un centro denso de carga y masa positivas. se hizo evidente que una fuerza muy fuerte debe estar presente si podía desviar las partículas alfa masivas y de rápido movimiento. Se dio cuenta de que el modelo del pudín de ciruelas no podía ser exacto y que las desviaciones de las partículas alfa solo podían explicarse si las cargas positivas y negativas estaban separadas entre sí y que la masa del átomo era un punto concentrado de carga positiva. Esto justificaba la idea de un átomo nuclear con un centro denso de carga y masa positivas.
Etimología
El término núcleo proviene de la palabra latina núcleo, un diminutivo de nux ('nuez'), que significa 'el grano' (es decir, la 'nuez pequeña') dentro de un tipo de fruta acuosa (como un melocotón). En 1844, Michael Faraday utilizó el término para referirse al "punto central de un átomo". El significado atómico moderno fue propuesto por Ernest Rutherford en 1912. Sin embargo, la adopción del término "núcleo" en la teoría atómica no fue inmediata. En 1916, por ejemplo, Gilbert N. Lewis afirmó, en su famoso artículo El átomo y la molécula, que "el átomo está compuesto por el núcleo y un átomo exterior o capa " .lo que significa que kernel se usa para núcleo en alemán y holandés.
Maquillaje nuclear
El núcleo de un átomo consta de neutrones y protones, que a su vez son la manifestación de partículas más elementales, llamadas quarks, que se mantienen asociadas por la fuerza nuclear fuerte en ciertas combinaciones estables de hadrones, llamadas bariones. La fuerza fuerte nuclear se extiende lo suficientemente lejos de cada barión como para unir los neutrones y los protones contra la fuerza eléctrica repulsiva entre los protones cargados positivamente. La fuerza nuclear fuerte tiene un alcance muy corto y esencialmente cae a cero justo más allá del borde del núcleo. La acción colectiva del núcleo cargado positivamente es mantener los electrones cargados eléctricamente negativamente en sus órbitas alrededor del núcleo. La colección de electrones cargados negativamente que orbitan alrededor del núcleo muestra una afinidad por ciertas configuraciones y números de electrones que hacen que sus órbitas sean estables. El elemento químico que representa un átomo está determinado por el número de protones en el núcleo; el átomo neutro tendrá un número igual de electrones orbitando ese núcleo. Los elementos químicos individuales pueden crear configuraciones electrónicas más estables al combinarse para compartir sus electrones. Es ese intercambio de electrones para crear órbitas electrónicas estables alrededor de los núcleos lo que nos parece la química de nuestro macro mundo. Los elementos químicos individuales pueden crear configuraciones electrónicas más estables al combinarse para compartir sus electrones. Es ese intercambio de electrones para crear órbitas electrónicas estables alrededor de los núcleos lo que nos parece la química de nuestro macro mundo. Los elementos químicos individuales pueden crear configuraciones electrónicas más estables al combinarse para compartir sus electrones. Es ese intercambio de electrones para crear órbitas electrónicas estables alrededor de los núcleos lo que nos parece la química de nuestro macro mundo.
Los protones definen la carga total de un núcleo y, por lo tanto, su identidad química. Los neutrones son eléctricamente neutros, pero contribuyen a la masa de un núcleo casi en la misma medida que los protones. Los neutrones pueden explicar el fenómeno de los isótopos (mismo número atómico con diferente masa atómica). El papel principal de los neutrones es reducir la repulsión electrostática dentro del núcleo.
Composición y forma
Los protones y los neutrones son fermiones, con diferentes valores del número cuántico de isospín fuerte, por lo que dos protones y dos neutrones pueden compartir la misma función de onda espacial ya que no son entidades cuánticas idénticas. A veces se ven como dos estados cuánticos diferentes de la misma partícula, el nucleón. Dos fermiones, como dos protones, o dos neutrones, o un protón + neutrón (el deuterón) pueden exhibir un comportamiento bosónico cuando se unen libremente en pares, que tienen espín entero.
En el raro caso de un hipernúcleo, un tercer barión llamado hiperón, que contiene uno o más quarks extraños y/u otros quarks inusuales, también puede compartir la función de onda. Sin embargo, este tipo de núcleo es extremadamente inestable y no se encuentra en la Tierra excepto en experimentos de física de alta energía.
El neutrón tiene un núcleo cargado positivamente de radio ≈ 0,3 fm rodeado por una carga negativa compensatoria de radio entre 0,3 fm y 2 fm. El protón tiene una distribución de carga positiva que decae exponencialmente con un radio cuadrático medio de alrededor de 0,8 fm.
Los núcleos pueden ser esféricos, en forma de pelota de rugby (deformación alargada), en forma de disco (deformación achatada), triaxiales (una combinación de deformación achatada y alargada) o en forma de pera.
Efectivo
Los núcleos están unidos por la fuerza fuerte residual (fuerza nuclear). La fuerza fuerte residual es un residuo menor de la interacción fuerte que une a los quarks para formar protones y neutrones. Esta fuerza es mucho más débil entre neutrones y protones porque en su mayor parte está neutralizada dentro de ellos, de la misma manera que las fuerzas electromagnéticas entre átomos neutros (como las fuerzas de van der Waals que actúan entre dos átomos de gas inerte) son mucho más débiles que las fuerzas electromagnéticas que mantienen unidas internamente las partes de los átomos (por ejemplo, las fuerzas que mantienen los electrones en un átomo de gas inerte unido a su núcleo).
La fuerza nuclear es muy atractiva a la distancia de separación típica de los nucleones, y esto supera la repulsión entre los protones debido a la fuerza electromagnética, lo que permite que existan los núcleos. Sin embargo, la fuerza fuerte residual tiene un alcance limitado porque decae rápidamente con la distancia (ver potencial de Yukawa); por lo tanto, solo los núcleos más pequeños que un cierto tamaño pueden ser completamente estables. El núcleo completamente estable más grande conocido (es decir, estable a la desintegración alfa, beta y gamma) es el plomo-208, que contiene un total de 208 nucleones (126 neutrones y 82 protones). Los núcleos más grandes que este máximo son inestables y tienden a tener una vida cada vez más corta con un mayor número de nucleones. Sin embargo, el bismuto-209 también es estable a la desintegración beta y tiene la vida media más larga a la desintegración alfa de cualquier isótopo conocido.
La fuerza fuerte residual es efectiva en un rango muy corto (generalmente solo unos pocos femtómetros (fm); aproximadamente uno o dos diámetros de nucleones) y provoca una atracción entre cualquier par de nucleones. Por ejemplo, entre protones y neutrones para formar [NP] deuterón, y también entre protones y protones, y neutrones y neutrones.
Límites de rango de fuerza nuclear y núcleos de halo
El límite absoluto efectivo del rango de la fuerza nuclear (también conocido como fuerza fuerte residual) está representado por núcleos de halo como el litio-11 o el boro-14, en los que los dineutrones, u otras colecciones de neutrones, orbitan a distancias de aproximadamente10 fm (más o menos similar a la8 fm radio del núcleo de uranio-238). Estos núcleos no son máximamente densos. Los núcleos de halo se forman en los bordes extremos del gráfico de los nucleidos (la línea de goteo de neutrones y la línea de goteo de protones) y son todos inestables con vidas medias cortas, medidas en milisegundos; por ejemplo, el litio-11 tiene una vida media de8,8 ms.
En efecto, los halos representan un estado excitado con nucleones en una capa cuántica externa que tiene niveles de energía vacíos "por debajo" (tanto en términos de radio como de energía). El halo puede estar formado por neutrones [NN, NNN] o protones [PP, PPP]. Los núcleos que tienen un solo halo de neutrones incluyen Be y C. He, Li, B, B y C exhiben un halo de dos neutrones . este comportamiento (refiriéndose a un sistema de tres anillos entrelazados en el que romper cualquier anillo libera a los otros dos). Tanto él como Be exhiben un halo de cuatro neutrones. Los núcleos que tienen un halo de protones incluyen B yP. Ne y S exhiben un halo de dos protones. Se espera que los halos de protones sean más raros e inestables que los ejemplos de neutrones, debido a las fuerzas electromagnéticas repulsivas del exceso de protones.
Modelos nucleares
Aunque se cree ampliamente que el modelo estándar de la física describe completamente la composición y el comportamiento del núcleo, generar predicciones a partir de la teoría es mucho más difícil que para la mayoría de las otras áreas de la física de partículas. Esto se debe a dos razones:
- En principio, la física dentro de un núcleo puede derivarse completamente de la cromodinámica cuántica (QCD). Sin embargo, en la práctica, los enfoques computacionales y matemáticos actuales para resolver QCD en sistemas de baja energía como los núcleos son extremadamente limitados. Esto se debe a la transición de fase que se produce entre la materia de quarks de alta energía y la materia hadrónica de baja energía, lo que hace que las técnicas perturbativas sean inutilizables, lo que dificulta la construcción de un modelo preciso derivado de QCD de las fuerzas entre nucleones. Los enfoques actuales se limitan a modelos fenomenológicos como el potencial de Argonne v18 o la teoría del campo efectivo quiral.
- Incluso si la fuerza nuclear está bien restringida, se requiere una cantidad significativa de potencia computacional para calcular con precisión las propiedades de los núcleos ab initio. Los desarrollos en la teoría de muchos cuerpos han hecho esto posible para muchos núcleos relativamente estables y de baja masa, pero se requieren mejoras adicionales tanto en el poder computacional como en los enfoques matemáticos antes de que se puedan abordar los núcleos pesados o los núcleos altamente inestables.
Históricamente, los experimentos se han comparado con modelos relativamente toscos que son necesariamente imperfectos. Ninguno de estos modelos puede explicar por completo los datos experimentales sobre la estructura nuclear.
El radio nuclear (R) se considera una de las cantidades básicas que cualquier modelo debe predecir. Para núcleos estables (no núcleos halo u otros núcleos distorsionados inestables) el radio nuclear es aproximadamente proporcional a la raíz cúbica del número de masa (A) del núcleo, y particularmente en núcleos que contienen muchos nucleones, ya que se organizan en configuraciones más esféricas:
El núcleo estable tiene aproximadamente una densidad constante y, por lo tanto, el radio nuclear R se puede aproximar mediante la siguiente fórmula,{displaystyle R=r_{0}A^{1/3},}
donde A = Número de masa atómica (el número de protones Z, más el número de neutrones N) y r 0 = 1,25 fm = 1,25 × 10 m. En esta ecuación, la "constante" r 0 varía en 0,2 fm, según el núcleo en cuestión, pero esto es menos del 20% de cambio de una constante.
En otras palabras, empaquetar protones y neutrones en el núcleo da aproximadamente el mismo resultado de tamaño total que empaquetar esferas duras de un tamaño constante (como canicas) en una bolsa esférica o casi esférica apretada (algunos núcleos estables no son del todo esféricos, pero se sabe que ser prolato).
Los modelos de estructura nuclear incluyen:
Modelo de gota de líquido
Los primeros modelos del núcleo veían el núcleo como una gota de líquido en rotación. En este modelo, la compensación de las fuerzas electromagnéticas de largo alcance y las fuerzas nucleares de relativamente corto alcance provocan juntas un comportamiento que se asemeja a las fuerzas de tensión superficial en gotas líquidas de diferentes tamaños. Esta fórmula logra explicar muchos fenómenos importantes de los núcleos, como las cantidades cambiantes de energía de enlace a medida que cambia su tamaño y composición (consulte la fórmula de masa semiempírica), pero no explica la estabilidad especial que se produce cuando los núcleos tienen " números mágicos" de protones o neutrones.
Los términos de la fórmula de masa semiempírica, que se puede utilizar para aproximar la energía de enlace de muchos núcleos, se consideran como la suma de cinco tipos de energías (ver más abajo). Luego, la imagen de un núcleo como una gota de líquido incompresible explica aproximadamente la variación observada de la energía de enlace del núcleo:
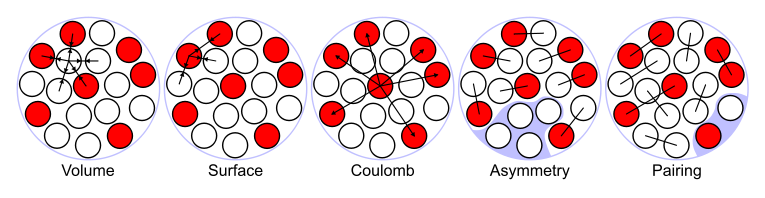
Volumen de energía. Cuando un conjunto de nucleones del mismo tamaño se empaqueta en el volumen más pequeño, cada nucleon interior tiene una cierta cantidad de otros nucleones en contacto con él. Entonces, esta energía nuclear es proporcional al volumen.
Energía superficial. Un nucleón en la superficie de un núcleo interactúa con menos otros nucleones que uno en el interior del núcleo y, por lo tanto, su energía de enlace es menor. Este término de energía superficial lo tiene en cuenta y, por lo tanto, es negativo y proporcional al área superficial.
Energía de culombio. La repulsión eléctrica entre cada par de protones en un núcleo contribuye a disminuir su energía de enlace.
Energía de asimetría (también llamada Energía de Pauli). Una energía asociada al principio de exclusión de Pauli. Si no fuera por la energía de Coulomb, la forma más estable de materia nuclear tendría el mismo número de neutrones que de protones, ya que un número desigual de neutrones y protones implica llenar niveles de energía más altos para un tipo de partícula, dejando vacantes niveles de energía más bajos para el otro tipo.
Emparejamiento de energía. Una energía que es un término de corrección que surge de la tendencia a que se produzcan pares de protones y pares de neutrones. Un número par de partículas es más estable que un número impar.
Modelos de caparazón y otros modelos cuánticos
También se han propuesto varios modelos para el núcleo en los que los nucleones ocupan orbitales, al igual que los orbitales atómicos en la teoría de la física atómica. Estos modelos de ondas imaginan que los nucleones son partículas puntuales sin tamaño en pozos potenciales, u ondas de probabilidad como en el "modelo óptico", que orbitan sin fricción a alta velocidad en pozos potenciales.
En los modelos anteriores, los nucleones pueden ocupar orbitales en pares, debido a que son fermiones, lo que permite la explicación de Z y N par/impar.efectos bien conocidos de los experimentos. La naturaleza y capacidad exactas de las capas nucleares difieren de las de los electrones en los orbitales atómicos, principalmente porque el pozo de potencial en el que se mueven los nucleones (especialmente en los núcleos más grandes) es bastante diferente del pozo de potencial electromagnético central que une los electrones en los átomos. Se puede ver cierta semejanza con los modelos de orbitales atómicos en un núcleo atómico pequeño como el del helio-4, en el que los dos protones y dos neutrones ocupan por separado orbitales 1s análogos al orbital 1s de los dos electrones en el átomo de helio, y logran inusuales estabilidad por la misma razón. Los núcleos con 5 nucleones son extremadamente inestables y de corta duración, sin embargo, el helio-3, con 3 nucleones, es muy estable incluso sin una capa orbital 1s cerrada. Otro núcleo con 3 nucleones, el tritón hidrógeno-3 es inestable y se descompone en helio-3 cuando se aísla. La estabilidad nuclear débil con 2 nucleones {NP} en el orbital 1s se encuentra en el deuterón hidrógeno-2, con solo un nucleón en cada uno de los pozos de potencial de protones y neutrones. Si bien cada nucleón es un fermión, el {NP} deuterón es un bosón y, por lo tanto, no sigue la exclusión de Pauli para el empaquetamiento cerrado dentro de las capas. El litio-6 con 6 nucleones es muy estable sin un segundo orbital de capa 1p cerrado. Para núcleos ligeros con números de nucleones totales de 1 a 6, solo aquellos con 5 no muestran alguna evidencia de estabilidad. Las observaciones de la estabilidad beta de los núcleos ligeros fuera de las capas cerradas indican que la estabilidad nuclear es mucho más compleja que el simple cierre de los orbitales de las capas con números mágicos de protones y neutrones. La estabilidad nuclear débil con 2 nucleones {NP} en el orbital 1s se encuentra en el deuterón hidrógeno-2, con solo un nucleón en cada uno de los pozos de potencial de protones y neutrones. Si bien cada nucleón es un fermión, el {NP} deuterón es un bosón y, por lo tanto, no sigue la exclusión de Pauli para el empaquetamiento cerrado dentro de las capas. El litio-6 con 6 nucleones es muy estable sin un segundo orbital de capa 1p cerrado. Para núcleos ligeros con números de nucleones totales de 1 a 6, solo aquellos con 5 no muestran alguna evidencia de estabilidad. Las observaciones de la estabilidad beta de los núcleos ligeros fuera de las capas cerradas indican que la estabilidad nuclear es mucho más compleja que el simple cierre de los orbitales de las capas con números mágicos de protones y neutrones. La estabilidad nuclear débil con 2 nucleones {NP} en el orbital 1s se encuentra en el deuterón hidrógeno-2, con solo un nucleón en cada uno de los pozos de potencial de protones y neutrones. Si bien cada nucleón es un fermión, el {NP} deuterón es un bosón y, por lo tanto, no sigue la exclusión de Pauli para el empaquetamiento cerrado dentro de las capas. El litio-6 con 6 nucleones es muy estable sin un segundo orbital de capa 1p cerrado. Para núcleos ligeros con números de nucleones totales de 1 a 6, solo aquellos con 5 no muestran alguna evidencia de estabilidad. Las observaciones de la estabilidad beta de los núcleos ligeros fuera de las capas cerradas indican que la estabilidad nuclear es mucho más compleja que el simple cierre de los orbitales de las capas con números mágicos de protones y neutrones. Si bien cada nucleón es un fermión, el {NP} deuterón es un bosón y, por lo tanto, no sigue la exclusión de Pauli para el empaquetamiento cerrado dentro de las capas. El litio-6 con 6 nucleones es muy estable sin un segundo orbital de capa 1p cerrado. Para núcleos ligeros con números de nucleones totales de 1 a 6, solo aquellos con 5 no muestran alguna evidencia de estabilidad. Las observaciones de la estabilidad beta de los núcleos ligeros fuera de las capas cerradas indican que la estabilidad nuclear es mucho más compleja que el simple cierre de los orbitales de las capas con números mágicos de protones y neutrones. Si bien cada nucleón es un fermión, el {NP} deuterón es un bosón y, por lo tanto, no sigue la exclusión de Pauli para el empaquetamiento cerrado dentro de las capas. El litio-6 con 6 nucleones es muy estable sin un segundo orbital de capa 1p cerrado. Para núcleos ligeros con números de nucleones totales de 1 a 6, solo aquellos con 5 no muestran alguna evidencia de estabilidad. Las observaciones de la estabilidad beta de los núcleos ligeros fuera de las capas cerradas indican que la estabilidad nuclear es mucho más compleja que el simple cierre de los orbitales de las capas con números mágicos de protones y neutrones.
Para núcleos más grandes, las capas ocupadas por nucleones comienzan a diferir significativamente de las capas de electrones, pero, sin embargo, la teoría nuclear actual predice los números mágicos de capas nucleares llenas tanto para protones como para neutrones. El cierre de las capas estables predice configuraciones inusualmente estables, análogas al grupo noble de gases casi inertes en química. Un ejemplo es la estabilidad de la capa cerrada de 50 protones, que permite que el estaño tenga 10 isótopos estables, más que cualquier otro elemento. De manera similar, la distancia desde el cierre de la capa explica la inusual inestabilidad de los isótopos que tienen números lejos de ser estables de estas partículas, como los elementos radiactivos 43 (tecnecio) y 61 (prometio), cada uno de los cuales está precedido y seguido por 17 o más. elementos estables.
Sin embargo, existen problemas con el modelo de capas cuando se intenta dar cuenta de las propiedades nucleares lejos de las capas cerradas. Esto ha llevado a distorsiones post hoc complejas de la forma del pozo de potencial para ajustarse a los datos experimentales, pero la pregunta sigue siendo si estas manipulaciones matemáticas realmente corresponden a las deformaciones espaciales en los núcleos reales. Los problemas con el modelo de capa han llevado a algunos a proponer efectos realistas de fuerza nuclear de dos y tres cuerpos que involucran grupos de nucleones y luego construir el núcleo sobre esta base. Tres de estos modelos de clúster son el modelo de estructura de grupo resonante de 1936 de John Wheeler, el modelo de esferón compacto de Linus Pauling y el modelo 2D Ising de MacGregor.
Coherencia entre modelos
Como en el caso del helio líquido superfluido, los núcleos atómicos son un ejemplo de un estado en el que se aplican (1) reglas físicas de partículas "ordinarias" para el volumen y (2) reglas mecánicas cuánticas no intuitivas para una naturaleza ondulatoria. En el helio superfluido, los átomos de helio tienen volumen y esencialmente se "tocan" entre sí, pero al mismo tiempo exhiben extrañas propiedades de volumen, consistentes con una condensación de Bose-Einstein. Los nucleones en los núcleos atómicos también exhiben una naturaleza ondulatoria y carecen de las propiedades estándar de los fluidos, como la fricción. Para núcleos hechos de hadrones que son fermiones, la condensación de Bose-Einstein no ocurre, sin embargo, muchas propiedades nucleares solo pueden explicarse de manera similar por una combinación de propiedades de partículas con volumen,
Contenido relacionado
Fenilalanina
Enlace (química)
Elemento del período 1
