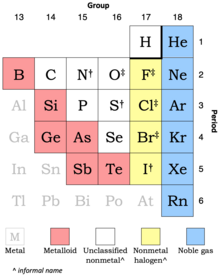
No metal

Extracto de la tabla periódica que muestra con qué frecuencia cada elemento se clasifica como un no metálico:
14 siempre 3 con frecuencia 6 a veces (metaloides)
Los metales cercanos se muestran en una fuente gris.
No hay una definición precisa de un no metálico; qué elementos se cuentan como tales varía.
El hidrógeno suele estar en el grupo 1 (por la tabla completa inferior), pero puede estar en el grupo 17 (por el extracto anterior).
| ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ |
| ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ |
En química, un no metal (o no metal) es un elemento químico que generalmente carece de predominio de propiedades metálicas; van desde gases incoloros (como el hidrógeno) hasta sólidos brillantes (como el carbono, como el grafito). Los electrones en los no metales se comportan de manera diferente a los de los metales. Con algunas excepciones, los de los no metales están fijos en su lugar, lo que hace que los no metales sean malos conductores del calor y la electricidad y quebradizos o quebradizos cuando están sólidos. Los electrones en los metales generalmente se mueven libremente y es por eso que los metales son buenos conductores y la mayoría se aplanan fácilmente en láminas y se estiran en cables. Los átomos no metálicos tienden a atraer electrones en las reacciones químicas y a formar compuestos ácidos.
Dos no metales, hidrógeno y helio, constituyen aproximadamente el 99 % de la materia ordinaria en el universo observable en masa. Cinco elementos no metálicos, hidrógeno, carbono, nitrógeno, oxígeno y silicio, constituyen en gran medida la corteza terrestre, la atmósfera, los océanos y la biosfera.
La mayoría de los no metales tienen funciones o usos biológicos, tecnológicos o domésticos. Los organismos vivos están compuestos casi en su totalidad por los no metales hidrógeno, oxígeno, carbono y nitrógeno. Casi todos los no metales tienen usos individuales en medicina y productos farmacéuticos; iluminación y láseres; y artículos para el hogar.
Si bien el término no metálico se remonta a 1566, no existe una definición precisa ampliamente aceptada de un no metal. Algunos elementos tienen una marcada mezcla de propiedades metálicas y no metálicas; cuáles de estos casos límite se cuentan como no metales pueden variar según los criterios de clasificación. Catorce elementos siempre se reconocen efectivamente como no metales y hasta nueve más se agregan con frecuencia o a veces, como se muestra en el extracto de la tabla periódica.
Definición y elementos aplicables
Un no metal es un elemento químico que se considera que carece de una preponderancia de propiedades metálicas, como brillo, deformabilidad, buena conductividad térmica y eléctrica y la capacidad de formar un óxido básico (en lugar de ácido). Dado que no existe una definición rigurosa de un no metal, existe cierta variación entre las fuentes en cuanto a qué elementos se clasifican como tales. Las decisiones involucradas dependen de qué propiedad o propiedades se consideran más indicativas de carácter metálico o no metálico.
Aunque Steudel, en 2020, reconoció veintitrés elementos como no metales, cualquier lista de este tipo está abierta a cuestionamientos. Catorce casi siempre reconocidos son hidrógeno, oxígeno, nitrógeno y azufre; los halógenos altamente reactivos flúor, cloro, bromo y yodo; y los gases nobles helio, neón, argón, criptón, xenón y radón (ver, por ejemplo, Larrañaga et al). Los autores reconocieron al carbono, fósforo y selenio como no metales; Vernon había informado anteriormente que estos tres elementos a veces se contaban como metaloides. Los elementos comúnmente reconocidos como metaloides son el boro; silicio y germanio; arsénico y antimonio; y el telurio a veces se cuentan como una clase intermedia entre los metales y los no metales cuando los criterios utilizados para distinguir entre metales y no metales no son concluyentes. En otras ocasiones, se cuentan como no metales a la luz de su química no metálica.
De los 118 elementos conocidos, no más del 20 % se consideran no metales. El estado de algunos elementos es menos seguro. Astatine, el quinto halógeno, a menudo se ignora debido a su rareza e intensa radiactividad; la teoría y la evidencia experimental sugieren que es un metal. Los elementos superpesados copernicium (Z = 112), flerovium (114) y oganesson (118) pueden resultar no metales; su estado no ha sido confirmado.
Propiedades generales
Física
(feminine)- Las propiedades físicas se aplican a los elementos en sus formas más estables en condiciones ambientales
de algunos elementos no metálicos
Alrededor de la mitad de los elementos no metálicos son gases; la mayor parte del resto son sólidos brillantes. El bromo, el único líquido, es tan volátil que suele estar cubierto por una capa de sus vapores; el azufre es el único no metal sólido coloreado. Los no metales fluidos tienen densidades, puntos de fusión y puntos de ebullición muy bajos, y son malos conductores del calor y la electricidad. Los elementos sólidos tienen densidades bajas, son quebradizos o desmenuzables con baja resistencia mecánica y estructural, y malos a buenos conductores.
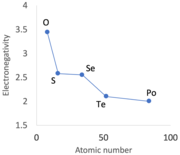
Las estructuras internas y los arreglos de enlace de los no metales explican sus diferencias de forma. Los que existen como átomos discretos (p. ej., xenón) o moléculas (p. ej., oxígeno, azufre y bromo) tienen puntos de fusión y ebullición bajos, ya que se mantienen unidos por las débiles fuerzas de dispersión de London que actúan entre sus átomos o moléculas. Muchos son gases a temperatura ambiente. Los no metales que forman estructuras gigantes, como cadenas de hasta 1000 átomos (p. ej., selenio), láminas (p. ej., carbono) o redes 3D (p. ej., silicio), tienen puntos de fusión y ebullición más altos, ya que se necesita más energía para superar sus enlaces covalentes más fuertes., por lo que son todos sólidos. Los que están más cerca del lado izquierdo de la tabla periódica, o más abajo en una columna, a menudo tienen algunas interacciones metálicas débiles entre sus moléculas, cadenas o capas, en consonancia con su proximidad a los metales; esto ocurre en boro, carbono, fósforo, arsénico, selenio, antimonio, telurio y yodo.
Los elementos no metálicos son brillantes, coloreados o incoloros. Para el boro, el carbono grafítico, el silicio, el fósforo negro, el germanio, el arsénico, el selenio, el antimonio, el telurio y el yodo, sus estructuras presentan diversos grados de electrones deslocalizados que dispersan la luz visible entrante, lo que da como resultado una apariencia brillante. Los no metales coloreados (azufre, flúor, cloro, bromo) absorben algunos colores (longitudes de onda) y transmiten los colores complementarios. Para el cloro, su "color amarillo verdoso familiar... se debe a una amplia región de absorción en las regiones violeta y azul del espectro". Para los no metales incoloros (hidrógeno, nitrógeno, oxígeno y los gases nobles), sus electrones se mantienen lo suficientemente fuertes como para que no se produzca absorción en la parte visible del espectro y se transmita toda la luz visible.
Las conductividades eléctricas y térmicas de los no metales y la naturaleza frágil de los sólidos también están relacionadas con sus disposiciones internas. Mientras que una buena conductividad y plasticidad (maleabilidad, ductilidad) normalmente se asocian con la presencia de electrones que se mueven libremente y se distribuyen uniformemente en los metales, los electrones en los no metales normalmente carecen de dicha movilidad. Entre los elementos no metálicos, la buena conductividad eléctrica y térmica ocurre solo en el carbono, el arsénico y el antimonio. De lo contrario, la buena conductividad térmica solo ocurre en boro, silicio, fósforo y germanio; dicha conductividad se transmite a través de vibraciones de las redes cristalinas de estos elementos. Conductividad eléctrica moderada ocurre en boro, silicio, fósforo, germanio, selenio, telurio y yodo. La plasticidad ocurre en circunstancias limitadas solo en carbono, fósforo, azufre y selenio.
Las diferencias físicas entre los metales y los no metales surgen de las fuerzas atómicas internas y externas. Internamente, la carga positiva que surge de los protones en el núcleo de un átomo actúa para mantener en su lugar a los electrones externos del átomo. Externamente, los mismos electrones están sujetos a las fuerzas de atracción de los protones en los átomos cercanos. Cuando las fuerzas externas son mayores o iguales que la fuerza interna, se espera que los electrones externos se liberen para moverse entre los átomos y se predicen las propiedades metálicas. De lo contrario, se esperan propiedades no metálicas.
Química
(feminine)| Aspecto | Metales | Nometales |
|---|---|---|
| Electronegatividad | Menos que no metales, con algunas excepciones | Moderado a muy alto |
| Química | ||
| Forma rara bonos covalentes | Forma con frecuencia bonos covalentes | |
| Bonos metálicos (aleaciones) entre metales | Covallent bonds entre los no metales | |
| Bonos iónicos entre no metales y metales | ||
| Oxidationstates | Positivo | Negativo o positivo |
| Oxides | Básico en óxidos inferiores; cada vez más ácido en óxidos superiores | Acidic; nunca básico |
| En la absolución acuosa | Existen como caciones | Existo como aniones o oxianiones |
Los no metales tienen valores de electronegatividad de moderados a altos y tienden a formar compuestos ácidos. Por ejemplo, los no metales sólidos (incluidos los metaloides) reaccionan con el ácido nítrico para formar un ácido o un óxido que tiene propiedades ácidas predominantes.
Tienden a ganar o compartir electrones cuando reaccionan, a diferencia de los metales que tienden a donar electrones. Dada la estabilidad de las configuraciones electrónicas de los gases nobles (que tienen capas externas completas), los no metales generalmente ganan suficientes electrones para darles la configuración electrónica del siguiente gas noble, mientras que los metales tienden a perder suficientes electrones para dejarlos con la configuración electrónica. del gas noble anterior. Para los elementos no metálicos, esta tendencia se resume en las reglas empíricas del dúo y el octeto (y para los metales existe una regla de 18 electrones menos rigurosamente predictiva).
La mayoría de los no metales tienen energías de ionización, afinidades electrónicas, valores de electronegatividad y potenciales de reducción estándar más altos que los metales. En general, cuanto más altos son estos valores, más no metálico es el elemento.
Las diferencias químicas entre los metales y los no metales surgen en gran medida de la fuerza de atracción entre la carga nuclear positiva de un átomo individual y sus electrones externos cargados negativamente. De izquierda a derecha en cada período de la tabla periódica, la carga nuclear aumenta a medida que aumenta el número de protones en el núcleo atómico. Hay una reducción asociada en el radio atómico a medida que la carga nuclear creciente atrae a los electrones externos más cerca del núcleo. En los metales, el efecto de la carga nuclear es generalmente más débil que en los elementos no metálicos. En la unión, los metales tienden a perder electrones y forman átomos o iones con carga positiva o polarizados, mientras que los no metales tienden a ganar esos mismos electrones debido a su carga nuclear más fuerte y forman iones con carga negativa o átomos polarizados.
La cantidad de compuestos formados por no metales es enorme. Los primeros diez lugares en un "top 20" tabla de elementos encontrados con mayor frecuencia en 895,501,834 compuestos, como se enumeran en el registro del Servicio de Resúmenes Químicos del 2 de noviembre de 2021, fueron ocupados por no metales. Hidrógeno, carbono, oxígeno y nitrógeno se encontraron colectivamente en la mayoría (80%) de los compuestos. El silicio, un metaloide, estaba en el puesto 11. El metal mejor calificado, con una frecuencia de ocurrencia de 0,14%, fue el hierro, en el puesto 12. Algunos ejemplos de compuestos no metálicos son: ácido bórico (H
3BO
3), utilizado en esmaltes cerámicos; selenocisteína (C
3H
7NO
2 Se), el aminoácido 21 de la vida; sesquisulfuro de fósforo (P4S3), en fósforos encendidos en cualquier lugar; y teflón ((C
2F
4) n), tal como se utiliza en revestimientos antiadherentes para sartenes y otros utensilios de cocina.
Complicaciones

Las anomalías que se ven en la primera fila de cada bloque de la tabla periódica complican la química de los no metales. Estas anomalías son prominentes en el hidrógeno, el boro (ya sea como no metal o como metaloide), el carbono, el nitrógeno, el oxígeno y el flúor. En filas posteriores, se manifiestan como periodicidad secundaria o tendencias periódicas no uniformes que descienden por la mayoría de los grupos del bloque p y estados de oxidación inusuales en los no metales más pesados.
Anomalía en la primera fila
Comenzando con el hidrógeno, la anomalía de la primera fila surge en gran medida de las configuraciones electrónicas de los elementos en cuestión. El hidrógeno se destaca por las diferentes formas en que forma enlaces. Lo más común es que forme enlaces covalentes. Puede perder su único electrón en solución acuosa, dejando atrás un protón desnudo con un tremendo poder de polarización. En consecuencia, este se une al par de electrones solitario de un átomo de oxígeno en una molécula de agua, formando así la base de la química ácido-base. Un átomo de hidrógeno en una molécula puede formar un segundo enlace, más débil, con un átomo o grupo de átomos en otra molécula. Tal unión, 'ayuda a dar a los copos de nieve su simetría hexagonal, une el ADN en una doble hélice; da forma a las formas tridimensionales de las proteínas; e incluso eleva el punto de ebullición del agua lo suficiente como para preparar una taza de té decente."
El hidrógeno, el helio y el boro y el neón tienen radios atómicos inusualmente pequeños. Esto ocurre porque las subcapas 1s y 2p no tienen análogos internos (es decir, no hay capa cero ni subcapa 1p) y, por lo tanto, no experimentan efectos de repulsión de electrones, a diferencia de las subcapas 3p, 4p y 5p de elementos más pesados. En consecuencia, las energías de ionización y las electronegatividades entre estos elementos son más altas de lo que cabría esperar, teniendo en cuenta las tendencias periódicas. Los pequeños radios atómicos de carbono, nitrógeno y oxígeno facilitan la formación de enlaces dobles o triples.
Aunque normalmente se esperaría que el hidrógeno y el helio, por razones de consistencia de la configuración electrónica, estuvieran ubicados encima de los elementos del bloque s, la anomalía de la primera fila en estos dos elementos es lo suficientemente fuerte como para justificar ubicaciones alternativas. El hidrógeno se coloca ocasionalmente sobre el flúor, en el grupo 17, en lugar del litio en el grupo 1. El helio se coloca regularmente sobre el neón, en el grupo 18, en lugar del berilio, en el grupo 2.
Periodicidad secundaria
Inmediatamente después de la primera fila de metales del bloque d, de escandio a zinc, los electrones 3d en los elementos del bloque p, es decir, galio (un metal), germanio, arsénico, selenio y bromo, no son tan efectivos como blindaje. el aumento de la carga nuclear positiva. Un efecto similar acompaña a la aparición de catorce metales del bloque f entre el bario y el lutecio, lo que finalmente da como resultado radios atómicos más pequeños de lo esperado para los elementos desde el hafnio (Hf) en adelante. El resultado neto, especialmente para los elementos del grupo 13–15, es que hay una alternancia en algunas tendencias periódicas que descienden de los grupos 13 a 17.
Estados de oxidación inusuales
Los radios atómicos más grandes de los no metales más pesados del grupo 15-18 permiten números de coordinación a granel más altos y dan como resultado valores de electronegatividad más bajos que toleran mejor las cargas positivas más altas. Por lo tanto, los elementos involucrados pueden exhibir estados de oxidación distintos al más bajo para su grupo (es decir, 3, 2, 1 o 0), por ejemplo, en el pentacloruro de fósforo (PCl5), el hexafluoruro de azufre (SF6), heptafluoruro de yodo (IF7) y difluoruro de xenón (XeF2).
Subclases
Los enfoques para clasificar los no metales pueden implicar desde dos subclases hasta seis o siete. Por ejemplo, la tabla periódica de la Encyclopædia Britannica reconoce los gases nobles, los halógenos y otros no metales, y divide los elementos comúnmente reconocidos como metaloides entre "otros metales" y "otros no metales". En cambio, la tabla periódica de la Royal Society of Chemistry usa un color diferente para cada uno de sus ocho grupos principales, y los no metales se pueden encontrar en siete de estos.
De derecha a izquierda en términos de la tabla periódica, se distinguen con más o menos frecuencia tres o cuatro tipos de no metales. Estos son:
- los gases nobles relativamente inertes;
- a set of chemically strong halogen elements—fluorine, chlorine, bromine and iodine—sometimes referred to as nonmetal halogens (the term used here) or stable halogens;
- a set of unclassified nonmetals, including elements such as hidrógeno, carbon, nitrogen, and oxígeno, with no widely recognized collective name; and
- los metaloides no metálicos químicamente débiles a veces se consideran no metálicos y a veces no.
Dado que los metaloides ocupan "territorio fronterizo", donde los metales se encuentran con los no metales, su tratamiento varía de un autor a otro. Algunos los consideran separados tanto de los metales como de los no metales; algunos los consideran como no metales o como una subclase de no metales. Otros autores cuentan algunos de ellos como metales, por ejemplo el arsénico y el antimonio, por su similitud con los metales pesados. Los metaloides se tratan aquí como no metales a la luz de su comportamiento químico y con fines comparativos.
Además de los metaloides, se puede discernir cierta confusión de límites y superposición (como ocurre generalmente con los esquemas de clasificación) entre las otras subclases de no metales. El carbono, el fósforo, el selenio y el yodo bordean los metaloides y muestran cierto carácter metálico, al igual que el hidrógeno. Entre los gases nobles, el radón es el más metálico y comienza a mostrar cierto comportamiento catiónico, lo cual es inusual para un no metal.
Gases nobles
Seis no metales se clasifican como gases nobles: helio, neón, argón, criptón, xenón y el radón radiactivo. En las tablas periódicas convencionales ocupan la columna más a la derecha. Se denominan gases nobles debido a su característica reactividad química muy baja.
Tienen propiedades muy similares, siendo todos ellos incoloros, inodoros y no inflamables. Con sus capas de electrones exteriores cerradas, los gases nobles tienen fuerzas de atracción interatómicas débiles que dan como resultado puntos de fusión y ebullición muy bajos. Es por eso que todos son gases en condiciones estándar, incluso aquellos con masas atómicas mayores que muchos elementos normalmente sólidos.
Químicamente, los gases nobles tienen energías de ionización relativamente altas, afinidades electrónicas nulas o negativas y electronegatividades relativamente altas. Los compuestos de los gases nobles se cuentan por cientos, aunque la lista continúa creciendo, y la mayoría de ellos involucran oxígeno o flúor combinados con criptón, xenón o radón.
En términos de la tabla periódica, se puede trazar una analogía entre los gases nobles y los metales nobles como el platino y el oro, siendo este último igualmente reacio a entrar en una combinación química. Como otro ejemplo, el xenón, en el estado de oxidación +8, forma un óxido explosivo amarillo pálido, XeO4, mientras que el osmio, otro metal noble, forma un óxido amarillo fuertemente oxidante, OsO4. También hay paralelismos en las fórmulas de los oxifluoruros: XeO2F4 y OsO2F4, y XeO3F2 y OsO3F2.
Alrededor de 1015 toneladas de gases nobles están presentes en la atmósfera terrestre. El helio también se encuentra en el gas natural hasta en un 7%. El radón se difunde fuera de las rocas, donde se forma durante la secuencia de descomposición natural del uranio y el torio. En 2014 se informó que el núcleo de la Tierra puede contener alrededor de 1013 toneladas de xenón, en forma de XeFe3 y XeNi3 compuestos intermetálicos. Esto puede explicar por qué "los estudios de la atmósfera de la Tierra han demostrado que se agota más del 90% de la cantidad esperada de Xe".
Halógenos no metálicos
Si bien los halógenos no metálicos son elementos notablemente reactivos y corrosivos, se pueden encontrar en compuestos tan comunes como la pasta de dientes (NaF); sal de mesa ordinaria (NaCl); desinfectante de piscinas (NaBr); o complementos alimenticios (KI). La palabra "halógeno" significa "formador de sal".
Físicamente, el flúor y el cloro son gases de color amarillo pálido y verde amarillento; el bromo es un líquido de color marrón rojizo (generalmente cubierto por una capa de sus vapores); y el yodo, bajo luz blanca, es un sólido de aspecto metálico. Eléctricamente, los tres primeros son aislantes mientras que el yodo es un semiconductor (a lo largo de sus planos).
Químicamente, tienen altas energías de ionización, afinidades electrónicas y valores de electronegatividad, y en su mayoría son agentes oxidantes relativamente fuertes. Las manifestaciones de este estado incluyen su naturaleza corrosiva. Los cuatro exhiben una tendencia a formar predominantemente compuestos iónicos con metales, mientras que los no metales restantes, el oxígeno de barra, tienden a formar predominantemente compuestos covalentes con metales. La naturaleza reactiva y fuertemente electronegativa de los halógenos no metálicos representa el epítome del carácter no metálico.
En términos de tabla periódica, las contrapartes de los halógenos altamente no metálicos en el grupo 17 son los metales alcalinos altamente reactivos, como el sodio y el potasio, en el grupo 1. La mayoría de los metales alcalinos, como si fueran una imitación de los halógenos no metálicos, se sabe que forman aniones –1 (algo que rara vez ocurre entre los metales).
Los halógenos no metálicos se encuentran en minerales relacionados con la sal. El flúor se encuentra en la fluorita (CaF2), un mineral ampliamente difundido. El cloro, el bromo y el yodo se encuentran en las salmueras. Excepcionalmente, un estudio de 2012 reportó la presencia de 0,04% de flúor nativo (F
2) por peso en antozonita, atribuyendo estas inclusiones como como resultado de la radiación de la presencia de pequeñas cantidades de uranio.
No metales no clasificados
Después de clasificar los elementos no metálicos como gases nobles, halógenos o metaloides (siguientes), los siete no metales restantes son hidrógeno, carbono, nitrógeno, oxígeno, fósforo, azufre y selenio. En sus formas más estables, tres son gases incoloros (H, N, O); tres tienen apariencia de metal (C, P, Se); y uno es amarillo (S). Eléctricamente, el carbono grafítico es un semimetal en sus planos y un semiconductor en una dirección perpendicular a sus planos; el fósforo y el selenio son semiconductores; y el hidrógeno, el nitrógeno, el oxígeno y el azufre son aislantes.
Por lo general, se consideran demasiado diversos para merecer un examen colectivo, y se los denomina otros no metales, o más claramente como no metales, ubicados entre los metaloides y los halógenos. En consecuencia, su química tiende a enseñarse de manera dispar, según sus cuatro grupos respectivos de la tabla periódica, por ejemplo: hidrógeno en el grupo 1; los no metales del grupo 14 (carbono y posiblemente silicio y germanio); los no metales del grupo 15 (nitrógeno, fósforo y posiblemente arsénico y antimonio); y los no metales del grupo 16 (oxígeno, azufre, selenio y posiblemente telurio). Son posibles otras subdivisiones según las preferencias individuales de los autores.
El hidrógeno, en particular, se comporta en algunos aspectos como un metal y en otros como un no metal. Como un metal, puede (primero) perder su único electrón; puede sustituir a los metales alcalinos en estructuras típicas de metales alcalinos; y es capaz de formar hidruros similares a aleaciones, con enlaces metálicos, con algunos metales de transición. Por otro lado, es un gas diatómico aislante, como un no metal típico, y en las reacciones químicas tiene una tendencia a alcanzar eventualmente la configuración electrónica del helio. Lo hace formando un enlace covalente o iónico o, si ha perdido su electrón, uniéndose a un par solitario de electrones.
Algunos o todos estos no metales, sin embargo, tienen varias propiedades compartidas. La mayoría de ellos, al ser menos reactivos que los halógenos, pueden ocurrir naturalmente en el medio ambiente. Tienen roles biológicos y geoquímicos prominentes. Si bien su carácter físico y químico es "moderadamente no metálico", en términos netos, todos ellos tienen aspectos corrosivos. El hidrógeno puede corroer los metales. La corrosión por carbono puede ocurrir en las celdas de combustible. La lluvia ácida es causada por nitrógeno o azufre disueltos. El oxígeno corroe el hierro a través del óxido. El fósforo blanco, la forma más inestable, se enciende en el aire y produce residuos de ácido fosfórico. El selenio no tratado en los suelos puede dar lugar a gas de seleniuro de hidrógeno corrosivo. Cuando se combinan con metales, los no metales no clasificados pueden formar compuestos de alta dureza (intersticiales o refractarios), debido a sus radios atómicos relativamente pequeños y valores de energía de ionización suficientemente bajos. Muestran una tendencia a unirse a sí mismos, especialmente en compuestos sólidos. Las relaciones de la tabla periódica diagonal entre estos no metales hacen eco de relaciones similares entre los metaloides.
En términos de la tabla periódica, se observa una analogía geográfica entre los no metales no clasificados y los metales de transición. Los no metales no clasificados ocupan territorio entre los halógenos fuertemente no metálicos a la derecha y los metaloides débilmente no metálicos a la izquierda. Los metales de transición ocupan territorio, "entre los metales virulentos y violentos a la izquierda de la tabla periódica, y los metales tranquilos y satisfechos a la derecha ... [y ] ... forman un puente de transición entre los dos".
Los no metales no clasificados normalmente se presentan en formas elementales (oxígeno, azufre) o se encuentran asociados con cualquiera de estos dos elementos:
- El hidrógeno se produce en los océanos del mundo como componente del agua, y en el gas natural como componente de metano y sulfuro de hidrógeno.
- El carbono se produce en piedra caliza, dolomita y mármol, como carbonatos. Menos conocido es el carbono como grafito, que ocurre principalmente en rocas silicadas metamorfóricas como resultado de la compresión y calefacción de compuestos sedimentarios de carbono.
- El oxígeno se encuentra en la atmósfera; en los océanos como componente del agua; y en la corteza como minerales de óxido.
- Los minerales de fósforo son generalizados, generalmente como fosfatos de fósforo-oxigeno.
- El azufre elemental se puede encontrar en o cerca de aguas termales y regiones volcánicas en muchas partes del mundo; los minerales azufre son generalizados, generalmente como sulfuros o sulfatos de oxígeno.
- El selenio ocurre en ores de sulfuro de metal, donde parcialmente reemplaza el azufre; selenio elemental se encuentra ocasionalmente.
Metaloides
Los seis elementos más comúnmente reconocidos como metaloides son el boro, el silicio, el germanio, el arsénico, el antimonio y el telurio, cada uno de los cuales tiene una apariencia metálica. En una tabla periódica estándar, ocupan un área diagonal en el bloque p que se extiende desde el boro en la parte superior izquierda hasta el telurio en la parte inferior derecha, a lo largo de la línea divisoria entre metales y no metales que se muestra en algunas tablas.
Son quebradizos y poco buenos conductores del calor y la electricidad. El boro, el silicio, el germanio y el telurio son semiconductores. El arsénico y el antimonio tienen estructuras electrónicas de semimetales, aunque ambos tienen formas semiconductoras menos estables.
Químicamente, los metaloides generalmente se comportan como no metales (débiles). Entre los elementos no metálicos, tienden a tener las energías de ionización, las afinidades electrónicas y los valores de electronegatividad más bajos, y son agentes oxidantes relativamente débiles. Además, demuestran una tendencia a formar aleaciones con metales.
En términos de la tabla periódica, a la izquierda de los metaloides débilmente no metálicos hay un conjunto indeterminado de metales débilmente metálicos (como el estaño, el plomo y el bismuto), a veces denominados metales posteriores a la transición. Dingle explica la situación de esta manera:
- ... con metales 'no-doubt' en la izquierda de la mesa, y no-doubt non-metals en la extrema derecha... la brecha entre los dos extremos es puenteada primero por los metales pobres (post-transición), y luego por los metaloides, que tal vez por el mismo token, podrían ser renombrados colectivamente los 'pobres no metálicos'.
Los metaloides tienden a encontrarse en formas combinadas con oxígeno o azufre o (en el caso del telurio) oro o plata. El boro se encuentra en minerales de borato de boro y oxígeno, incluso en aguas de manantiales volcánicos. El silicio se encuentra en el mineral de silicio-oxígeno sílice (arena). El germanio, el arsénico y el antimonio se encuentran principalmente como componentes de los minerales sulfurados. El telurio se encuentra en minerales de telururo de oro o plata. Se han informado formas nativas de arsénico, antimonio y telurio.
Alótropos
La mayoría de los elementos no metálicos existen en formas alotrópicas. El carbono, por ejemplo, se presenta como grafito, diamante y otras formas. Dichos alótropos pueden exhibir propiedades físicas que son más metálicas o menos no metálicas.
Entre los halógenos no metálicos y los no metales no clasificados:
- El yodo se conoce en forma semiconducta amorfa.
- El grafito, el estado estándar de carbono, es un conductor eléctrico bastante bueno. El alotropo de diamantes de carbono es claramente no metálico, siendo translúcido y un conductor eléctrico extremadamente pobre. El carbono se conoce en varias otras formas alotrópicas, incluyendo las variedades semiconducting buckminsterfullerene, y las variedades amorfos y paracristalinas (mixed amorphous y cristalline).
- El nitrógeno puede formar tetranitrógeno gaseoso (NN)4), una molécula poliatómica inestable con una vida de alrededor de un microsegundo.
- El oxígeno es una molécula diatómica en su estado estándar; también existe como ozono (O3), un alotropo no metálico inestable con una media vida de "indoors" de alrededor de media hora, en comparación con unos tres días en el aire ambiente a 20 °C.
- El fósforo, únicamente, existe en varias formas alotrópicas más estables que su estado estándar como fósforo blanco (P)4). Los alótropos blanco, rojo y negro son probablemente los más conocidos; el primero es un aislante; los dos últimos son semiconductores. El fósforo también existe como difosforo (P)2Un alotropo diatómico inestable.
- El azufre tiene más alotropos que cualquier otro elemento. El azufre amorfo, una mezcla metaestable de tales alotropos, se observa por su elasticidad.
- Selenium tiene varios alotropos no metálicos, todos los cuales son mucho menos eléctricos que su estado estándar de selenio gris "metállico".
Todos los elementos más comúnmente reconocidos como metaloides forman alótropos:
- Boron es conocido en varias formas cristalinas y amorfos.
- El silicio puede formar cristalino (como diamendra); amorfo; y ortodombic Si24 alotropos.
- A una presión de aproximadamente 10–11 GPa germanio se transforma en una fase metálica con la misma estructura tetragonal que la estaño. Cuando se descomprime —y dependiendo de la velocidad de liberación de presión— el germanio metálico forma una serie de alotropos que son metástasis en condiciones ambientales.
- Arsénico y antimonio forman varios alotropos conocidos (amarillo, gris y negro).
- El Tellurium es conocido en formas cristalinas y amorfos.
Se conocen otras formas alotrópicas de elementos no metálicos, ya sea bajo presión o en monocapas. Bajo presiones suficientemente altas, se ha observado que al menos la mitad de los elementos no metálicos que son semiconductores o aislantes, empezando por el fósforo a 1,7 GPa, forman alótropos metálicos. Las formas bidimensionales de una sola capa de no metales incluyen borofeno (boro), grafeno (carbono), siliceno (silicio), fosforeno (fósforo), germaneno (germanio), arseno (arsénico), antimoneno (antimonio) y telureno (teluro), colectivamente denominados xenes.
Prevalencia y acceso
Abundancia
| Dominio | Principales componentes | Siguiente más abundante |
|---|---|---|
| Crust | O 61%, Si 20% | H 2,9% |
| Atmósfera | N 78%, O 21% | Ar 0,5% |
| Hydrosphere | O 66,2%, H 33,2% | Cl 0,3% |
| Biomasa | O 63%, C 20%, H 10% | N 3.0% |
Se estima que el hidrógeno y el helio constituyen aproximadamente el 99 % de toda la materia ordinaria del universo y más del 99,9 % de sus átomos. Se cree que el oxígeno es el siguiente elemento más abundante, con un 0,1 % aproximadamente. Se cree que menos del cinco por ciento del universo está hecho de materia ordinaria, representada por estrellas, planetas y seres vivos. El equilibrio está hecho de energía oscura y materia oscura, las cuales actualmente son poco conocidas.
Cinco no metales, a saber, hidrógeno, carbono, nitrógeno, oxígeno y silicio, constituyen la mayor parte de la corteza terrestre, la atmósfera, la hidrosfera y la biomasa, en las cantidades que se muestran en la tabla.
Extracción
Los no metales y los metaloides se extraen en su forma bruta de:
- Brine- cloro, bromo, yodo;
- aire líquido—nitrógeno, oxígeno, neón, argón, krypton, xenón;
- minerales—borón (minerales de mineral de hierro); carbono (caal; diamante; grafito); fluorina (fluorita); silicio (sílice); fósforo (fosfatos); antimonio (estibnita, tetrahedrite); yodo (en yodato de sodio y iodida de sodio);
- gas natural—hidrógeno, helio, azufre; y
- ores, como subproductos de procesamiento-germanio (ores de cinc); arsénico (cobre y ores de plomo); selenio, dicurium (ores de cobre); y radón (ores de torsión de uranio).
Coste
Los costos diarios variarán según la pureza, la cantidad, las condiciones del mercado y los recargos del proveedor.
Basado en la literatura disponible a agosto de 2022, mientras que los costos citados de la mayoría de los no metales son menores que el costo de $0.80 por gramo de plata, el boro, el fósforo, el germanio, el xenón y el radón (en teoría) son excepciones:
- El hierro cuesta alrededor de $25 por gramo para el 99,7% trozos policristalinos puros con un tamaño de partículas de aproximadamente 1 cm. Anteriormente, en 1997, se citó al borón en $280 por gramo para varillas de 4 a 6 mm de diámetro de 99,999% de pureza, aproximadamente diez veces el entonces $28.35 por gramo de oro.
- En 2020 el fósforo en su forma negra más estable podría "cosar hasta $1,000 por gramo", más de 15 veces el costo del oro, mientras que el fósforo rojo ordinario, en 2017, se calculó alrededor de $3,40 por kilogramo. Los investigadores esperaban poder reducir el costo del fósforo negro a tan bajo como $1 por gramo.
- Germanium y xenon cuestan aproximadamente $1.20 y $7.60 por gramo.
- Hasta 2013, el radón estaba disponible en el Instituto Nacional de Normas y Tecnología por $1,636 por unidad de emisión de 0,2 ml, equivalente a unos 86.000.000 dólares por gramo, sin indicación de un descuento para cantidades masivas.
Usos compartidos
Casi todos los no metales tienen diversos usos en artículos para el hogar; iluminación y láseres; y medicina y productos farmacéuticos. El nitrógeno, por ejemplo, se encuentra en algunos tratamientos de jardín; láseres; y medicamentos para la diabetes. El germanio, el arsénico y el radón tienen usos en uno o dos de estos campos, pero no en los tres. Aparte de los gases nobles, la mayoría de los restantes no metales tienen, o han tenido, usos en agroquímicos y colorantes. En la medida en que los metaloides muestren carácter metálico, tienen usos especiales que se extienden a (por ejemplo) vidrios de óxido, componentes de aleación y semiconductores.
Otros usos compartidos de diferentes subconjuntos de los no metales ocurren en o como reemplazos del aire; criogenia y refrigerantes; fertilizantes; retardantes de llama o extintores de incendios; ácidos minerales; vehículos híbridos enchufables; gases de soldadura; y teléfonos inteligentes.
Historia, trasfondo y taxonomía
Descubrimiento
La mayoría de los no metales se descubrieron en los siglos XVIII y XIX. Antes de eso se conocían en la antigüedad el carbono, el azufre y el antimonio; el arsénico fue descubierto durante la Edad Media (por Albertus Magnus); y Hennig Brand aisló el fósforo de la orina en 1669. El helio (1868) tiene la distinción de ser el único elemento que no se descubrió por primera vez en la Tierra. El radón es el no metal descubierto más recientemente y se descubrió solo a fines del siglo XIX.
Las técnicas basadas en la química o la física utilizadas en los esfuerzos de aislamiento fueron espectroscopia, destilación fraccionada, detección de radiación, electrólisis, acidificación del mineral, reacciones de desplazamiento, combustión y calentamiento; algunos no metales ocurrieron naturalmente como elementos libres
De los gases nobles, el helio se detectó por su línea amarilla en el espectro coronal del sol, y posteriormente por la observación de las burbujas que escapaban de la uranita UO2 disuelta en ácido. Se obtuvieron de neón a xenón mediante destilación fraccionada de aire. El radón se observó por primera vez emanando de compuestos de torio, tres años después del descubrimiento de la radiación por Henri Becquerel en 1896.
Los halógenos no metálicos se obtuvieron a partir de sus haluros mediante electrólisis, adición de un ácido o desplazamiento. Algunos químicos murieron como resultado de sus experimentos tratando de aislar el flúor.
Entre los no metales no clasificados, el carbono se conocía (o producía) como carbón vegetal, hollín, grafito y diamante; se observó nitrógeno en el aire del que se había eliminado el oxígeno; el oxígeno se obtuvo calentando óxido mercurioso; el fósforo se liberó calentando hidrógeno fosfato de sodio y amonio (Na(NH4)HPO4), tal como se encuentra en la orina; el azufre se presentaba naturalmente como elemento libre; y se detectó selenio como residuo en ácido sulfúrico.
La mayoría de los elementos comúnmente reconocidos como metaloides se aislaron calentando sus óxidos (boro, silicio, arsénico, telurio) o un sulfuro (germanio). El antimonio se conocía en su forma nativa y también se podía obtener calentando su sulfuro.
Origen del concepto
La distinción entre metales y no metales surgió, de manera complicada, a partir de un reconocimiento crudo de diferentes tipos de materia, a saber, sustancias puras, mezclas, compuestos y elementos. Así, la materia podía dividirse en sustancias puras (como sal, bicarbonato de sodio o azufre) y mezclas (agua regia, pólvora o bronce, por ejemplo) y las sustancias puras eventualmente podían distinguirse en compuestos y elementos. "Metálico" Entonces, los elementos parecían tener atributos ampliamente distinguibles que otros elementos no tenían, como su capacidad para conducir el calor o para sus "tierras" (óxidos) para formar soluciones básicas en agua, por ejemplo como ocurrió con la cal viva (CaO).
Uso del término
El término no metálico data de 1566. En un tratado médico publicado ese año, Loys de L'Aunay (médico francés) mencionó las propiedades de las sustancias vegetales de metal y &# 34;no metálico" tierras
En los inicios de la química, Wilhelm Homberg (un filósofo natural alemán) se refirió a los elementos "no metálicos" azufre en Des Essais de Chimie (1708). Cuestionó la división quíntuple de toda la materia en azufre, mercurio, sal, agua y tierra, como postula Étienne de Clave (1641) en Nueva luz filosófica de los verdaderos principios y elementos de la naturaleza. El enfoque de Homberg representó "un paso importante hacia el concepto moderno de un elemento".
Lavoisier, en su discurso "revolucionario" En 1789, el trabajo Traité élémentaire de chimie publicó la primera lista moderna de elementos químicos en la que distinguía entre gases, metales, no metales y tierras (óxidos resistentes al calor). En sus primeros diecisiete años, el trabajo de Lavoisier se volvió a publicar en veintitrés ediciones en seis idiomas y "llevó... [su] nueva química por toda Europa y América".
Criterios distintivos sugeridos
Física
|
| Productos químicos
Electron related
|
En 1809, el descubrimiento del sodio y el potasio por parte de Humphry Davy 'aniquiló' la línea de demarcación entre metales y no metales. Antes de eso, los metales se habían distinguido sobre la base de su pesadez o densidades relativamente altas. El sodio y el potasio, por otro lado, flotaban en el agua y, sin embargo, eran claramente metales sobre la base de su comportamiento químico.
Desde 1811, se han utilizado diferentes propiedades (físicas, químicas y relacionadas con los electrones) en un intento de refinar la distinción entre metales y no metales. La tabla adjunta establece 22 de tales propiedades, por tipo y orden de fecha.
Probablemente, la propiedad más conocida es que la conductividad eléctrica de un metal aumenta cuando la temperatura desciende, mientras que la de un no metal aumenta. Sin embargo, este esquema no funciona para plutonio, carbono, arsénico y antimonio. El plutonio, que es un metal, aumenta su conductividad eléctrica cuando se calienta en un rango de temperatura de alrededor de –175 a +125 °C. El carbono, a pesar de ser ampliamente considerado como un no metal, también aumenta su conductividad cuando se calienta. El arsénico y el antimonio a veces se clasifican como no metales pero actúan de manera similar al carbono.
Kneen et al. sugirió que los no metales podrían distinguirse una vez que se hubiera elegido un criterio [único] para la metalicidad, y agregó que "son posibles muchas clasificaciones arbitrarias, la mayoría de las cuales, si se eligen razonablemente, serían similares pero no necesariamente idénticas". 34; Emsley señaló que, "Ninguna propiedad única ... se puede usar para clasificar todos los elementos como metales o no metales." Jones agregó que "las clases generalmente se definen por más de dos atributos".
| EN | ||
| Densidad | 1.9 | ≥ 1.9 |
| 7 gm/cm3 | Grupos 1 y 2 Sc, Y, La Ce, Pr, Eu, Yb Ti, Zr, V; Al, Ga | Gases nobles F, Cl, Br, I H, C, N, P, O, S, Se B, Si, Ge, Como, Sb, Te |
| ■ 7 gm/cm3 | Nd, Pm, Sm, Gd, Tb, Dy Ho, Er, Tm, Lu; Ac-Es; Hf, Nb, Ta; Cr, Mn, Fe, Co, Zn, Cd, En, Tl, Pb | Ni, Mo, W, Tc, Re, Metales de grupo platino, Metales de cobre, Hg; Sn, Bi, Po, At |
Johnson sugirió que las propiedades físicas pueden indicar mejor las propiedades metálicas o no metálicas de un elemento, con la condición de que se necesiten otras propiedades en casos ambiguos. Observó que todos los elementos gaseosos o no conductores son no metales; no metales sólidos los metales son duros y quebradizos o blandos y desmenuzables mientras que los metales suelen ser maleables y dúctiles; y los óxidos no metálicos son ácidos.
Según Hein y Arena, los no metales tienen densidades bajas y electronegatividad relativamente alta; la tabla adjunta lo confirma. Los elementos no metálicos ocupan el cuadrante superior izquierdo, donde las densidades son bajas y los valores de electronegatividad son relativamente altos. Los otros tres cuadrantes están ocupados por metales. Algunos autores dividen además los elementos en metales, metaloides y no metales, aunque Odberg argumenta que cualquier cosa que no sea un metal es, por motivos de categorización, un no metal.
Desarrollo de subclases
Alphonse Dupasquier, médico, farmacéutico y químico francés, estableció una taxonomía básica de los no metales en 1844. Para facilitar el estudio de los no metales, escribió:
- Se dividirán en cuatro grupos o secciones, como en los siguientes:
- Organogens O, N, H, C
- Sulphuroids S, Se, P
- Chloroides F, Cl, Br, I
- Boroides B, Si.
Un eco de la clasificación cuádruple de Dupasquier se ve en las subclases modernas. Los organógenos y sulfuroides representan el conjunto de no metales no clasificados. Las distintas configuraciones de estos siete no metales se han denominado, por ejemplo, no metales básicos; biógenos; no metales centrales; CHNOPS; elementos esenciales; "no metales"; no metales huérfanos; o no metales redox. Los no metales de cloroide llegaron a denominarse de forma independiente halógenos. Los no metales de boro se expandieron a los metaloides, a partir de 1864. Los gases nobles, como un grupo discreto, se contaron entre los no metales desde 1900.
Comparación
En la tabla se resumen algunas propiedades de los metales y de los metaloides, los no metales no clasificados, los halógenos no metálicos y los gases nobles. Las propiedades físicas se aplican a los elementos en sus formas más estables en condiciones ambientales y se enumeran en orden impreciso para facilitar su determinación. Las propiedades químicas se enumeran de lo general a lo descriptivo y luego a lo específico. La línea discontinua alrededor de los metaloides indica que, según el autor, los elementos involucrados pueden reconocerse o no como una clase o subclase distinta de elementos. Los metales se incluyen como punto de referencia.
La mayoría de las propiedades muestran una progresión de izquierda a derecha en caracteres metálicos a no metálicos o valores promedio. La tabla periódica puede así dividirse indicativamente en metales y no metales, con gradaciones más o menos distintas entre los no metales.
| Propiedad física | Metales alkali, tierra alcalina, lanthanida, actinida, transición, post-transición | Metaloides borón, silicio, germanio, arsénico, antimonio, dicurium | No metálicos no reclasificados hidrógeno, carbono, nitrógeno, fósforo, oxígeno, azufre, selenio | Halógenos no metálicos flúor, cloro, bromo, yodo | Gases nobles helio, neón, argón, krypton, xenón, radón |
|---|---|---|---|---|---|
| Forma y heft |
|
|
|
|
|
| Apariencia | lujurioso | lujurioso |
|
| incoloro |
| Elasticidad | mayormente maleable y dúctil (Hg es líquido) | Brittle | C, P negro, S, Se salpican; los cuatro tienen formas menos estables | Yodo es frágil | no aplicable |
| Conductividad eléctrica | Bien. |
|
|
| pobres |
| Estructura electrónica | metálico (Bi is a semimetal) | semimetal (As, Sb) o semiconductor |
| semiconductor (I) o aislador | insulator |
| Propiedad química | Metales alkali, tierra alcalina, lanthanida, actinida, transición, post-transición | Metaloides borón, silicio, germanio, arsénico, antimonio, dicurium | No metálicos no reclasificados hidrógeno, carbono, nitrógeno, fósforo, oxígeno, azufre, selenio | Halógenos no metálicos flúor, cloro, bromo, yodo | Gases nobles helio, neón, argón, krypton, xenón, radón |
| Comportamiento químico general |
| débilmente no metálico | moderadamente no metálica | fuertemente no metálico |
|
| Oxides |
|
|
|
|
|
| Compuestos con metales | aleaciones o compuestos intermetálicos | tienden a formar aleaciones o compuestos intermetálicos |
| principalmente iónico | compuestos simples en condiciones ambientales no conocidos |
| Energía de ionización (kJ mol−1) (página de datos) |
|
|
|
|
|
| Electronegatividad (Pauling)‡ (página de datos) |
|
|
|
|
|
| † Hydrogen también puede formar hidratos similares a la aleación . Las etiquetas baja, moderada, alta, y muy alto se basan arbitrariamente en los valores incluidos en el cuadro | |||||
Contenido relacionado
7-deshidrocolesterol
Psilocibina
Juan Herschel