Nitrato de cobre(II)
Nitrato de cobre(II) describe cualquier miembro de la familia de compuestos inorgánicos con la fórmula Cu(NO3)2(H2O)x. Los hidratos son sólidos azules. El nitrato de cobre anhidro forma cristales de color azul verdoso y se sublima en el vacío a 150-200 °C. Los hidratos comunes son el hemipentahidrato y el trihidrato.
Síntesis y reacciones
Nitrato de cobre(II) hidratado
El nitrato de cobre hidratado se prepara tratando cobre metálico o su óxido con ácido nítrico:
- Cu + 4 HNO3 → Cu(NO3)2 + 2 H2O + 2 NO2
Las mismas sales se pueden preparar tratando cobre metálico con una solución acuosa de nitrato de plata. Esa reacción ilustra la capacidad del cobre metálico para reducir los iones de plata.
En solución acuosa, los hidratos existen como el complejo acuático [Cu(H2O)6]2+. Estos complejos son muy lábiles debido a la configuración electrónica d9 del cobre (II).
El intento de deshidratación de cualquiera de los nitratos de cobre (II) hidratados mediante calentamiento produce óxidos, no Cu(NO3)2. A 80 °C los hidratos se convierten en "nitrato de cobre básico", Cu2(NO3)(OH)3, que se convierte en CuO a 180 °C. Aprovechando esta reactividad, el nitrato de cobre se puede utilizar para generar ácido nítrico calentándolo hasta su descomposición y pasando los vapores directamente al agua. Este método es similar al último paso del proceso de Ostwald. Las ecuaciones son las siguientes:
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- 3 NO2 + H2O → 2 HNO3 + NO
El tratamiento de soluciones de nitrato de cobre(II) con trifenilfosfina, trifenilarsina y trifenilstibina da los correspondientes complejos de cobre(I) [Cu(EPh3)3]NO3 (E = P, As, Sb; Ph = C6H5< /sub>). El ligando del grupo V se oxida al óxido.
Nitrato de cobre(II) anhidro
Anhidro Cu(NO3)2 es uno de los pocos nitratos de metales de transición anhidros. No puede prepararse mediante reacciones que contengan o produzcan agua. En su lugar, anhidro Cu(NO3)2 se forma cuando el cobre metálico se trata con tetróxido de dinitrógeno:
- Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
Estructura
Nitrato de cobre(II) anhidro
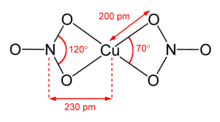
Se conocen dos polimorfos de nitrato de cobre (II) anhidro, α y β. Ambos polimorfos son redes de polímeros de coordinación tridimensionales con cadenas infinitas de centros de cobre (II) y grupos nitrato. La forma α tiene solo un entorno de Cu, con coordinación [4+1], pero la forma β tiene dos centros de cobre diferentes, uno con [4+1] y otro que es cuadrado plano.
El solvato de nitrometano también presenta "coordinación [4+1]", con cuatro enlaces cortos de Cu-O de aproximadamente 200 pm y un enlace más largo de 240 pm.
Calentar nitrato de cobre (II) anhidro sólido al vacío a 150-200 °C provoca la sublimación y el "agrietamiento" para dar un vapor de moléculas monoméricas de nitrato de cobre (II). En la fase de vapor, la molécula presenta dos ligandos de nitrato bidentados.
Nitrato de cobre(II) hidratado
Se han informado cinco hidratos: el monohidrato (Cu(NO3)2·2H2O), el sesquihidrato (Cu(NO3)2·1.5H2O), el hemipentahidrato (Cu(NO3)2·2.5H 2O), un trihidrato (Cu(NO3)2·3H2O), y un hexahidrato ([Cu(OH2)6](NO3)2. El hexahidrato es interesante porque las distancias Cu-O son todas iguales, sin revelar el efecto habitual de la distorsión de Jahn-Teller, es decir por lo demás característico de los complejos octaédricos de Cu (II). Este no efecto se atribuye a los fuertes enlaces de hidrógeno que limitan la elasticidad de los enlaces Cu-O.
Aplicaciones
El nitrato de cobre (II) encuentra una variedad de aplicaciones, la principal es su conversión en óxido de cobre (II), que se utiliza como catalizador para una variedad de procesos en química orgánica. Sus soluciones se utilizan en textiles y agentes de pulido para otros metales. Los nitratos de cobre se encuentran en algunos productos pirotécnicos. A menudo se utiliza en laboratorios escolares para demostrar reacciones químicas de células voltaicas. Es un componente de algunos esmaltes cerámicos y pátinas metálicas.
Síntesis orgánica
El nitrato de cobre, en combinación con anhídrido acético, es un reactivo eficaz para la nitración de compuestos aromáticos, conocida como nitración de Menke. El nitrato de cobre hidratado adsorbido sobre arcilla produce un reactivo llamado "Claycop". La arcilla de color azul resultante se utiliza como suspensión, por ejemplo para la oxidación de tioles a disulfuros. Claycop también se utiliza para convertir ditioacetales en carbonilos. Un reactivo relacionado basado en montmorillonita ha demostrado ser útil para la nitración de compuestos aromáticos.
Electroganación
El nitrato de cobre (II) también se puede utilizar para la electroobtención de cobre a pequeña escala con amoníaco (NH3) como subproducto.
Nitratos de cobre naturales
No se conoce ningún mineral de fórmula Cu(NO3) ideal, ni los hidratos.. Likasita, Cu3(NO3)(OH)5·2H2O y buttgenbachita, Cu19(NO3)2(OH)32Cl4·2H2O son minerales relacionados.
Los nitratos de cobre básicos naturales incluyen los minerales raros gerhardtita y rouaita, ambos polimorfos de Cu2(NO3)(OH)3< /sub>. Una sal natural mucho más compleja, básica, hidratada y que contiene cloruros es la buttgenbachita.
Contenido relacionado
Ley de Fick
Masa molar
Miscibilidad