Ninhidrina
Ninhidrina (2,2-dihidroxiindano-1,3-diona) es un compuesto orgánico con la fórmula C6H4(CO)2C(OH)2. Se utiliza para detectar amoníaco y aminas. Al reaccionar con estas aminas, la ninhidrina se convierte en derivados de color azul intenso o violeta, que se denominan púrpura de Ruhemann. La ninhidrina se usa más comúnmente para detectar huellas dactilares en casos forenses, ya que las aminas terminales de los residuos de lisina en péptidos y proteínas desprendidas en las huellas dactilares reaccionan con la ninhidrina.
La ninhidrina es un sólido blanco que es soluble en etanol y acetona. La ninhidrina puede considerarse como el hidrato de la indano-1,2,3-triona.
Historia
La ninhidrina fue descubierta en 1910 por el químico alemán-inglés Siegfried Ruhemann (1859-1943). Ese mismo año, Ruhemann observó la reacción de la ninhidrina con los aminoácidos. En 1954, los investigadores suecos Oden y von Hofsten propusieron que la ninhidrina podría usarse para desarrollar huellas dactilares latentes.
Usos
La ninhidrina se puede utilizar en la prueba de Kaiser para controlar la desprotección en la síntesis de péptidos en fase sólida. La cadena está unida a través de su extremo C al soporte sólido, con el extremo N saliendo de él. Cuando ese nitrógeno se desprotege, una prueba de ninhidrina arroja color azul. Los residuos de aminoácidos están unidos con su extremo N protegido, por lo que si el siguiente residuo se ha acoplado con éxito a la cadena, la prueba arroja un resultado incoloro o amarillo.
La ninhidrina también se utiliza en el análisis cualitativo de proteínas. La mayoría de los aminoácidos, excepto la prolina, se hidrolizan y reaccionan con la ninhidrina. Además, se degradan determinadas cadenas de aminoácidos. Por lo tanto, se requiere un análisis por separado para identificar los aminoácidos que reaccionan de manera diferente o no reaccionan en absoluto con la ninhidrina. A continuación se cuantifican colorimétricamente el resto de aminoácidos tras separación por cromatografía.
Una solución sospechosa de contener ion amonio se puede analizar con ninhidrina colocándola sobre un soporte sólido (como gel de sílice); El tratamiento con ninhidrina debería dar como resultado un color púrpura espectacular si la solución contiene esta especie. En el análisis de una reacción química mediante cromatografía en capa fina (TLC), también se puede utilizar el reactivo (normalmente una solución al 0,2% en n-butanol o en etanol). Detectará, en la placa TLC, prácticamente todas las aminas, carbamatos y también, después de un calentamiento vigoroso, amidas.
Al reaccionar con la ninhidrina, los aminoácidos se descarboxilan. El CO2 liberado se origina en el carbono carboxilo del aminoácido. Esta reacción se ha utilizado para liberar los carbonos carboxílicos del colágeno óseo de huesos antiguos para el análisis de isótopos estables con el fin de ayudar a reconstruir la paleodieta de los osos de las cavernas. La liberación del carbono carboxílico (a través de la ninhidrina) de los aminoácidos recuperados del suelo que ha sido tratado con un sustrato marcado demuestra la asimilación de ese sustrato en proteínas microbianas. Este enfoque se utilizó con éxito para revelar que algunas bacterias oxidantes de amonio, también llamadas bacterias nitrificantes, utilizan la urea como fuente de carbono en el suelo.

Forense
Los investigadores forenses suelen utilizar una solución de ninhidrina en el análisis de huellas dactilares latentes en superficies porosas como el papel. Los aminoácidos presentes en las diminutas secreciones sudorosas que se acumulan en las crestas únicas de los dedos se transfieren a las superficies que se tocan. La exposición de la superficie a la ninhidrina convierte los aminoácidos en productos visiblemente coloreados y así revela la impresión. Las soluciones de prueba adolecen de una pobre estabilidad a largo plazo, especialmente si no se mantienen frías.
Para mejorar aún más la capacidad de la ninhidrina, se puede utilizar una solución de 1,2-indandiona y cloruro de zinc (IND-Zn) antes de la ninhidrina. Esta secuencia conduce a una mayor reacción general de los aminoácidos, posiblemente porque el IND-Zn ayuda a liberarlos de la superficie para la posterior reacción de ninhidrina.
Reactividad
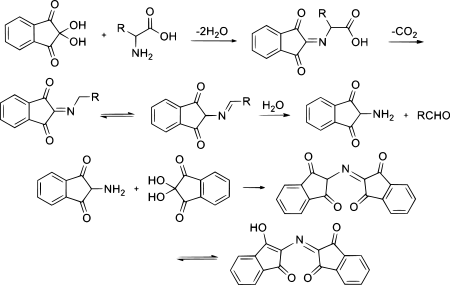
La ninhidrina existe en equilibrio con la tricetona indano-1,2,3-triona, que reacciona fácilmente con los nucleófilos (incluida el agua). Mientras que para la mayoría de los compuestos carbonilo, una forma carbonilo es más estable que un producto de la adición de agua (hidrato), la ninhidrina forma un hidrato estable del carbono central debido al efecto desestabilizador de los grupos carbonilo adyacentes.
Para generar el cromóforo de ninhidrina [2-(1,3-dioxoindan-2-il)iminoindano-1,3-diona], la amina debe condensarse para dar una base de Schiff. La reacción de la ninhidrina con aminas secundarias da una sal de iminio, que también tiene color, siendo generalmente de color amarillo anaranjado.
Efectos sobre la salud
La ninhidrina puede causar rinitis alérgica mediada por IgE y asma. Se ha descrito un caso en el que un trabajador de un laboratorio forense de 41 años que trabajaba con ninhidrina desarrolló rinitis y dificultad respiratoria. Se encontró que sus niveles de IgE específicos casi se duplicaron.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar