Modelo de Bohr
En física atómica, el modelo de Bohr o modelo de Rutherford-Bohr, presentado por Niels Bohr y Ernest Rutherford en 1913, es un sistema que consiste en un núcleo pequeño y denso rodeado de electrones en órbita, similar a la estructura del Sistema Solar, pero con la atracción provista por fuerzas electrostáticas en lugar de la gravedad. Llegó después del sistema solar, el modelo de Joseph Larmor (1897), el modelo cúbico (1902), el modelo de Saturno de Hantaro Nagaoka (1904), el modelo de budín de ciruelas (1904), el modelo cuántico de Arthur Haas (1910), el modelo de Rutherford (1911), y el modelo cuántico nuclear de John William Nicholson (1912). La mejora sobre el modelo de Rutherford de 1911 se refería principalmente a la nueva interpretación física cuántica introducida por Haas y Nicholson, pero abandonando cualquier intento de alinearse con la radiación de la física clásica.
El éxito clave del modelo radica en explicar la fórmula de Rydberg para las líneas de emisión espectral del hidrógeno atómico. Si bien la fórmula de Rydberg se conocía experimentalmente, no obtuvo una base teórica hasta que se introdujo el modelo de Bohr. El modelo de Bohr no solo explicó las razones de la estructura de la fórmula de Rydberg, sino que también proporcionó una justificación para las constantes físicas fundamentales que componen los resultados empíricos de la fórmula.
El modelo de Bohr es un modelo relativamente primitivo del átomo de hidrógeno, en comparación con el modelo del átomo de la capa de valencia. Como teoría, se puede derivar como una aproximación de primer orden del átomo de hidrógeno utilizando la mecánica cuántica más amplia y mucho más precisa y, por lo tanto, se puede considerar una teoría científica obsoleta. Sin embargo, debido a su simplicidad y sus resultados correctos para sistemas seleccionados (consulte la aplicación a continuación), el modelo de Bohr todavía se enseña comúnmente para presentar a los estudiantes la mecánica cuántica o los diagramas de niveles de energía antes de pasar a la más precisa, pero más compleja. átomo de la capa de valencia. Arthur Erich Haas propuso originalmente un modelo cuántico relacionado en 1910, pero fue rechazado hasta el Congreso Solvay de 1911, donde se discutió a fondo.La teoría cuántica del período entre el descubrimiento de Planck del cuanto (1900) y el advenimiento de una mecánica cuántica madura (1925) a menudo se conoce como la vieja teoría cuántica.
Origen
A principios del siglo XX, los experimentos de Ernest Rutherford establecieron que los átomos consistían en una nube difusa de electrones cargados negativamente que rodeaban un núcleo pequeño, denso y cargado positivamente. Dados estos datos experimentales, Rutherford consideró naturalmente un modelo planetario del átomo, el modelo de Rutherford de 1911. Este tenía electrones orbitando un núcleo solar, pero implicaba una dificultad técnica: las leyes de la mecánica clásica (es decir, la fórmula de Larmor) predicen que el electrón liberará radiación electromagnética mientras orbita un núcleo. Debido a que el electrón perdería energía, rápidamente se movería en espiral hacia adentro, colapsando en el núcleo en una escala de tiempo de alrededor de 16 picosegundos. El modelo atómico de Rutherford es desastroso porque predice que todos los átomos son inestables.Además, a medida que el electrón gira en espiral hacia adentro, la emisión aumentaría rápidamente en frecuencia debido a que el período orbital se acortaría, lo que daría como resultado una radiación electromagnética con un espectro continuo. Sin embargo, los experimentos de finales del siglo XIX con descargas eléctricas demostraron que los átomos solo emiten luz (es decir, radiación electromagnética) en ciertas frecuencias discretas. A principios del siglo XX, se esperaba que el átomo explicara las líneas espectrales. En 1897, Lord Rayleigh analizó el problema. Para 1906, dijo Rayleigh, “las frecuencias observadas en el espectro pueden no ser frecuencias de perturbación u oscilación en el sentido ordinario, sino que forman una parte esencial de la constitución original del átomo determinada por las condiciones de estabilidad”.
El esbozo del átomo de Bohr se produjo durante las actas de la primera Conferencia Solvay en 1911 sobre el tema de la radiación y los cuantos, en la que estuvo presente el mentor de Bohr, Rutherford. La conferencia de Max Planck terminó con este comentario: “… los átomos o electrones sujetos al enlace molecular obedecerían las leyes de la teoría cuántica”. Hendrik Lorentz en la discusión de la conferencia de Planck planteó la cuestión de la composición del átomo basada en el modelo de Thompson con una gran parte de la discusión en torno al modelo atómico desarrollado por Arthur Erich Haas. Lorentz explicó que la constante de Planck podría tomarse para determinar el tamaño de los átomos, o que el tamaño de los átomos podría tomarse para determinar la constante de Planck.Lorentz incluyó comentarios sobre la emisión y absorción de radiación concluyendo que “se establecerá un estado estacionario en el que el número de electrones que ingresan a sus esferas es igual al número de los que salen de ellas”. En la discusión sobre qué podría regular las diferencias de energía entre los átomos, Max Planck simplemente afirmó: “Los intermediarios podrían ser los electrones”.Las discusiones destacaron la necesidad de incluir la teoría cuántica en el átomo y las dificultades de una teoría atómica. Planck en su charla dijo explícitamente: “Para que un oscilador [molécula o átomo] pueda proporcionar radiación de acuerdo con la ecuación, es necesario introducir en las leyes de su funcionamiento, como ya hemos dicho al principio de este Informe, una hipótesis física particular que está, en un punto fundamental, en contradicción con la Mecánica clásica, explícita o tácitamente”.El primer artículo de Bohr sobre su modelo atómico cita a Planck casi palabra por palabra, diciendo: “Cualquiera que sea la alteración en las leyes del movimiento de los electrones, parece necesario introducir en las leyes en cuestión una cantidad ajena a la electrodinámica clásica, es decir La constante de Planck, o como a menudo se le llama, el cuanto elemental de acción. La nota al pie de página de Bohr en la parte inferior de la página es de la traducción francesa del Congreso Solvay de 1911, lo que demuestra que modeló su modelo directamente sobre los procedimientos y principios fundamentales establecidos por Planck, Lorentz y el modelo cuantizado del átomo de Arthur Haas que se mencionó diecisiete veces. Lorentz terminó la discusión de la charla de Einstein explicando: “La suposición de que esta energía debe ser un múltiplo de 


Luego, en 1912, Bohr se encontró con la teoría del modelo atómico de John William Nicholson que cuantificaba el momento angular como h /2 π. Según una celebración del centenario del átomo de Bohr en la revista Nature, fue Nicholson quien descubrió que los electrones irradian las líneas espectrales a medida que descienden hacia el núcleo y su teoría era tanto nuclear como cuántica. Niels Bohr lo citó en su artículo de 1913 sobre el modelo del átomo de Bohr. Muchos historiadores han enfatizado la importancia del trabajo del modelo atómico cuántico nuclear de Nicholson en el modelo de Bohr.
A continuación, su amigo, Hans Hansen, le dijo a Bohr que la serie de Balmer se calcula utilizando la fórmula de Balmer, una ecuación empírica descubierta por Johann Balmer en 1885 que describía las longitudes de onda de algunas líneas espectrales de hidrógeno. Esto fue generalizado aún más por Johannes Rydberg en 1888, lo que resultó en lo que ahora se conoce como la fórmula de Rydberg. Después de esto, declaró Bohr, “todo quedó claro”.
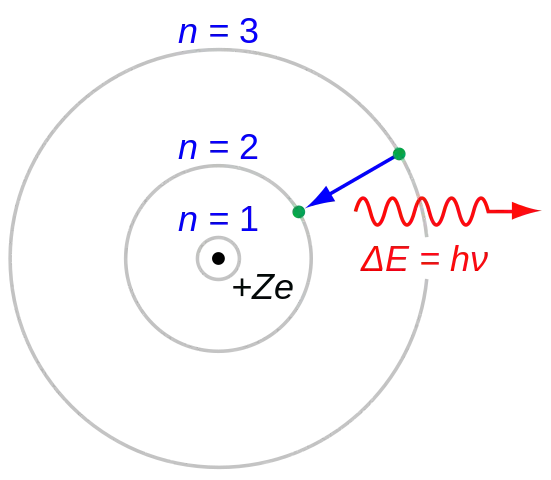
Para superar los problemas del átomo de Rutherford, en 1913 Niels Bohr planteó tres postulados que resumen la mayor parte de su modelo:
- El electrón es capaz de girar en ciertas órbitas estables alrededor del núcleo sin irradiar energía alguna, al contrario de lo que sugiere el electromagnetismo clásico. Estas órbitas estables se denominan órbitas estacionarias y se alcanzan a ciertas distancias discretas del núcleo. El electrón no puede tener ninguna otra órbita entre las discretas.
- Las órbitas estacionarias se alcanzan a distancias en las que el momento angular del electrón giratorio es un múltiplo entero de la constante de Planck reducida:
, donde n = 1, 2, 3,... se denomina número cuántico principal, y ħ = h /2 π. El valor más bajo de n es 1; esto da el radio orbital más pequeño posible de 0,0529 nm conocido como el radio de Bohr. Una vez que un electrón está en esta órbita más baja, no puede acercarse más al protón. A partir de la regla cuántica del momento angular, como admite Bohr, Nicholson la dio previamente en su artículo de 1912, Bohrpudo calcular las energías de las órbitas permitidas del átomo de hidrógeno y otros átomos e iones similares al hidrógeno. Estas órbitas están asociadas con energías definidas y también se denominan capas de energía o niveles de energía. En estas órbitas, la aceleración del electrón no produce radiación ni pérdida de energía. El modelo de Bohr de un átomo se basó en la teoría cuántica de la radiación de Planck.
- Los electrones sólo pueden ganar y perder energía saltando de una órbita permitida a otra, absorbiendo o emitiendo radiación electromagnética con una frecuencia ν determinada por la diferencia de energía de los niveles según la relación de Planck:
, donde h es la constante de Planck.
Otros puntos son:
- Al igual que la teoría del efecto fotoeléctrico de Einstein, la fórmula de Bohr asume que durante un salto cuántico se irradia una cantidad discreta de energía. Sin embargo, a diferencia de Einstein, Bohr se apegó a la teoría clásica de Maxwell del campo electromagnético. La cuantificación del campo electromagnético se explica por la discreción de los niveles de energía atómica; Bohr no creía en la existencia de fotones.
- Según la teoría de Maxwell, la frecuencia ν de la radiación clásica es igual a la frecuencia de rotación ν rot del electrón en su órbita, con armónicos en múltiplos enteros de esta frecuencia. Este resultado se obtiene del modelo de Bohr para saltos entre los niveles de energía E n y E n − k cuando k es mucho menor que n. Estos saltos reproducen la frecuencia del k -ésimo armónico de la órbita n. Para valores suficientemente grandes de n(los llamados estados de Rydberg), las dos órbitas involucradas en el proceso de emisión tienen casi la misma frecuencia de rotación, por lo que la frecuencia orbital clásica no es ambigua. Pero para n pequeña (o k grande), la frecuencia de radiación no tiene una interpretación clásica inequívoca. Esto marca el nacimiento del principio de correspondencia, que requiere que la teoría cuántica concuerde con la teoría clásica solo en el límite de los grandes números cuánticos.
- La teoría de Bohr-Kramers-Slater (teoría BKS) es un intento fallido de extender el modelo de Bohr, que viola la conservación de la energía y el momento en los saltos cuánticos, y las leyes de conservación solo se cumplen en promedio.
La condición de Bohr, de que el momento angular es un múltiplo entero de ħ, fue reinterpretada más tarde en 1924 por de Broglie como una condición de onda estacionaria: el electrón se describe mediante una onda y debe caber un número entero de longitudes de onda a lo largo de la circunferencia de la órbita del electrón:
Según la hipótesis de De Broglie, las partículas de materia como el electrón se comportan como ondas. La longitud de onda de De Broglie de un electrón es
lo que implica que
o
donde 

que es el segundo postulado de Bohr.
Bohr describió el momento angular de la órbita del electrón como 1/2h mientras que la longitud de onda de De Broglie de λ = h / p describió h dividido por el momento del electrón. En 1913, sin embargo, Bohr justificó su regla apelando al principio de correspondencia, sin proporcionar ningún tipo de interpretación ondulatoria. En 1913 no se sospechaba del comportamiento ondulatorio de partículas de materia como el electrón.
En 1925, se propuso un nuevo tipo de mecánica, la mecánica cuántica, en la que el modelo de Bohr de los electrones que viajan en órbitas cuantizadas se amplió a un modelo más preciso del movimiento de los electrones. La nueva teoría fue propuesta por Werner Heisenberg. Otra forma de la misma teoría, la mecánica ondulatoria, fue descubierta por el físico austriaco Erwin Schrödinger de forma independiente y mediante un razonamiento diferente. Schrödinger empleó las ondas de materia de De Broglie, pero buscó soluciones de onda de una ecuación de onda tridimensional que describía electrones que estaban obligados a moverse alrededor del núcleo de un átomo similar al hidrógeno, al quedar atrapados por el potencial de la carga nuclear positiva.
Niveles de energía de electrones
El modelo de Bohr da resultados casi exactos solo para un sistema en el que dos puntos cargados orbitan entre sí a velocidades mucho menores que la de la luz. Esto no solo involucra sistemas de un electrón como el átomo de hidrógeno, el helio ionizado individualmente y el litio doblemente ionizado, sino que también incluye los estados de positronio y Rydberg de cualquier átomo donde un electrón está lejos de todo lo demás. Se puede usar para cálculos de transición de rayos X de línea K si se agregan otras suposiciones (consulte la ley de Moseley a continuación). En física de alta energía, se puede utilizar para calcular las masas de mesones de quarks pesados.
El cálculo de las órbitas requiere dos suposiciones.
- Mecanica clasica
El electrón se mantiene en una órbita circular por atracción electrostática. La fuerza centrípeta es igual a la fuerza de Coulomb.


- Una regla cuántica
El momento angular L = m e vr es un múltiplo entero de ħ:
Derivación
Si un electrón en un átomo se mueve en una órbita con período T, clásicamente la radiación electromagnética se repetirá en cada período orbital. Si el acoplamiento al campo electromagnético es débil, de modo que la órbita no decae mucho en un ciclo, la radiación se emitirá en un patrón que se repite cada período, de modo que la transformada de Fourier tendrá frecuencias que son solo múltiplos de 1/ T. Esta es la ley de radiación clásica: las frecuencias emitidas son múltiplos enteros de 1/ T.
En la mecánica cuántica, esta emisión debe ser en cuantos de luz, de frecuencias que consisten en múltiplos enteros de 1/ T, por lo que la mecánica clásica es una descripción aproximada en números cuánticos grandes. Esto significa que el nivel de energía correspondiente a una órbita clásica de período 1/ T debe tener niveles de energía cercanos que difieren en energía por h / T, y deben estar igualmente espaciados cerca de ese nivel,
A Bohr le preocupaba si el espaciamiento de energía 1/ T debería calcularse mejor con el período del estado de energía 

Bohr consideró órbitas circulares. Clásicamente, estas órbitas deben decaer en círculos más pequeños cuando se emiten fotones. El espaciado de nivel entre órbitas circulares se puede calcular con la fórmula de correspondencia. Para un átomo de hidrógeno, las órbitas clásicas tienen un período T determinado por la tercera ley de Kepler a escala como r. La escala de energía es 1/ r, por lo que la fórmula de espaciado entre niveles equivale a
Es posible determinar los niveles de energía bajando recursivamente órbita por órbita, pero hay un atajo.
El momento angular L de la órbita circular escala como 
Suponiendo, con Bohr, que los valores cuantificados de L están igualmente espaciados, el espaciado entre las energías vecinas es
Esto es lo que se desea para momentos angulares igualmente espaciados. Si uno hiciera un seguimiento de las constantes, el espaciado sería ħ, por lo que el momento angular debería ser un múltiplo entero de ħ,
Así llegó Bohr a su modelo.Sustituyendo la expresión por la velocidad se obtiene una ecuación para r en términos de n:


Por lo tanto, un electrón en el nivel de energía más bajo del hidrógeno (n = 1) tiene aproximadamente 13,6 eV menos de energía que un electrón inmóvil infinitamente lejos del núcleo. El siguiente nivel de energía (n = 2) es −3,4 eV. El tercero (n = 3) es −1,51 eV, y así sucesivamente. Para valores mayores de n, estas son también las energías de enlace de un átomo altamente excitado con un electrón en una gran órbita circular alrededor del resto del átomo. La fórmula del hidrógeno también coincide con el producto de Wallis.
La combinación de constantes naturales en la fórmula energética se denomina energía de Rydberg (R E):
Esta expresión se aclara interpretándola en combinaciones que forman unidades más naturales:


Dado que esta derivación es con la suposición de que el núcleo está orbitado por un electrón, podemos generalizar este resultado dejando que el núcleo tenga una carga q = Ze, donde Z es el número atómico. Esto ahora nos dará los niveles de energía para los átomos hidrogenados (similares al hidrógeno), que pueden servir como una aproximación aproximada del orden de magnitud de los niveles de energía reales. Entonces, para núcleos con protones Z, los niveles de energía son (en una aproximación aproximada):
Los niveles de energía reales no se pueden resolver analíticamente para más de un electrón (ver el problema de n cuerpos) porque los electrones no solo se ven afectados por el núcleo sino que también interactúan entre sí a través de la Fuerza de Coulomb.
Cuando Z = 1/ α (Z ≈ 137), el movimiento se vuelve altamente relativista y Z cancela el α en R; la energía de la órbita comienza a ser comparable a la energía en reposo. Los núcleos lo suficientemente grandes, si fueran estables, reducirían su carga creando un electrón ligado desde el vacío, expulsando el positrón al infinito. Este es el fenómeno teórico del apantallamiento de carga electromagnética que predice una carga nuclear máxima. Se ha observado la emisión de tales positrones en las colisiones de iones pesados para crear núcleos superpesados temporales.
La fórmula de Bohr utiliza correctamente la masa reducida del electrón y el protón en todas las situaciones, en lugar de la masa del electrón,
Sin embargo, estos números son casi iguales, debido a la masa mucho mayor del protón, alrededor de 1836,1 veces la masa del electrón, de modo que la masa reducida en el sistema es la masa del electrón multiplicada por la constante 1836,1/(1+1836,1) = 0,99946. Este hecho fue históricamente importante para convencer a Rutherford de la importancia del modelo de Bohr, ya que explicaba el hecho de que las frecuencias de las líneas en los espectros del helio ionizado solo no difieren de las del hidrógeno en un factor de exactamente 4, sino en 4. veces la relación de la masa reducida para los sistemas de hidrógeno y helio, que estaba mucho más cerca de la relación experimental que exactamente 4.
Para el positronio, la fórmula también usa la masa reducida, pero en este caso, es exactamente la masa del electrón dividida por 2. Para cualquier valor del radio, el electrón y el positrón se mueven cada uno a la mitad de la velocidad alrededor de su centro común de masa, y cada uno tiene sólo un cuarto de la energía cinética. La energía cinética total es la mitad de lo que sería para un solo electrón que se mueve alrededor de un núcleo pesado.
Fórmula de Rydberg
La fórmula de Rydberg, que se conocía empíricamente antes que la fórmula de Bohr, se considera en la teoría de Bohr como una descripción de las energías de las transiciones o saltos cuánticos entre los niveles de energía orbital. La fórmula de Bohr da el valor numérico de la ya conocida y medida constante de Rydberg, pero en términos de constantes de la naturaleza más fundamentales, incluyendo la carga del electrón y la constante de Planck.
Cuando el electrón se mueve de su nivel de energía original a uno más alto, salta de nuevo cada nivel hasta que llega a la posición original, lo que resulta en la emisión de un fotón. Utilizando la fórmula derivada para los diferentes niveles de energía del hidrógeno, se pueden determinar las longitudes de onda de la luz que puede emitir un átomo de hidrógeno.
La energía de un fotón emitido por un átomo de hidrógeno viene dada por la diferencia de dos niveles de energía del hidrógeno:
donde n f es el nivel de energía final y ni es el nivel de energía inicial.
Como la energía de un fotón es
la longitud de onda del fotón emitido viene dada por
Esto se conoce como la fórmula de Rydberg, y la constante de Rydberg R es R E / hc, o R E /2 π en unidades naturales. Esta fórmula era conocida en el siglo XIX por los científicos que estudiaban la espectroscopia, pero no había una explicación teórica para esta forma o una predicción teórica para el valor de R, hasta Bohr. De hecho, la derivación de Bohr de la constante de Rydberg, así como el acuerdo concomitante de la fórmula de Bohr con las líneas espectrales observadas experimentalmente de Lyman (n f = 1), Balmer (n f = 2) y Paschen (n f=3) serie, y la predicción teórica exitosa de otras líneas aún no observadas, fue una de las razones por las que su modelo fue aceptado de inmediato.
Para aplicarla a átomos con más de un electrón, la fórmula de Rydberg se puede modificar reemplazando Z con Z − b o n con n − b donde b es constante y representa un efecto de pantalla debido a la capa interna y otros electrones (ver Capa de electrones y la discusión posterior del "Modelo de caparazón del átomo" a continuación). Esto se estableció empíricamente antes de que Bohr presentara su modelo.
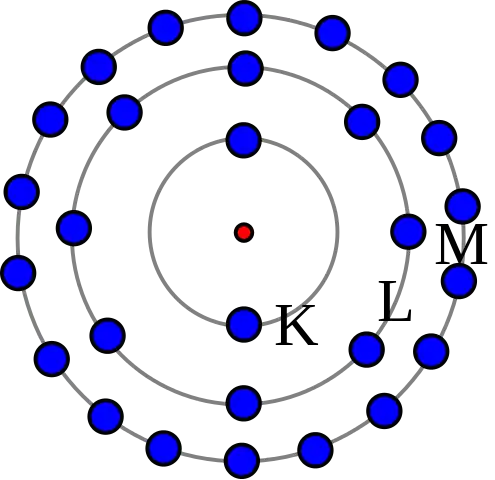
Modelo de caparazón (átomos más pesados)
Los tres artículos originales de Bohr en 1913 describían principalmente la configuración electrónica en elementos más ligeros. Bohr llamó a sus capas de electrones "anillos" en 1913. Los orbitales atómicos dentro de las capas no existían en el momento de su modelo planetario. Bohr explica en la Parte 3 de su famoso artículo de 1913 que el máximo de electrones en una capa es ocho, y escribe: “Vemos, además, que un anillo de n electrones no puede girar en un solo anillo alrededor de un núcleo de carga n e a menos que n< 8.” Para átomos más pequeños, las capas de electrones se llenarían de la siguiente manera: “los anillos de electrones solo se unirán si contienen el mismo número de electrones; y que, en consecuencia, el número de electrones en los anillos internos será solo de 2, 4, 8”. Sin embargo, en átomos más grandes, la capa más interna contendría ocho electrones, “por otro lado, el sistema periódico de los elementos sugiere fuertemente que ya en el neón N = 10 se producirá un anillo interno de ocho electrones”. Consulte la tabla periódica para obtener más información sobre cómo Bohr construyó su modelo de electrones en elementos de 1913.
“De lo anterior llegamos al siguiente esquema posible para la disposición de los electrones en los átomos ligeros:
| Elemento | electrones por capa |
|---|---|
| 4 | 2, 2 |
| 6 | 2, 4 |
| 7 | 4, 3 |
| 8 | 4, 2, 2 |
| 9 | 4, 4, 1 |
| 10 | 8, 2 |
| 11 | 8, 2, 1 |
| dieciséis | 8, 4, 2, 2 |
| 18 | 8, 8, 2 |
Tabla periódica de Bohr en 1913 que muestra configuraciones electrónicas en su segundo artículo donde fue al elemento 24. En el tercer artículo de 1913 de Bohr, Parte III, llamado sistemas que contienen varios núcleos, dice que dos átomos forman moléculas en un plano simétrico y vuelve a describir el hidrógeno. El modelo de Bohr de 1913 no analizaba en detalle los elementos superiores y John William Nicholson fue uno de los primeros en demostrar en 1914 que no podía funcionar para el litio, pero era una teoría atractiva para el hidrógeno y el helio ionizado.
En 1921, siguiendo el trabajo de los químicos y otros involucrados en el trabajo de la tabla periódica, Bohr amplió el modelo del hidrógeno para dar un modelo aproximado para los átomos más pesados. Esto dio una imagen física que reprodujo muchas propiedades atómicas conocidas por primera vez, aunque estas propiedades se propusieron simultáneamente con el trabajo idéntico del químico Charles Rugeley Bury.
El socio de investigación de Bohr durante 1914 a 1916 fue Walther Kossel, quien corrigió el trabajo de Bohr para mostrar que los electrones interactuaban a través de los anillos exteriores, y Kossel llamó a los anillos: "capas". A Irving Langmuir se le atribuye la primera disposición viable de electrones en capas con solo dos en la primera capa y subiendo a ocho en la siguiente según la regla del octeto de 1904, aunque Kossel ya había predicho un máximo de ocho por capa en 1916. Los átomos más pesados tienen más protones en el núcleo y más electrones para cancelar la carga. Bohr tomó de estos químicos la idea de que cada órbita discreta solo podía contener una cierta cantidad de electrones. Según Kossel, después de que la órbita esté llena, se tendría que usar el siguiente nivel.Esto le da al átomo una estructura de capa diseñada por Kossel, Langmuir y Bury, en la que cada capa corresponde a una órbita de Bohr.
Este modelo es aún más aproximado que el modelo del hidrógeno, porque trata a los electrones en cada capa como si no interactuaran. Pero las repulsiones de los electrones se tienen en cuenta de alguna manera por el fenómeno del apantallamiento. Los electrones en las órbitas exteriores no solo giran alrededor del núcleo, sino que también se mueven alrededor de los electrones interiores, por lo que la carga efectiva Z que sienten se reduce por el número de electrones en la órbita interior.
Por ejemplo, el átomo de litio tiene dos electrones en la órbita más baja de 1s, y estos orbitan en Z = 2. Cada uno ve la carga nuclear de Z = 3 menos el efecto de pantalla del otro, lo que reduce bruscamente la carga nuclear en 1 unidad.. Esto significa que los electrones más internos orbitan aproximadamente a la mitad del radio de Bohr. El electrón más externo en el litio orbita aproximadamente en el radio de Bohr, ya que los dos electrones internos reducen la carga nuclear en 2. Este electrón externo debe estar a casi un radio de Bohr del núcleo. Debido a que los electrones se repelen fuertemente entre sí, la descripción de la carga efectiva es muy aproximada; la carga efectiva Zpor lo general no resulta ser un número entero. Pero la ley de Moseley prueba experimentalmente el par de electrones más interno y muestra que ven una carga nuclear de aproximadamente Z − 1, mientras que el electrón más externo en un átomo o ion con solo un electrón en la capa más externa orbita un núcleo con carga efectiva Z − k donde k es el número total de electrones en las capas internas.
El modelo de caparazón pudo explicar cualitativamente muchas de las propiedades misteriosas de los átomos que se codificaron a fines del siglo XIX en la tabla periódica de los elementos. Una propiedad era el tamaño de los átomos, que podía determinarse aproximadamente midiendo la viscosidad de los gases y la densidad de los sólidos cristalinos puros. Los átomos tienden a hacerse más pequeños hacia la derecha en la tabla periódica y se vuelven mucho más grandes en la siguiente línea de la tabla. Los átomos a la derecha de la tabla tienden a ganar electrones, mientras que los átomos a la izquierda tienden a perderlos. Cada elemento de la última columna de la tabla es químicamente inerte (gas noble).
En el modelo de caparazón, este fenómeno se explica por el relleno de caparazón. Los átomos sucesivos se vuelven más pequeños porque están llenando órbitas del mismo tamaño, hasta que la órbita está llena, momento en el cual el siguiente átomo en la tabla tiene un electrón externo débilmente unido, lo que hace que se expanda. La primera órbita de Bohr se llena cuando tiene dos electrones, lo que explica por qué el helio es inerte. La segunda órbita permite ocho electrones, y cuando está llena el átomo es neón, nuevamente inerte. El tercer orbital contiene ocho nuevamente, excepto que en el tratamiento de Sommerfeld más correcto (reproducido en la mecánica cuántica moderna) hay electrones "d" adicionales. La tercera órbita puede contener 10 electrones d adicionales, pero estas posiciones no se llenan hasta que se llenan algunos orbitales más del siguiente nivel (llenar los orbitales n = 3 d produce los 10 elementos de transición).
Ley y cálculo de Moseley (líneas de emisión de rayos X K-alfa)
Niels Bohr dijo en 1962: "Verá, en realidad, el trabajo de Rutherford no se tomó en serio. No podemos entenderlo hoy, pero no se tomó en serio en absoluto. No se mencionó en ningún lugar. El gran cambio vino de Moseley".
En 1913, Henry Moseley encontró una relación empírica entre la línea de rayos X más fuerte emitida por los átomos bajo el bombardeo de electrones (entonces conocida como la línea K-alfa) y su número atómico Z. Se descubrió que la fórmula empírica de Moseley se derivaba de la fórmula de Rydberg y más tarde de la fórmula de Bohr (Moseley en realidad menciona solo a Ernest Rutherford y Antonius Van den Broek en términos de modelos, ya que estos se habían publicado antes del trabajo de Moseley y el artículo de Moseley de 1913 se publicó el mismo mes que el primer artículo modelo de Bohr). Las dos suposiciones adicionales de que [1] esta línea de rayos X proviene de una transición entre niveles de energía con números cuánticos 1 y 2, y [2], que el número atómico Zcuando se usa en la fórmula para átomos más pesados que el hidrógeno, debe disminuirse en 1, a (Z − 1).
Moseley le escribió a Bohr, desconcertado por sus resultados, pero Bohr no pudo ayudarlo. En ese momento, pensó que la capa de electrones "K" más interna postulada debería tener al menos cuatro electrones, no los dos que habrían explicado claramente el resultado. Entonces Moseley publicó sus resultados sin una explicación teórica.
Fue Walther Kossel en 1914 y en 1916 quien explicó que en la tabla periódica se crearían nuevos elementos a medida que se añadían electrones a la capa exterior. En el artículo de Kossel, escribe: “Esto lleva a la conclusión de que los electrones, que se agregan más, deben colocarse en anillos concéntricos o capas, en cada uno de los cuales... solo un cierto número de electrones, a saber, ocho en nuestro caso—debe arreglarse. Tan pronto como se completa un anillo o caparazón, se debe comenzar uno nuevo para el siguiente elemento; el número de electrones, que son más fácilmente accesibles y se encuentran en la periferia más externa, aumenta nuevamente de elemento a elemento y, por lo tanto, en la formación de cada nueva capa se repite la periodicidad química”.Más tarde, el químico Langmuir se dio cuenta de que el efecto era causado por la detección de carga, con una capa interna que contenía solo 2 electrones. En su artículo de 1919, Irving Langmuir postuló la existencia de "células" que solo podían contener dos electrones cada una, y que estaban dispuestas en "capas equidistantes".
En el experimento de Moseley, se elimina uno de los electrones más internos del átomo, lo que deja una vacante en la órbita de Bohr más baja, que contiene un solo electrón restante. Luego, esta vacante se llena con un electrón de la siguiente órbita, que tiene n = 2. Pero los n=2 electrones ven una carga efectiva de Z − 1, que es el valor apropiado para la carga del núcleo, cuando un solo electrón permanece en la órbita de Bohr más baja para apantallar la carga nuclear + Z y reducirla en − 1 (debido a que la carga negativa del electrón oculta la carga positiva nuclear). La energía ganada por un electrón que cae de la segunda capa a la primera da la ley de Moseley para las líneas K-alfa,
o
Aquí, R v = R E / h es la constante de Rydberg, en términos de frecuencia igual a 3,28 x 10 Hz. Para valores de Z entre 11 y 31, esta última relación había sido deducida empíricamente por Moseley, en un gráfico simple (lineal) de la raíz cuadrada de la frecuencia de rayos X contra el número atómico (sin embargo, para la plata, Z = 47, el obtenido experimentalmente el término de cribado debe sustituirse por 0,4). Sin perjuicio de su vigencia restringida,La ley de Moseley no solo estableció el significado objetivo del número atómico, sino que, como señaló Bohr, también hizo más que la derivación de Rydberg para establecer la validez del modelo nuclear del átomo de Rutherford/Van den Broek/Bohr, con el número atómico (colocar en la tabla periódica) representando unidades enteras de carga nuclear. Van den Broek había publicado su modelo en enero de 1913 mostrando que la tabla periódica estaba ordenada según la carga, mientras que el modelo atómico de Bohr no se publicó hasta julio de 1913.
Ahora se sabe que la línea K-alfa de la época de Moseley es un par de líneas cercanas, escritas como (Kα 1 y Kα 2) en notación Siegbahn.
Deficiencias
El modelo de Bohr da un valor incorrecto L = ħ para el momento angular orbital del estado fundamental: se sabe que el momento angular en el estado fundamental verdadero es cero a partir del experimento.Aunque las imágenes mentales fallan un poco en estos niveles de escala, se puede pensar que un electrón en el "orbital" moderno más bajo sin momento orbital no gira "alrededor" del núcleo en absoluto, sino que simplemente lo rodea con fuerza. elipse con área cero (esto puede representarse como "de ida y vuelta", sin golpear o interactuar con el núcleo). Esto solo se reproduce en un tratamiento semiclásico más sofisticado como el de Sommerfeld. Aún así, incluso el modelo semiclásico más sofisticado no logra explicar el hecho de que el estado de energía más bajo es esféricamente simétrico: no apunta en ninguna dirección en particular.
Sin embargo, en el moderno tratamiento totalmente cuántico en el espacio de fases, la deformación adecuada (cuidadosa extensión completa) del resultado semiclásico ajusta el valor del momento angular al efectivo correcto. Como consecuencia, la expresión del estado fundamental físico se obtiene mediante un desplazamiento de la expresión del momento angular cuántico que se desvanece, que corresponde a la simetría esférica.
En la mecánica cuántica moderna, el electrón en el hidrógeno es una nube esférica de probabilidad que se vuelve más densa cerca del núcleo. La constante de velocidad de decaimiento de probabilidad en el hidrógeno es igual a la inversa del radio de Bohr, pero dado que Bohr trabajó con órbitas circulares, no con elipses de área cero, el hecho de que estos dos números coincidan exactamente se considera una "coincidencia". (Sin embargo, se encuentran muchos acuerdos coincidentes de este tipo entre el tratamiento del átomo semiclásico frente al tratamiento mecánico cuántico completo; estos incluyen niveles de energía idénticos en el átomo de hidrógeno y la derivación de una constante de estructura fina, que surge del modelo relativista de Bohr-Sommerfeld. (ver más abajo) y que resulta ser igual a un concepto completamente diferente, en plena mecánica cuántica moderna).
El modelo de Bohr también tiene dificultades, o bien no logra explicar:
- Gran parte de los espectros de los átomos más grandes. En el mejor de los casos, puede hacer predicciones sobre los espectros de emisión de rayos X K-alfa y algunos L-alfa para átomos más grandes, si se hacen dos suposiciones ad hoc adicionales. Los espectros de emisión para átomos con un solo electrón en la capa externa (átomos en el grupo de litio) también se pueden predecir de forma aproximada. Además, si se conocen los factores empíricos de selección electrón-nuclear para muchos átomos, se pueden deducir muchas otras líneas espectrales a partir de la información, en átomos similares de diferentes elementos, a través de los principios de combinación de Ritz-Rydberg (consulte la fórmula de Rydberg). Todas estas técnicas esencialmente hacen uso de la imagen del átomo de energía-potencial newtoniana de Bohr.
- las intensidades relativas de las líneas espectrales; aunque en algunos casos simples, la fórmula de Bohr o modificaciones de la misma, pudo proporcionar estimaciones razonables (por ejemplo, cálculos de Kramers para el efecto Stark).
- La existencia de una estructura fina y una estructura hiperfina en las líneas espectrales, que se sabe que se deben a una variedad de efectos relativistas y sutiles, así como a complicaciones del espín de los electrones.
- El efecto Zeeman: cambios en las líneas espectrales debido a campos magnéticos externos; estos también se deben a principios cuánticos más complicados que interactúan con el espín de los electrones y los campos magnéticos orbitales.
- El modelo también viola el principio de incertidumbre en el sentido de que considera que los electrones tienen órbitas y ubicaciones conocidas, dos cosas que no se pueden medir simultáneamente.
- Los dobletes y tripletes aparecen en los espectros de algunos átomos como pares de líneas muy próximos. El modelo de Bohr no puede decir por qué algunos niveles de energía deberían estar muy juntos.
- Los átomos multielectrónicos no tienen niveles de energía predichos por el modelo. No funciona para helio (neutro).
Refinamientos
Se propusieron varias mejoras al modelo de Bohr, en particular los modelos de Sommerfeld o Bohr-Sommerfeld, que sugerían que los electrones viajaban en órbitas elípticas alrededor de un núcleo en lugar de las órbitas circulares del modelo de Bohr. Este modelo complementó la condición de momento angular cuantificado del modelo de Bohr con una condición de cuantificación radial adicional, la condición de cuantificación de Wilson-Sommerfeld
donde p r es el momento radial conjugado canónicamente con la coordenada q, que es la posición radial, y T es un período orbital completo. La integral es la acción de las coordenadas del ángulo de acción. Esta condición, sugerida por el principio de correspondencia, es la única posible, ya que los números cuánticos son invariantes adiabáticos.
El modelo de Bohr-Sommerfeld era fundamentalmente inconsistente y condujo a muchas paradojas. El número cuántico magnético mide la inclinación del plano orbital en relación con el xy plano, y sólo podía tomar unos pocos valores discretos. Esto contradecía el hecho obvio de que un átomo podía girarse de un lado a otro en relación con las coordenadas sin restricción. La cuantización de Sommerfeld se puede realizar en diferentes coordenadas canónicas y, en ocasiones, da respuestas diferentes. La incorporación de correcciones de radiación fue difícil porque requería encontrar coordenadas de ángulo de acción para un sistema combinado de radiación/átomo, lo cual es difícil cuando se permite que escape la radiación. Toda la teoría no se extendía a los movimientos no integrables, lo que significaba que muchos sistemas no podían tratarse ni siquiera en principio. Al final, el modelo fue reemplazado por el moderno tratamiento de la mecánica cuántica del átomo de hidrógeno, que fue dado por primera vez por Wolfgang Pauli en 1925, utilizando la mecánica matricial de Heisenberg.
Sin embargo, esto no quiere decir que el modelo de Bohr-Sommerfeld no tuviera éxito. Los cálculos basados en el modelo de Bohr-Sommerfeld pudieron explicar con precisión una serie de efectos espectrales atómicos más complejos. Por ejemplo, hasta las perturbaciones de primer orden, el modelo de Bohr y la mecánica cuántica hacen las mismas predicciones para la división de la línea espectral en el efecto Stark. Sin embargo, en perturbaciones de orden superior, el modelo de Bohr y la mecánica cuántica difieren, y las mediciones del efecto Stark bajo intensidades de campo altas ayudaron a confirmar la corrección de la mecánica cuántica sobre el modelo de Bohr. La teoría predominante detrás de esta diferencia radica en las formas de los orbitales de los electrones, que varían según el estado de energía del electrón.
Las condiciones de cuantización de Bohr-Sommerfeld generan preguntas en las matemáticas modernas. La condición de cuantificación semiclásica consistente requiere un cierto tipo de estructura en el espacio de fase, lo que impone limitaciones topológicas a los tipos de variedades simplécticas que se pueden cuantificar. En particular, la forma simpléctica debería ser la forma de curvatura de una conexión de un haz de líneas hermíticas, lo que se denomina precuantización.
Bohr también actualizó su modelo en 1922, asumiendo que cierto número de electrones (por ejemplo, 2, 8 y 18) corresponden a "capas cerradas" estables.
Modelo del enlace químico
Niels Bohr propuso un modelo del átomo y un modelo del enlace químico. Según su modelo para una molécula diatómica, los electrones de los átomos de la molécula forman un anillo giratorio cuyo plano es perpendicular al eje de la molécula y equidistante de los núcleos atómicos. El equilibrio dinámico del sistema molecular se logra mediante el equilibrio de fuerzas entre las fuerzas de atracción de los núcleos al plano del anillo de electrones y las fuerzas de repulsión mutua de los núcleos. El modelo de Bohr del enlace químico tuvo en cuenta la repulsión de Coulomb: los electrones en el anillo están a la máxima distancia entre sí.
Contenido relacionado
Ingeniería molecular
Compuesto no estequiométrico
Glucógeno




















