Fuerzas fundamentales
En física, las interacciones fundamentales, también conocidas como fuerzas fundamentales, son las interacciones que no parecen ser reducibles a... (leer más)
En química, el término metal de transición (o elemento de transición) tiene tres posibles definiciones:
El químico inglés Charles Rugeley Bury (1890–1968) utilizó por primera vez la palabra transición en este contexto en 1921, cuando se refirió a una serie de transición de elementos durante el cambio de una capa interna de electrones (por ejemplo, n = 3 en la cuarta fila de electrones). la tabla periódica) de un grupo estable de 8 a uno de 18, o de 18 a 32. Estos elementos ahora se conocen como el bloque d.
En el bloque d, los átomos de los elementos tienen entre cero y diez electrones d.
Los elementos de los grupos 4 a 11 se reconocen generalmente como metales de transición, justificados por su química típica, es decir, una amplia gama de iones complejos en varios estados de oxidación, complejos coloreados y propiedades catalíticas como elemento o como iones (o ambos). Sc e Y en el grupo 3 también se reconocen generalmente como metales de transición. Sin embargo, los elementos La–Lu y Ac–Lr y el grupo 12 atraen diferentes definiciones de diferentes autores.
Como la tercera forma es la única forma que permite simultáneamente (1) la preservación de la secuencia de números atómicos crecientes, (2) un bloque f de 14 elementos de ancho y (3) evitar la división en el bloque d, ha sido sugerido por un informe preliminar de la IUPAC de 2021 como la forma preferida. Los físicos soviéticos Lev Landau y Evgeny Lifshitz sugirieron por primera vez esta modificación, que trata a Lu como un elemento de transición en lugar de como un elemento de transición interna, en 1948. Después de esto, muchos otros físicos y químicos la sugirieron y, en general, fue la clasificación adoptada por quienes consideraron el tema, pero los libros de texto generalmente se retrasaron en adoptarla.
El zinc, el cadmio y el mercurio a veces se excluyen de los metales de transición, ya que tienen la configuración electrónica [ ] d s, sin capa d incompleta. En el estado de oxidación +2, los iones tienen la configuración electrónica [ ]…d. Aunque estos elementos pueden existir en otros estados de oxidación, incluido el estado de oxidación +1, como en el ion diatómico Hg2, todavía tienen una capa d completa en estos estados de oxidación. Los elementos del grupo 12 Zn, Cd y Hg pueden, por lo tanto, bajo ciertos criterios, ser clasificados como metales de post-transición en este caso. Sin embargo, a menudo es conveniente incluir estos elementos en una discusión sobre los elementos de transición. Por ejemplo, cuando se analiza la energía de estabilización del campo cristalino de los elementos de transición de la primera fila, es conveniente incluir también los elementos calcio y zinc, ya que ambos Cay zinctienen un valor de cero, contra el cual se puede comparar el valor de otros iones de metales de transición. Otro ejemplo ocurre en la serie Irving-Williams de constantes de estabilidad de complejos.
La síntesis reciente (aunque discutida y hasta ahora no reproducida de forma independiente) de fluoruro de mercurio (IV) (HgF4) ha sido tomado por algunos para reforzar la opinión de que los elementos del grupo 12 deben considerarse metales de transición, pero algunos autores aún consideran que este compuesto es excepcional. Se espera que Copernicium pueda usar sus electrones d para la química, ya que su subcapa 6d está desestabilizada por fuertes efectos relativistas debido a su número atómico muy alto y, como tal, se espera que tenga un comportamiento similar al de un metal de transición cuando muestre estados de oxidación más altos que +2 (que no se conocen definitivamente para los elementos más ligeros del grupo 12).
Aunque el meitnerio, el darmstadtio y el roentgenio se encuentran dentro del bloque d y se espera que se comporten como metales de transición de forma análoga a sus congéneres más ligeros como el iridio, el platino y el oro, esto aún no se ha confirmado experimentalmente. No está claro si el copernicio se comporta más como el mercurio o tiene propiedades más similares a las del gas noble radón.
Los metales de transición tempranos están en el lado izquierdo de la tabla periódica del grupo 3 al grupo 7. Los metales de transición tardíos están en el lado derecho del bloque d, del grupo 8 al 11 (y 12 si se cuentan como metales de transición).
La configuración electrónica general de los elementos del bloque d es (gas noble) (n − 1) d ns. Aquí "(gas noble)" es la configuración del último gas noble que precede al átomo en cuestión, y n es el número cuántico principal más alto de un orbital ocupado en ese átomo. Por ejemplo, Ti(Z = 22) está en el período 4, de modo que n = 4, los primeros 18 electrones tienen la misma configuración que Ar al final del período 3 y la configuración general es (Ar)3d 4s. Los metales de transición de los períodos 6 y 7 también agregan electrones centrales (n − 2) f, que se omiten en las tablas a continuación. La única excepción es el laurencio, que tiene una ocupación de 7p debido a los efectos relativistas que se vuelven importantes a niveles tan altos.Z (aunque los orbitales p también pueden contribuir al enlace químico en elementos de transición más ligeros).
La regla de Madelung predice que el orbital d interno se llena después del orbital s de la capa de valencia. La estructura electrónica típica de los átomos de metales de transición se escribe entonces como (gas noble) ns (n − 1) d. Sin embargo, esta regla es solo aproximada: solo se cumple para algunos de los elementos de transición, y solo en los estados básicos neutrales.
La subcapa d es la penúltima subcapa y se denomina 
Los elementos del grupo 3 tienen una configuración ns (n − 1) d, excepto el laurencio (Lr): su configuración 7s 7p excepcionalmente no llena los orbitales 6d en absoluto. La primera serie de transición está presente en el 4to período, y comienza después de Ca (Z = 20) del grupo-2 con la configuración [Ar]4 s, o escandio (Sc), el primer elemento del grupo 3 con número atómico Z = 21 y configuración [Ar]4 s 3 d, según la definición utilizada. A medida que nos movemos de izquierda a derecha, se agregan electrones al mismo dsubcapa hasta que esté completa. El elemento del grupo 11 de la primera serie de transición es el cobre (Cu) con una configuración atípica [Ar]4 s 3 d. A pesar de la subcapa d llena en cobre metálico, forma un ion estable con una subcapa d incompleta. Dado que los electrones agregados llenan los 
| Grupo | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|
| Número atómico | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Elemento | Carolina del Sur | ti | V | cr | Minnesota | Fe | Co | Ni | cobre | zinc |
| Configuración electrónica | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos | 3 días 4 segundos |
| Número atómico | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 |
|---|---|---|---|---|---|---|---|---|---|---|
| Elemento | Y | Zr | Nótese bien | Mes | tc | ru | Rh | PD | Agricultura | Discos compactos |
| Configuración electrónica | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos | 4 días 5 segundos |
| Número atómico | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
|---|---|---|---|---|---|---|---|---|---|---|
| Elemento | Lu | H.f. | Ejército de reserva | W | Re | Os | ir | punto | Au | Hg |
| Configuración electrónica | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos | 5 días 6 segundos |
| Número atómico | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 |
|---|---|---|---|---|---|---|---|---|---|---|
| Elemento | Lr | radiofrecuencia | DB | sg | bh | hs | Monte | Ds | Rg | cn |
| Configuración electrónica | 7 s 7 p | 6 días 7 años | 6 días 7 años | 6 días 7 años | 6 días 7 años | 6 días 7 años | 6 días 7 años | 6 días 7 años | 6 días 7 años | 6 días 7 años |
Una mirada cuidadosa a la configuración electrónica de los elementos revela que existen ciertas excepciones a la regla de Madelung. Para Cr como ejemplo, la regla predice la configuración 3 d 4 s, pero los espectros atómicos observados muestran que el estado fundamental real es 3 d 4 s. Para explicar tales excepciones, es necesario considerar los efectos del aumento de la carga nuclear en las energías orbitales, así como las interacciones electrón-electrón, incluidas la repulsión de Coulomb y el intercambio de energía.
Los 


Hay una serie de propiedades compartidas por los elementos de transición que no se encuentran en otros elementos, lo que resulta del caparazón d parcialmente lleno. Éstos incluyen
La mayoría de los metales de transición se pueden unir a una variedad de ligandos, lo que permite una amplia variedad de complejos de metales de transición.
El color en los compuestos metálicos de la serie de transición generalmente se debe a transiciones electrónicas de dos tipos principales.
Una transición de transferencia de carga de metal a ligando (MLCT) será más probable cuando el metal esté en un estado de oxidación bajo y el ligando se reduzca fácilmente.
En general, las transiciones de transferencia de carga dan como resultado colores más intensos que las transiciones dd.
En los complejos centrosimétricos, como los complejos octaédricos, las transiciones d - d están prohibidas por la regla de Laporte y solo ocurren debido al acoplamiento vibrónico en el que se produce una vibración molecular junto con una transición dd. Los complejos tetraédricos tienen un color algo más intenso porque es posible mezclar los orbitales d y p cuando no hay un centro de simetría, por lo que las transiciones no son transiciones dd puras. La absortividad molar (ε) de las bandas causadas por las transiciones dd es relativamente baja, aproximadamente en el rango de 5 a 500 M cm (donde M = mol dm). Algunos d - dlas transiciones están prohibidas. Un ejemplo ocurre en los complejos octaédricos de alto espín de manganeso (II), que tiene una configuración d en la que los cinco electrones tienen espines paralelos; el color de tales complejos es mucho más débil que en los complejos con transiciones permitidas por espín. Muchos compuestos de manganeso (II) parecen casi incoloros. El espectro de [Mn(H2O)6]muestra una absortividad molar máxima de alrededor de 0,04 M cm en el espectro visible.
Una característica de los metales de transición es que exhiben dos o más estados de oxidación, generalmente diferentes en uno. Por ejemplo, se conocen compuestos de vanadio en todos los estados de oxidación entre -1, como [V(CO)6], y +5, como VO4.
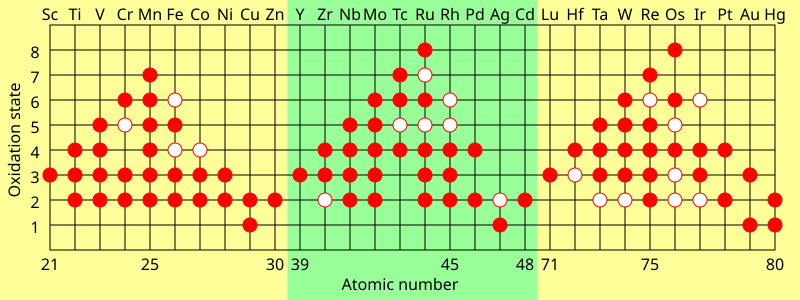 Estados de oxidación de los metales de transición. Los puntos sólidos muestran estados de oxidación comunes y los puntos huecos muestran estados posibles pero improbables.
Estados de oxidación de los metales de transición. Los puntos sólidos muestran estados de oxidación comunes y los puntos huecos muestran estados posibles pero improbables.
Los elementos del grupo principal en los grupos 13 a 18 también exhiben múltiples estados de oxidación. Los estados de oxidación "comunes" de estos elementos suelen diferir en dos en lugar de uno. Por ejemplo, existen compuestos de galio en los estados de oxidación +1 y +3 en los que hay un solo átomo de galio. Los compuestos de Ga(II) tendrían un electrón desapareado y se comportarían como un radical libre y generalmente se destruirían rápidamente, pero se conocen algunos radicales estables de Ga(II). El galio también tiene un estado de oxidación formal de +2 en compuestos diméricos, como [Ga2cl6], que contienen un enlace Ga-Ga formado a partir del electrón desapareado en cada átomo de Ga. Por lo tanto, la principal diferencia en los estados de oxidación entre los elementos de transición y otros elementos es que se conocen estados de oxidación en los que hay un solo átomo del elemento y uno o más electrones desapareados.
El estado de oxidación máximo en los metales de transición de la primera fila es igual al número de electrones de valencia desde el titanio (+4) hasta el manganeso (+7), pero disminuye en los últimos elementos. En la segunda fila, el máximo ocurre con rutenio (+8), y en la tercera fila, el máximo ocurre con iridio (+9). En compuestos como [MnO4]y OsO4, los elementos logran una configuración estable por enlace covalente.
Los estados de oxidación más bajos se exhiben en complejos de carbonilo metálico como Cr (CO)6(estado de oxidación cero) y [Fe(CO)4](estado de oxidación −2) en el que se cumple la regla de los 18 electrones. Estos complejos también son covalentes.
Los compuestos iónicos se forman principalmente con estados de oxidación +2 y +3. En solución acuosa, los iones se hidratan (generalmente) por seis moléculas de agua dispuestas octaédricamente.
Los compuestos de metales de transición son paramagnéticos cuando tienen uno o más electrones d desapareados. En los complejos octaédricos con entre cuatro y siete electrones d son posibles tanto los estados de espín alto como los de espín bajo. Complejos tetraédricos de metales de transición como [FeCl4]son de alto espín porque la división del campo cristalino es pequeña, por lo que la energía que se gana en virtud de que los electrones están en orbitales de menor energía siempre es menor que la energía necesaria para emparejar los espines. Algunos compuestos son diamagnéticos. Estos incluyen complejos octaédricos, de bajo espín, d y planos cuadrados . En estos casos, la división del campo cristalino es tal que todos los electrones están emparejados.
El ferromagnetismo ocurre cuando los átomos individuales son paramagnéticos y los vectores de espín están alineados paralelos entre sí en un material cristalino. El hierro metálico y la aleación alnico son ejemplos de materiales ferromagnéticos que involucran metales de transición. El antiferromagnetismo es otro ejemplo de una propiedad magnética que surge de una alineación particular de espines individuales en el estado sólido.
Los metales de transición y sus compuestos son conocidos por su actividad catalítica homogénea y heterogénea. Esta actividad se atribuye a su capacidad para adoptar múltiples estados de oxidación y formar complejos. El óxido de vanadio (V) (en el proceso de contacto), el hierro finamente dividido (en el proceso de Haber) y el níquel (en la hidrogenación catalítica) son algunos de los ejemplos. Los catalizadores en una superficie sólida (catalizadores basados en nanomateriales) implican la formación de enlaces entre las moléculas reactivas y los átomos de la superficie del catalizador (los metales de transición de la primera fila utilizan electrones 3d y 4s para la unión). Esto tiene el efecto de aumentar la concentración de los reactivos en la superficie del catalizador y también debilitar los enlaces en las moléculas que reaccionan (se reduce la energía de activación). También porque los iones de metales de transición pueden cambiar sus estados de oxidación,
Un tipo interesante de catálisis ocurre cuando los productos de una reacción catalizan la reacción que produce más catalizador (autocatálisis). Un ejemplo es la reacción del ácido oxálico con permanganato de potasio acidificado (o manganato (VII)). Una vez que se ha producido un poco de Mn, puede reaccionar con MnO 4 formando Mn. Este luego reacciona con los iones C 2 O 4 formando Mn nuevamente.
Como su nombre lo indica, todos los metales de transición son metales y, por lo tanto, conductores de electricidad.
En general, los metales de transición poseen una alta densidad y altos puntos de fusión y de ebullición. Estas propiedades se deben al enlace metálico por electrones d deslocalizados, lo que lleva a una cohesión que aumenta con el número de electrones compartidos. Sin embargo, los metales del grupo 12 tienen puntos de fusión y ebullición mucho más bajos, ya que sus subcapas d completas evitan la unión d-d, lo que nuevamente tiende a diferenciarlos de los metales de transición aceptados. El mercurio tiene un punto de fusión de -38,83 °C (-37,89 °F) y es líquido a temperatura ambiente.
En física, las interacciones fundamentales, también conocidas como fuerzas fundamentales, son las interacciones que no parecen ser reducibles a... (leer más)
Cisteína es un aminoácido proteinogénico semiesencial con la fórmula HOOC−CH(−NH2)−CH2−SH. La cadena lateral de tiol en la cisteína a menudo... (leer más)
Un ensamblaje supramolecular es un complejo de moléculas unidas por enlaces no covalentes. Si bien un ensamblaje supramolecular puede estar compuesto... (leer más)