Cisteína
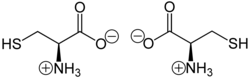
Cisteína (símbolo Cys o C;) es un aminoácido proteinogénico semiesencial con la fórmula HOOC−CH(−NH2)−CH2−SH. La cadena lateral de tiol en la cisteína a menudo participa en reacciones enzimáticas como nucleófilo.
Cuando está presente como un residuo catalítico desprotonado, a veces se usa el símbolo Cyz. La forma desprotonada generalmente también se puede describir con el símbolo Cym. El tiol es susceptible de oxidación para dar el derivado de disulfuro cistina, que cumple una función estructural importante en muchas proteínas. En este caso, a veces se usa el símbolo Cyx. Cuando se usa como aditivo alimentario, tiene el número E E920.
La cisteína está codificada por los codones UGU y UGC.
Los aminoácidos que contienen azufre cisteína y metionina se oxidan más fácilmente que los otros aminoácidos.
Estructura
Al igual que otros aminoácidos (no como un residuo de una proteína), la cisteína existe como un zwitterión. La cisteína tiene l quiralidad en la antigua notación d/l basada en la homología a d- y l-gliceraldehído. En el nuevo sistema R/S para designar la quiralidad, basado en los números atómicos de los átomos cerca del carbono asimétrico, la cisteína (y la selenocisteína) tienen R quiralidad, debido a la presencia de azufre (o selenio) como segundo vecino del átomo de carbono asimétrico. Los aminoácidos quirales restantes, que tienen átomos más ligeros en esa posición, tienen quiralidad S. Reemplazar azufre con selenio da selenocisteína.
Fuentes dietéticas
La cisteinil es un residuo en los alimentos ricos en proteínas. Algunos alimentos que se consideran ricos en cisteína son las aves de corral, los huevos, la carne de res y los cereales integrales. En las dietas ricas en proteínas, la cisteína puede ser parcialmente responsable de la reducción de la presión arterial y el riesgo de accidente cerebrovascular. Aunque se clasifica como un aminoácido no esencial, en casos raros, la cisteína puede ser esencial para los bebés, los ancianos y las personas con ciertas enfermedades metabólicas o que sufren síndromes de malabsorción. La cisteína generalmente puede ser sintetizada por el cuerpo humano en condiciones fisiológicas normales si se dispone de una cantidad suficiente de metionina.
Fuentes industriales
La mayor parte de la l-cisteína se obtiene industrialmente por hidrólisis de materiales animales, como plumas de aves o pelo de cerdo. A pesar de la creencia generalizada de lo contrario, poca evidencia muestra que el cabello humano se utiliza como material de origen y su uso está prohibido explícitamente para aditivos alimentarios y productos cosméticos en la Unión Europea. La l-cisteína producida sintéticamente, que cumple con las leyes judías kosher y musulmanas halal, también está disponible, aunque a un precio más alto. La ruta sintética involucra la fermentación usando un mutante de E. coli. Evonik (anteriormente Degussa) introdujo una ruta a partir de tiazolinas sustituidas. Siguiendo esta tecnología, la l-cisteína se produce mediante la hidrólisis del ácido racémico 2-amino-Δ2-tiazolina-4-carboxílico usando Pseudomonas thiazolinophilum.
Biosíntesis
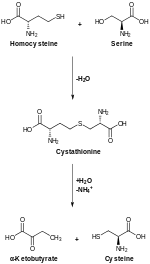
En los animales, la biosíntesis comienza con el aminoácido serina. El azufre se deriva de la metionina, que se convierte en homocisteína a través del intermedio S-adenosilmetionina. La cistationina beta-sintasa luego combina la homocisteína y la serina para formar el tioéter cistationina asimétrico. La enzima cistationina gamma-liasa convierte la cistationina en cisteína y alfa-cetobutirato. En plantas y bacterias, la biosíntesis de cisteína también comienza a partir de la serina, que se convierte en O-acetilserina por la enzima serina transacetilasa. La enzima cisteína sintasa, utilizando fuentes de sulfuro, convierte este éster en cisteína, liberando acetato.
Funciones biológicas
El grupo sulfhidrilo de cisteína es nucleófilo y se oxida fácilmente. La reactividad aumenta cuando el tiol se ioniza, y los residuos de cisteína en las proteínas tienen valores de pKa cercanos a la neutralidad, por lo que a menudo se encuentran en su forma de tiolato reactivo en la célula. Debido a su alta reactividad, el grupo sulfhidrilo de la cisteína tiene numerosas funciones biológicas.
Precursora del antioxidante glutatión
(feminine)Debido a la capacidad de los tioles para sufrir reacciones redox, los residuos de cisteína y cisteinilo tienen propiedades antioxidantes. Sus propiedades antioxidantes se expresan típicamente en el tripéptido glutatión, que se encuentra en humanos y otros organismos. La disponibilidad sistémica de glutatión oral (GSH) es insignificante; por lo que debe biosintetizarse a partir de sus aminoácidos constituyentes, cisteína, glicina y ácido glutámico. Si bien el ácido glutámico suele ser suficiente porque el nitrógeno de los aminoácidos se recicla a través del glutamato como intermediario, la suplementación con cisteína y glicina en la dieta puede mejorar la síntesis de glutatión.
Precursor de los grupos de hierro y azufre
La cisteína es una fuente importante de sulfuro en el metabolismo humano. El sulfuro en los grupos de hierro-azufre y en la nitrogenasa se extrae de la cisteína, que se convierte en alanina en el proceso.
Unión de iones metálicos
Más allá de las proteínas de hierro y azufre, muchos otros cofactores metálicos en las enzimas están unidos al sustituyente tiolato de los residuos de cisteinilo. Los ejemplos incluyen zinc en dedos de zinc y alcohol deshidrogenasa, cobre en las proteínas de cobre azul, hierro en el citocromo P450 y níquel en las [NiFe]-hidrogenasas. El grupo sulfhidrilo también tiene una gran afinidad por los metales pesados, por lo que las proteínas que contienen cisteína, como la metalotioneína, se unirán fuertemente a metales como el mercurio, el plomo y el cadmio.
Papeles en la estructura de proteínas
En la traducción de moléculas de ARN mensajero para producir polipéptidos, los codones UGU y UGC codifican la cisteína.
La cisteína se ha considerado tradicionalmente como un aminoácido hidrofílico, en gran parte debido al paralelo químico entre su grupo sulfhidrilo y los grupos hidroxilo en las cadenas laterales de otros aminoácidos polares. Sin embargo, se ha demostrado que la cadena lateral de cisteína estabiliza las interacciones hidrofóbicas en las micelas en mayor medida que la cadena lateral en el aminoácido no polar glicina y el aminoácido polar serina. En un análisis estadístico de la frecuencia con la que aparecen los aminoácidos en diferentes entornos químicos en las estructuras de las proteínas, se encontró que los residuos de cisteína libres se asociaban con regiones hidrofóbicas de las proteínas. Su tendencia hidrofóbica era equivalente a la de los aminoácidos no polares conocidos como la metionina y la tirosina (la tirosina es aromática polar pero también hidrofóbica), de los cuales era mucho mayor que la de los aminoácidos polares conocidos como la serina y la treonina. Las escalas de hidrofobicidad, que clasifican los aminoácidos desde los más hidrofóbicos hasta los más hidrofílicos, ubican consistentemente a la cisteína hacia el extremo hidrofóbico del espectro, incluso cuando se basan en métodos que no están influenciados por la tendencia de las cisteínas a formar enlaces disulfuro en las proteínas. Por lo tanto, la cisteína ahora se agrupa a menudo entre los aminoácidos hidrofóbicos, aunque a veces también se clasifica como ligeramente polar o polar.
Si bien existen residuos de cisteína libres en las proteínas, la mayoría están unidos covalentemente a otros residuos de cisteína para formar enlaces disulfuro, que desempeñan un papel importante en el plegamiento y la estabilidad de algunas proteínas, generalmente proteínas secretadas al medio extracelular. Dado que la mayoría de los compartimentos celulares son entornos reductores, los enlaces disulfuro son generalmente inestables en el citosol con algunas excepciones, como se indica a continuación.
Los enlaces disulfuro en las proteínas se forman por oxidación del grupo sulfhidrilo de los residuos de cisteína. El otro aminoácido que contiene azufre, la metionina, no puede formar enlaces disulfuro. Los oxidantes más agresivos convierten la cisteína en el correspondiente ácido sulfínico y ácido sulfónico. Los residuos de cisteína juegan un papel valioso al entrecruzar proteínas, lo que aumenta la rigidez de las proteínas y también funciona para conferir resistencia proteolítica (dado que la exportación de proteínas es un proceso costoso, es ventajoso minimizar su necesidad). Dentro de la célula, los puentes disulfuro entre los residuos de cisteína dentro de un polipéptido sostienen la estructura terciaria de la proteína. La insulina es un ejemplo de una proteína con reticulación de cistina, en la que dos cadenas peptídicas separadas están conectadas por un par de enlaces disulfuro.
Las proteínas disulfuro isomerasas catalizan la formación adecuada de enlaces disulfuro; la célula transfiere ácido dehidroascórbico al retículo endoplásmico, que oxida el medio ambiente. En este entorno, las cisteínas, en general, se oxidan a cistina y ya no son funcionales como nucleófilos.
Además de su oxidación a cistina, la cisteína participa en numerosas modificaciones postraduccionales. El grupo sulfhidrilo nucleófilo permite que la cisteína se conjugue con otros grupos, por ejemplo, en la prenilación. Las ligasas de ubiquitina transfieren ubiquitina a su colgante, proteínas y caspasas, que participan en la proteólisis en el ciclo apoptótico. Las inteínas a menudo funcionan con la ayuda de una cisteína catalítica. Estas funciones normalmente se limitan al medio intracelular, donde el entorno se reduce y la cisteína no se oxida a cistina.
Aplicaciones
La cisteína, principalmente el enantiómero l, es un precursor en las industrias alimentaria, farmacéutica y de cuidado personal. Una de las mayores aplicaciones es la producción de sabores. Por ejemplo, la reacción de cisteína con azúcares en una reacción de Maillard produce sabores a carne. l-La cisteína también se usa como coadyuvante de procesamiento para hornear.
En el campo del cuidado personal, la cisteína se usa para aplicaciones de onda permanente, predominantemente en Asia. Nuevamente, la cisteína se usa para romper los enlaces disulfuro en la queratina del cabello.
La cisteína es un objetivo muy popular para los experimentos de marcado dirigido al sitio para investigar la estructura y la dinámica biomolecular. Las maleimidas se unen selectivamente a la cisteína mediante una adición covalente de Michael. El etiquetado de espín dirigido al sitio para EPR o RMN potenciada por relajación paramagnética también usa cisteína ampliamente.
Reducción de los efectos tóxicos del alcohol
La cisteína se ha propuesto como preventivo o antídoto para algunos de los efectos negativos del alcohol, incluido el daño hepático y la resaca. Contrarresta los efectos venenosos del acetaldehído. La cisteína respalda el siguiente paso en el metabolismo, que convierte el acetaldehído en ácido acético.
En un estudio con ratas, los animales de prueba recibieron una dosis LD90 de acetaldehído. Los que recibieron cisteína tuvieron una tasa de supervivencia del 80 %; cuando se administraron cisteína y tiamina, todos los animales sobrevivieron. El grupo de control tuvo una tasa de supervivencia del 10%.
En 2020, se publicó un artículo que sugiere que la L-cisteína también podría funcionar en humanos.
N-Acetilcisteína
La N-acetil-l-cisteína es un derivado de la cisteína en el que un grupo acetilo está unido al átomo de nitrógeno. Este compuesto se vende como suplemento dietético y se usa como antídoto en casos de sobredosis de paracetamol.
Oveja
Las ovejas necesitan cisteína para producir lana. Es un aminoácido esencial que debe tomarse de su alimentación. Como consecuencia, durante condiciones de sequía, las ovejas producen menos lana; sin embargo, se han desarrollado ovejas transgénicas que pueden producir su propia cisteína.
Restricciones dietéticas
Las fuentes de origen animal de l-cisteína como aditivo alimentario son un punto de discusión para las personas que siguen restricciones dietéticas como kosher, halal, vegana o vegetariana. Para evitar este problema, la l-cisteína también puede obtenerse de microbios u otros procesos sintéticos.
Historia
En 1884, el químico alemán Eugen Baumann descubrió que cuando se trataba la cistina con un agente reductor, la cistina se revelaba como un dímero de un monómero al que denominó "cisteína".
Contenido relacionado
Mol (unidad)
Trimix (respiración de gas)
Grupo acetilo