Metal
Un metal (del griego μέταλλον métallon, "mina, cantera, metal") es un material que, cuando está recién preparado, pulido o fracturado, muestra una apariencia brillante y conduce relativamente bien la electricidad y el calor. Los metales suelen ser maleables (se pueden martillar en láminas delgadas) o dúctiles (se pueden estirar en alambres). Un metal puede ser un elemento químico como el hierro; una aleación como el acero inoxidable; o un compuesto molecular tal como nitruro de azufre polimérico.
En física, un metal se considera generalmente como cualquier sustancia capaz de conducir electricidad a una temperatura de cero absoluto. Muchos elementos y compuestos que normalmente no se clasifican como metales se vuelven metálicos bajo altas presiones. Por ejemplo, el yodo no metálico se convierte gradualmente en metal a una presión de entre 40 y 170 mil veces la presión atmosférica. Asimismo, algunos materiales considerados como metales pueden convertirse en no metales. El sodio, por ejemplo, se convierte en un no metal a una presión de poco menos de dos millones de veces la presión atmosférica.
En química, dos elementos que de otro modo calificarían (en física) como metales frágiles, el arsénico y el antimonio, se reconocen comúnmente como metaloides debido a su química (predominantemente no metálico para el arsénico y equilibrado entre metalicidad y no metalicidad para el antimonio). Alrededor de 95 de los 118 elementos de la tabla periódica son metales (o es probable que lo sean). El número es inexacto ya que los límites entre metales, no metales y metaloides fluctúan ligeramente debido a la falta de definiciones universalmente aceptadas de las categorías involucradas.
En astrofísica, el término "metal" se utiliza más ampliamente para referirse a todos los elementos químicos de una estrella que son más pesados que el helio, y no solo a los metales tradicionales. En este sentido, los primeros cuatro "metales" que se acumulan en los núcleos estelares a través de la nucleosíntesis son el carbono, el nitrógeno, el oxígeno y el neón, todos los cuales son estrictamente no metales en química. Una estrella fusiona átomos más ligeros, principalmente hidrógeno y helio, en átomos más pesados durante su vida. Usada en ese sentido, la metalicidad de un objeto astronómico es la proporción de su materia compuesta por los elementos químicos más pesados.
Los metales, como elementos químicos, comprenden el 25% de la corteza terrestre y están presentes en muchos aspectos de la vida moderna. La resistencia y resiliencia de algunos metales ha llevado a su uso frecuente, por ejemplo, en la construcción de puentes y edificios de gran altura, así como en la mayoría de los vehículos, muchos electrodomésticos, herramientas, tuberías y vías férreas. Históricamente, los metales preciosos se utilizaron como acuñación, pero en la era moderna, los metales de acuñación se han extendido a al menos 23 de los elementos químicos.
Se cree que la historia de los metales refinados comienza con el uso del cobre hace unos 11.000 años. El oro, la plata, el hierro (como hierro meteórico), el plomo y el latón también se usaban antes de la primera aparición conocida del bronce en el quinto milenio a. Los desarrollos posteriores incluyen la producción de formas tempranas de acero; el descubrimiento del sodio, el primer metal ligero, en 1809; el auge de los aceros aleados modernos; y, desde el final de la Segunda Guerra Mundial, el desarrollo de aleaciones más sofisticadas.
Propiedades
Forma y estructura
Los metales son brillantes y lustrosos, al menos cuando están recién preparados, pulidos o fracturados. Las láminas de metal con un grosor superior a unos pocos micrómetros parecen opacas, pero el pan de oro transmite luz verde.
El estado sólido o líquido de los metales se origina en gran medida en la capacidad de los átomos metálicos involucrados para perder fácilmente los electrones de su capa externa. En términos generales, las fuerzas que mantienen en su lugar a los electrones de la capa externa de un átomo individual son más débiles que las fuerzas de atracción sobre los mismos electrones que surgen de las interacciones entre los átomos en el metal sólido o líquido. Los electrones involucrados se deslocalizan y la estructura atómica de un metal puede visualizarse efectivamente como una colección de átomos incrustados en una nube de electrones relativamente móviles. Este tipo de interacción se llama enlace metálico. La fuerza de los enlaces metálicos para diferentes metales elementales alcanza un máximo alrededor del centro de la serie de metales de transición, ya que estos elementos tienen una gran cantidad de electrones deslocalizados.
Aunque la mayoría de los metales elementales tienen densidades más altas que la mayoría de los no metales, existe una amplia variación en sus densidades, siendo el litio el menos denso (0,534 g/cm ) y el osmio (22,59 g/cm ) el más denso. El magnesio, el aluminio y el titanio son metales ligeros de gran importancia comercial. Sus densidades respectivas de 1,7, 2,7 y 4,5 g/cm pueden compararse con las de los metales estructurales más antiguos, como el hierro con 7,9 y el cobre con 8,9 g/cm. Una bola de hierro pesaría tanto como tres bolas de aluminio del mismo volumen.
Los metales son típicamente maleables y dúctiles, deformándose bajo tensión sin romperse. Se cree que la naturaleza no direccional del enlace metálico contribuye significativamente a la ductilidad de la mayoría de los sólidos metálicos. Por el contrario, en un compuesto iónico como la sal de mesa, cuando los planos de un enlace iónico se deslizan entre sí, el cambio de ubicación resultante desplaza a los iones de la misma carga a una proximidad cercana, lo que provoca la escisión del cristal. Tal cambio no se observa en un cristal unido covalentemente, como un diamante, donde se produce la fractura y la fragmentación del cristal. La deformación elástica reversible en los metales puede describirse mediante la Ley de Hooke para restaurar las fuerzas, donde la tensión es linealmente proporcional a la deformación.
El calor o las fuerzas mayores que el límite elástico de un metal pueden causar una deformación permanente (irreversible), conocida como deformación plástica o plasticidad. Una fuerza aplicada puede ser una fuerza de tracción (tracción), una fuerza de compresión (empuje) o una fuerza de corte, flexión o torsión (torsión). Un cambio de temperatura puede afectar el movimiento o el desplazamiento de defectos estructurales en el metal, como límites de grano, puntos vacantes, dislocaciones de línea y tornillo, fallas de apilamiento y maclas en metales cristalinos y no cristalinos. Puede producirse deslizamiento interno, fluencia y fatiga del metal.
Los átomos de las sustancias metálicas se organizan típicamente en una de las tres estructuras cristalinas comunes, a saber, cúbica centrada en el cuerpo (bcc), cúbica centrada en la cara (fcc) y empaquetada hexagonal (hcp). En bcc, cada átomo se coloca en el centro de un cubo de otros ocho. En fcc y hcp, cada átomo está rodeado por otros doce, pero el apilamiento de las capas difiere. Algunos metales adoptan diferentes estructuras dependiendo de la temperatura.
 Estructura cristalina cúbica centrada en el cuerpo, con una celda unitaria de 2 átomos, como se encuentra, por ejemplo, en cromo, hierro y tungsteno
Estructura cristalina cúbica centrada en el cuerpo, con una celda unitaria de 2 átomos, como se encuentra, por ejemplo, en cromo, hierro y tungsteno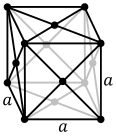 Estructura cristalina cúbica centrada en las caras, con una celda unitaria de 4 átomos, como la que se encuentra, por ejemplo, en aluminio, cobre y oro.
Estructura cristalina cúbica centrada en las caras, con una celda unitaria de 4 átomos, como la que se encuentra, por ejemplo, en aluminio, cobre y oro. Estructura cristalina compacta hexagonal, con una celda unitaria de 6 átomos, como la que se encuentra, por ejemplo, en titanio, cobalto y zinc.
Estructura cristalina compacta hexagonal, con una celda unitaria de 6 átomos, como la que se encuentra, por ejemplo, en titanio, cobalto y zinc.
La celda unitaria para cada estructura cristalina es el grupo más pequeño de átomos que tiene la simetría general del cristal, y a partir del cual se puede construir toda la red cristalina por repetición en tres dimensiones. En el caso de la estructura cristalina cúbica centrada en el cuerpo que se muestra arriba, la celda unitaria se compone del átomo central más uno-ocho de cada uno de los ocho átomos de las esquinas.
Eléctrico y térmico
La estructura electrónica de los metales significa que son relativamente buenos conductores de electricidad. Los electrones en la materia solo pueden tener niveles de energía fijos en lugar de variables, y en un metal los niveles de energía de los electrones en su nube de electrones, al menos hasta cierto punto, corresponden a los niveles de energía en los que puede ocurrir la conducción eléctrica. En un semiconductor como el silicio o un no metal como el azufre, existe una brecha de energía entre los electrones de la sustancia y el nivel de energía al que puede ocurrir la conducción eléctrica. En consecuencia, los semiconductores y los no metales son relativamente malos conductores.
Los metales elementales tienen valores de conductividad eléctrica desde 6,9 × 10 S/cm para el manganeso hasta 6,3 × 10 S/cm para la plata. Por el contrario, un metaloide semiconductor como el boro tiene una conductividad eléctrica de 1,5 × 10 S/cm. Con una excepción, los elementos metálicos reducen su conductividad eléctrica cuando se calientan. El plutonio aumenta su conductividad eléctrica cuando se calienta en un rango de temperatura de alrededor de -175 a +125 °C.
Los metales son relativamente buenos conductores del calor. Los electrones en la nube de electrones de un metal son altamente móviles y fácilmente capaces de transmitir energía vibracional inducida por calor.
La contribución de los electrones de un metal a su capacidad calorífica y conductividad térmica, y la conductividad eléctrica del metal en sí, se pueden calcular a partir del modelo de electrones libres. Sin embargo, esto no tiene en cuenta la estructura detallada de la red de iones del metal. Tener en cuenta el potencial positivo causado por la disposición de los núcleos de iones permite considerar la estructura de bandas electrónicas y la energía de enlace de un metal. Son aplicables varios modelos matemáticos, siendo el más simple el modelo de electrones casi libres.
Químico
Los metales suelen tender a formar cationes a través de la pérdida de electrones. La mayoría reaccionará con el oxígeno del aire para formar óxidos en varias escalas de tiempo (el potasio se quema en segundos mientras que el hierro se oxida en años). Algunos otros, como el paladio, el platino y el oro, no reaccionan en absoluto con la atmósfera. Los óxidos de los metales son generalmente básicos, a diferencia de los de los no metales, que son ácidos o neutros. Las excepciones son en gran medida los óxidos con estados de oxidación muy altos, como CrO 3, Mn 2 O 7 y OsO 4, que tienen reacciones estrictamente ácidas.
Pintar, anodizar o enchapar metales son buenas formas de prevenir su corrosión. Sin embargo, se debe elegir un metal más reactivo en la serie electroquímica para el recubrimiento, especialmente cuando se espera que el recubrimiento se astille. El agua y los dos metales forman una celda electroquímica y, si el recubrimiento es menos reactivo que el metal subyacente, el recubrimiento en realidad promueve la corrosión.
Distribución de la tabla periódica
En química, los elementos que normalmente se consideran metales en condiciones ordinarias se muestran en amarillo en la siguiente tabla periódica. Los elementos restantes son metaloides (B, Si, Ge, As, Sb y Te se reconocen comúnmente como tales) o no metales. El astato (At) generalmente se clasifica como un no metal o un metaloide, pero algunas predicciones esperan que sea un metal; como tal, se ha dejado en blanco debido al estado no concluyente del conocimiento experimental. Es probable que los otros elementos que se muestran con propiedades desconocidas sean metales, pero existen algunas dudas sobre el copernicio (Cn) y el oganesón (Og).
| escondervtmiMetales-metaloides-no metales en la tabla periódica | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | dieciséis | 17 | 18 | |||||||||||||||
| Grupo → | ||||||||||||||||||||||||||||||||
| ↓ Período | ||||||||||||||||||||||||||||||||
| 1 | H | Él | ||||||||||||||||||||||||||||||
| 2 | li | Ser | B | C | norte | O | F | Nordeste | ||||||||||||||||||||||||
| 3 | N / A | magnesio | Alabama | Si | PAG | S | cl | Arkansas | ||||||||||||||||||||||||
| 4 | k | California | Carolina del Sur | ti | V | cr | Minnesota | Fe | Co | Ni | cobre | zinc | Georgia | ge | Como | Se | hermano | kr | ||||||||||||||
| 5 | Rb | señor | Y | Zr | Nótese bien | Mes | tc | ru | Rh | PD | Agricultura | Discos compactos | En | sn | Sb | Te | yo | Xe | ||||||||||||||
| 6 | cs | Licenciado en Letras | La | Ce | PR | Dakota del Norte | Pm | pequeño | UE | Di-s | Tuberculosis | dy | Ho | Eh | Tm | Yb | Lu | H.f. | Ejército de reserva | W | Re | Os | ir | punto | Au | Hg | Tl | Pb | Bi | Correos | En | Rn |
| 7 | fr | Real academia de bellas artes | C.A | el | Pensilvania | tu | Notario público | PU | Soy | Cm | negro | Cf. | ES | FM | Maryland | No | Lr | radiofrecuencia | DB | sg | bh | hs | Monte | Ds | Rg | cn | Nueva Hampshire | Florida | Mc | Lv | ts | og |
| Metal Metaloide No metal Propiedades desconocidasEl color de fondo muestra la tendencia metal-metaloide-no metal en la tabla periódica |
Aleaciones
Una aleación es una sustancia que tiene propiedades metálicas y que se compone de dos o más elementos, de los cuales al menos uno es un metal. Una aleación puede tener una composición variable o fija. Por ejemplo, el oro y la plata forman una aleación en la que las proporciones de oro o plata se pueden ajustar libremente; el titanio y el silicio forman una aleación Ti 2 Si en la que se fija la proporción de los dos componentes (también conocido como compuesto intermetálico).
La mayoría de los metales puros son demasiado blandos, quebradizos o químicamente reactivos para un uso práctico. La combinación de diferentes proporciones de metales como aleaciones modifica las propiedades de los metales puros para producir características deseables. El objetivo de hacer aleaciones generalmente es hacerlas menos quebradizas, más duras, resistentes a la corrosión o que tengan un color y brillo más deseables. De todas las aleaciones metálicas en uso hoy en día, las aleaciones de hierro (acero, acero inoxidable, hierro fundido, acero para herramientas, acero aleado) constituyen la mayor proporción tanto en cantidad como en valor comercial. El hierro aleado con diversas proporciones de carbono da lugar a aceros de bajo, medio y alto contenido de carbono, con niveles crecientes de carbono que reducen la ductilidad y la tenacidad. La adición de silicio producirá hierros fundidos, mientras que la adición de cromo, níquel,
Otras aleaciones metálicas importantes son las de aluminio, titanio, cobre y magnesio. Las aleaciones de cobre se conocen desde la prehistoria (el bronce dio nombre a la Edad del Bronce) y tienen muchas aplicaciones en la actualidad, sobre todo en el cableado eléctrico. Las aleaciones de los otros tres metales se han desarrollado relativamente recientemente; debido a su reactividad química requieren procesos de extracción electrolítica. Las aleaciones de aluminio, titanio y magnesio se valoran por su alta relación resistencia-peso; el magnesio también puede proporcionar protección electromagnética. Estos materiales son ideales para situaciones en las que una alta relación resistencia-peso es más importante que el costo del material, como en aplicaciones aeroespaciales y automotrices.
Las aleaciones especialmente diseñadas para aplicaciones muy exigentes, como los motores a reacción, pueden contener más de diez elementos.
Categorías
| elementos metalicos |
|---|
| Metales alcalinos |
| litiosodiopotasiorubidiocesiofrancio |
| Metales alcalinotérreos |
| beriliomagnesiocalcioestronciobarioradio |
| Metales de transición |
| escandiotitaniovanadiocromomanganesoplancharcobaltoníquelcobreitriocirconioniobiomolibdenotecnecioruteniorodiopaladioplatahafniotantaliotungstenorenioosmioiridioplatinoororutherfordiodubnioseaborgiobohriohassio |
| Metales posteriores a la transición |
| aluminiozincgaliocadmioindioestañomercuriotalioPlomobismutopolonioastato |
| lantánidos |
| lantanoceriopraseodimioneodimioprometeosamarioeuropiogadolinioterbiodisprosioholmioerbiotulioiterbiolutecio |
| actínidos |
| actiniotorioprotactiniouranioneptunioplutonioamericiocurioberkeliocalifornioeinsteniofermiomendelevionobeliolaurencio |
| Elementos que posiblemente sean metales |
| meitneriodarmestadioroentgeniocopernicionihoniofleroviomoscoviohígadomoriotennessineoganesson |
| Elementos que a veces se consideran metales |
| germanioarsénicoselenioantimoniotelurio |
| vtmi |
Los metales se pueden clasificar según sus propiedades físicas o químicas. Las categorías descritas en las subsecciones siguientes incluyen metales ferrosos y no ferrosos; metales frágiles y metales refractarios; metales blancos; metales pesados y ligeros; y metales básicos, nobles y preciosos. La tabla de elementos metálicos de esta sección clasifica los metales elementales según sus propiedades químicas en metales alcalinos y alcalinotérreos; metales de transición y post-transición; y lantánidos y actínidos. Otras categorías son posibles, dependiendo de los criterios de inclusión. Por ejemplo, los metales ferromagnéticos, aquellos metales que son magnéticos a temperatura ambiente, son el hierro, el cobalto y el níquel.
Metales ferrosos y no ferrosos
El término "ferroso" se deriva de la palabra latina que significa "que contiene hierro". Esto puede incluir hierro puro, como el hierro forjado, o una aleación como el acero. Los metales ferrosos suelen ser magnéticos, pero no exclusivamente. Los metales no ferrosos y las aleaciones carecen de cantidades apreciables de hierro.
Metal quebradizo
Si bien casi todos los metales son maleables o dúctiles, algunos (berilio, cromo, manganeso, galio y bismuto) son frágiles. El arsénico y el antimonio, si se admiten como metales, son quebradizos. Los valores bajos de la relación entre el módulo de elasticidad aparente y el módulo de corte (criterio de Pugh) son indicativos de fragilidad intrínseca.
Metal refractario
En ciencia de materiales, metalurgia e ingeniería, un metal refractario es un metal extraordinariamente resistente al calor y al desgaste. Los metales que pertenecen a esta categoría varían; la definición más común incluye niobio, molibdeno, tantalio, tungsteno y renio. Todos ellos tienen puntos de fusión por encima de los 2000 °C, y una elevada dureza a temperatura ambiente.
 Cristales de niobio y un cubo de niobio anodizado de 1 cm para comparar
Cristales de niobio y un cubo de niobio anodizado de 1 cm para comparar Cristales de molibdeno y un cubo de molibdeno de 1 cm para comparar
Cristales de molibdeno y un cubo de molibdeno de 1 cm para comparar Monocristal de tantalio, algunos fragmentos cristalinos y un cubo de tantalio de 1 cm para comparar
Monocristal de tantalio, algunos fragmentos cristalinos y un cubo de tantalio de 1 cm para comparar Varillas de tungsteno con cristales evaporados, parcialmente oxidados con manchas de colores y un cubo de tungsteno de 1 cm para comparar
Varillas de tungsteno con cristales evaporados, parcialmente oxidados con manchas de colores y un cubo de tungsteno de 1 cm para comparar Cristal único de renio, una barra refundida y un cubo de renio de 1 cm para comparar
Cristal único de renio, una barra refundida y un cubo de renio de 1 cm para comparar
Metal blanco
Un metal blanco es cualquiera de la gama de metales de color blanco (o sus aleaciones) con puntos de fusión relativamente bajos. Tales metales incluyen zinc, cadmio, estaño, antimonio (aquí considerado como un metal), plomo y bismuto, algunos de los cuales son bastante tóxicos. En Gran Bretaña, el comercio de bellas artes utiliza el término "metal blanco" en los catálogos de subastas para describir artículos de plata extranjeros que no llevan las marcas de la Oficina de Ensayos Británica, pero que, sin embargo, se entiende que son plata y tienen un precio acorde.
Metales pesados y ligeros
Un metal pesado es cualquier metal o metaloide relativamente denso. Se han propuesto definiciones más específicas, pero ninguna ha obtenido una aceptación generalizada. Algunos metales pesados tienen usos especializados o son notablemente tóxicos; algunos son esenciales en pequeñas cantidades. Todos los demás metales son metales ligeros.
Metales básicos, nobles y preciosos
En química, el término metal base se usa de manera informal para referirse a un metal que se oxida o corroe fácilmente, como cuando reacciona fácilmente con ácido clorhídrico diluido (HCl) para formar un cloruro metálico e hidrógeno. Los ejemplos incluyen hierro, níquel, plomo y zinc. El cobre se considera un metal base ya que se oxida con relativa facilidad, aunque no reacciona con el HCl.
El término metal noble se usa comúnmente en oposición a metal base. Los metales nobles son resistentes a la corrosión oa la oxidación, a diferencia de la mayoría de los metales básicos. Tienden a ser metales preciosos, a menudo debido a la rareza percibida. Los ejemplos incluyen oro, platino, plata, rodio, iridio y paladio.
En alquimia y numismática se contrasta el término metal base con metal precioso, es decir, aquellos de alto valor económico. Un objetivo de mucho tiempo de los alquimistas fue la transmutación de los metales básicos en metales preciosos, incluidos metales de acuñación como la plata y el oro. La mayoría de las monedas actuales están hechas de metales básicos con un valor intrínseco bajo; En el pasado, las monedas frecuentemente derivaban su valor principalmente de su contenido de metales preciosos.
Químicamente, los metales preciosos (como los metales nobles) son menos reactivos que la mayoría de los elementos, tienen un alto brillo y una alta conductividad eléctrica. Históricamente, los metales preciosos fueron importantes como moneda, pero ahora se consideran principalmente como bienes de inversión e industriales. El oro, la plata, el platino y el paladio tienen cada uno un código de moneda ISO 4217. Los metales preciosos más conocidos son el oro y la plata. Si bien ambos tienen usos industriales, son más conocidos por sus usos en el arte, la joyería y la acuñación. Otros metales preciosos incluyen los metales del grupo del platino: rutenio, rodio, paladio, osmio, iridio y platino, de los cuales el platino es el más comercializado.
La demanda de metales preciosos está impulsada no solo por su uso práctico, sino también por su papel como inversiones y depósito de valor. El paladio y el platino, a partir del otoño de 2018, se valoraron en aproximadamente tres cuartas partes del precio del oro. La plata es sustancialmente menos costosa que estos metales, pero a menudo se considera tradicionalmente un metal precioso a la luz de su papel en la acuñación y joyería.
Metales de valvula
En electroquímica, un metal de válvula es un metal que pasa corriente en una sola dirección.
Ciclo vital
Formación
| Metales en la corteza terrestre:vtmi | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| abundancia y ocurrencia principal o fuente, por peso | |||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | dieciséis | 17 | 18 | ||
| 1 | H | Él | |||||||||||||||||
| 2 | li | Ser | B | C | norte | O | F | Nordeste | |||||||||||
| 3 | N / A | magnesio | Alabama | Si | PAG | S | cl | Arkansas | |||||||||||
| 4 | k | California | Carolina del Sur | ti | V | cr | Minnesota | Fe | Co | Ni | cobre | zinc | Georgia | ge | Como | Se | hermano | kr | |
| 5 | Rb | señor | Y | Zr | Nótese bien | Mes | ru | Rh | PD | Agricultura | Discos compactos | En | sn | Sb | Te | yo | Xe | ||
| 6 | cs | Licenciado en Letras | Lu | H.f. | Ejército de reserva | W | Re | Os | ir | punto | Au | Hg | Tl | Pb | Bi | ||||
| 7 | |||||||||||||||||||
| La | Ce | PR | Dakota del Norte | pequeño | UE | Di-s | Tuberculosis | dy | Ho | Eh | Tm | Yb | |||||||
| el | tu | ||||||||||||||||||
| más abundante (hasta82 000 ppm) | |||||||||||||||||||
| Abundante (100 -999 ppm) | |||||||||||||||||||
| Poco común (1–99 ppm) | |||||||||||||||||||
| Extraño (0.01 –0,99 ppm) | |||||||||||||||||||
| Muy raro (0.0001 –0,0099 ppm) | |||||||||||||||||||
| Los metales a la izquierda de la línea divisoria ocurren (o se obtienen) principalmente como litófilos; los de la derecha, como calcófilos excepto el oro (un siderófilo) y el estaño (un litófilo). |
Esta subsección trata de la formación de los metales elementales de la tabla periódica, ya que estos forman la base de los materiales metálicos, tal como se definen en este artículo.
Los metales hasta la vecindad del hierro (en la tabla periódica) se producen en gran medida a través de la nucleosíntesis estelar. En este proceso, los elementos más livianos, desde el hidrógeno hasta el silicio, experimentan sucesivas reacciones de fusión dentro de las estrellas, liberando luz y calor y formando elementos más pesados con números atómicos más altos.
Los metales más pesados no suelen formarse de esta manera, ya que las reacciones de fusión en las que intervienen tales núcleos consumirían energía en lugar de liberarla. Más bien, se sintetizan en gran medida (a partir de elementos con un número atómico más bajo) por captura de neutrones, siendo los dos modos principales de esta captura repetitiva el proceso s y el proceso r. En el proceso s ("s" significa "lento"), las capturas singulares se separan por años o décadas, lo que permite que los núcleos menos estables se desintegren en beta.mientras que en el proceso r ("rápido"), las capturas ocurren más rápido de lo que los núcleos pueden decaer. Por lo tanto, el proceso s sigue un camino más o menos claro: por ejemplo, los núcleos estables de cadmio-110 son bombardeados sucesivamente por neutrones libres dentro de una estrella hasta que forman núcleos de cadmio-115 que son inestables y se descomponen para formar indio-115. (que es casi estable, con una vida media30 000 veces la edad del universo). Estos núcleos capturan neutrones y forman indio-116, que es inestable, y se descompone para formar estaño-116, y así sucesivamente. Por el contrario, no existe tal camino en el proceso r. El proceso s se detiene en el bismuto debido a la corta vida media de los siguientes dos elementos, polonio y astato, que se descomponen en bismuto o plomo. El proceso r es tan rápido que puede saltarse esta zona de inestabilidad y crear elementos más pesados como el torio y el uranio.
Los metales se condensan en los planetas como resultado de los procesos de evolución y destrucción estelar. Las estrellas pierden gran parte de su masa cuando es expulsada al final de su vida y, a veces, como resultado de una fusión de estrellas de neutrones, lo que aumenta la abundancia de elementos más pesados que el helio en el medio interestelar. Cuando la atracción gravitacional hace que esta materia se fusione y colapse, se forman nuevas estrellas y planetas.
Abundancia y ocurrencia
La corteza terrestre está formada por aproximadamente un 25 % de metales en peso, de los cuales el 80 % son metales ligeros como el sodio, el magnesio y el aluminio. Los no metales (~75%) constituyen el resto de la corteza. A pesar de la escasez general de algunos metales más pesados como el cobre, pueden concentrarse en cantidades económicamente extraíbles como resultado de la formación de montañas, la erosión u otros procesos geológicos.
Los metales se encuentran principalmente como litófilos (amantes de las rocas) o calcófilos (amantes de los minerales). Los metales litófilos son principalmente los elementos del bloque s, los más reactivos de los elementos del bloque d y los elementos del bloque f. Tienen una fuerte afinidad por el oxígeno y en su mayoría existen como minerales de silicato de densidad relativamente baja. Los metales calcófilos son principalmente los elementos del bloque d menos reactivos y los metales del bloque p del período 4–6. Por lo general, se encuentran en minerales de sulfuro (insolubles). Al ser más densos que los litófilos, por lo que se hunden más en la corteza en el momento de su solidificación, los calcófilos tienden a ser menos abundantes que los litófilos.
Por otro lado, el oro es un elemento siderófilo o amante del hierro. No forma fácilmente compuestos con oxígeno o azufre. En el momento de la formación de la Tierra, y como el más noble (inerte) de los metales, el oro se hundió en el núcleo debido a su tendencia a formar aleaciones metálicas de alta densidad. En consecuencia, es un metal relativamente raro. Algunos otros metales (menos) nobles (molibdeno, renio, los metales del grupo del platino (rutenio, rodio, paladio, osmio, iridio y platino), germanio y estaño) pueden considerarse siderófilos, pero solo en términos de su aparición principal en la Tierra (núcleo, manto y corteza), más bien la corteza. Por lo demás, estos metales se encuentran en la corteza, en pequeñas cantidades, principalmente como calcófilos (menos en su forma nativa).
Se cree que el núcleo externo fluido giratorio del interior de la Tierra, que está compuesto principalmente de hierro, es la fuente del campo magnético protector de la Tierra. El núcleo se encuentra por encima del núcleo interno sólido de la Tierra y por debajo de su manto. Si pudiera reorganizarse en una columna con una huella de 5 m (54 pies cuadrados), tendría una altura de casi 700 años luz. El campo magnético protege a la Tierra de las partículas cargadas del viento solar y de los rayos cósmicos que, de lo contrario, eliminarían la atmósfera superior (incluida la capa de ozono que limita la transmisión de la radiación ultravioleta).
Extracción
Los metales a menudo se extraen de la Tierra mediante la extracción de minerales que son fuentes ricas en los elementos necesarios, como la bauxita. El mineral se localiza mediante técnicas de prospección, seguidas de la exploración y examen de los yacimientos. Las fuentes minerales generalmente se dividen en minas de superficie, que se extraen mediante excavación con equipo pesado, y minas subterráneas. En algunos casos, el precio de venta de los metales involucrados hace que sea económicamente factible extraer fuentes de menor concentración.
Una vez extraído el mineral, se deben extraer los metales, generalmente mediante reducción química o electrolítica. La pirometalurgia usa altas temperaturas para convertir el mineral en metales crudos, mientras que la hidrometalurgia emplea la química acuosa para el mismo propósito. Los métodos utilizados dependen del metal y sus contaminantes.
Cuando un mineral metálico es un compuesto iónico de ese metal y un no metal, el mineral generalmente debe fundirse, calentarse con un agente reductor, para extraer el metal puro. Muchos metales comunes, como el hierro, se funden utilizando carbono como agente reductor. Algunos metales, como el aluminio y el sodio, no tienen un agente reductor comercialmente práctico y, en su lugar, se extraen mediante electrólisis.
Los minerales de sulfuro no se reducen directamente al metal, sino que se tuestan al aire para convertirlos en óxidos.
Usos
Los metales están presentes en casi todos los aspectos de la vida moderna. El hierro, un metal pesado, puede ser el más común ya que representa el 90 % de todos los metales refinados; el aluminio, un metal ligero, es el siguiente metal más comúnmente refinado. El hierro puro puede ser el elemento metálico más barato de todos a un costo de alrededor de US$0,07 por gramo. Sus minerales están muy extendidos; es fácil de refinar; y la tecnología involucrada se ha desarrollado durante cientos de años. El hierro fundido es aún más barato, a una fracción de US$0,01 por gramo, porque no hay necesidad de purificación posterior. El platino, a un costo de alrededor de $ 27 por gramo, puede ser el más omnipresente debido a su punto de fusión muy alto, resistencia a la corrosión, conductividad eléctrica y durabilidad. Se dice que se encuentra o se utiliza para producir el 20% de todos los bienes de consumo. Es probable que el polonio sea el metal más caro,debido a su escasez y producción a microescala.
Algunos metales y aleaciones de metales poseen una alta resistencia estructural por unidad de masa, lo que los convierte en materiales útiles para transportar grandes cargas o resistir daños por impacto. Las aleaciones metálicas se pueden diseñar para que tengan una alta resistencia al corte, el par y la deformación. Sin embargo, el mismo metal también puede ser vulnerable al daño por fatiga por el uso repetido o por una falla repentina por estrés cuando se excede la capacidad de carga. La resistencia y resiliencia de los metales ha llevado a su uso frecuente en la construcción de puentes y edificios de gran altura, así como en la mayoría de los vehículos, muchos electrodomésticos, herramientas, tuberías y vías férreas.
Los metales son buenos conductores, lo que los hace valiosos en electrodomésticos y para transportar una corriente eléctrica a distancia con poca pérdida de energía. Las redes eléctricas se basan en cables metálicos para distribuir la electricidad. Los sistemas eléctricos domésticos, en su mayor parte, están cableados con alambre de cobre por sus buenas propiedades conductoras.
La conductividad térmica de los metales es útil para que los recipientes calienten materiales sobre una llama. Los metales también se utilizan para disipadores de calor para proteger equipos sensibles del sobrecalentamiento.
La alta reflectividad de algunos metales permite su uso en espejos, incluidos instrumentos astronómicos de precisión, y se suma a la estética de la joyería metálica.
Algunos metales tienen usos especializados; el mercurio es un líquido a temperatura ambiente y se usa en interruptores para completar un circuito cuando fluye sobre los contactos del interruptor. Los metales radiactivos como el uranio y el plutonio son combustible para las plantas de energía nuclear, que producen energía a través de la fisión nuclear. Las aleaciones con memoria de forma se utilizan para aplicaciones tales como tuberías, sujetadores y stents vasculares.
Los metales se pueden dopar con moléculas extrañas: orgánicas, inorgánicas, biológicas y poliméricas. Este dopaje conlleva al metal con nuevas propiedades que son inducidas por las moléculas huésped. Se han desarrollado aplicaciones en catálisis, medicina, celdas electroquímicas, corrosión y más.
Reciclaje
La demanda de metales está estrechamente relacionada con el crecimiento económico dado su uso en infraestructura, construcción, manufactura y bienes de consumo. Durante el siglo XX, la variedad de metales utilizados en la sociedad creció rápidamente. Hoy, el desarrollo de las principales naciones, como China e India, y los avances tecnológicos están alimentando una demanda cada vez mayor. El resultado es que las actividades mineras se están expandiendo, y cada vez más las existencias de metales del mundo están en uso sobre la superficie, en lugar de debajo de la tierra como reservas no utilizadas. Un ejemplo es el stock de cobre en uso. Entre 1932 y 1999, el uso de cobre en los EE. UU. aumentó de 73 ga 238 g por persona.
Los metales son inherentemente reciclables, por lo que, en principio, se pueden usar una y otra vez, minimizando estos impactos ambientales negativos y ahorrando energía. Por ejemplo, el 95 % de la energía utilizada para fabricar aluminio a partir del mineral de bauxita se ahorra mediante el uso de material reciclado.
A nivel mundial, el reciclaje de metales es generalmente bajo. En 2010, el Panel Internacional de Recursos, organizado por el Programa de las Naciones Unidas para el Medio Ambiente, publicó informes sobre las existencias de metales que existen en la sociedad y sus tasas de reciclaje. Los autores del informe observaron que las existencias de metales en la sociedad pueden servir como enormes minas sobre el suelo. Advirtieron que las tasas de reciclaje de algunos metales raros utilizados en aplicaciones como teléfonos móviles, paquetes de baterías para automóviles híbridos y celdas de combustible son tan bajas que, a menos que se aumenten drásticamente las futuras tasas de reciclaje al final de su vida útil, estos metales críticos no estarán disponibles para uso en la tecnología moderna.
Interacciones biológicas
Se ha revisado el papel de los elementos metálicos en la evolución de la bioquímica celular, incluida una sección detallada sobre el papel del calcio en las enzimas redox.
Uno o más de los elementos hierro, cobalto, níquel, cobre y zinc son esenciales para todas las formas superiores de vida. El molibdeno es un componente esencial de la vitamina B12. Los compuestos de todos los demás elementos de transición y elementos posteriores a la transición son tóxicos en mayor o menor medida, con pocas excepciones, como ciertos compuestos de antimonio y estaño. Las fuentes potenciales de envenenamiento por metales incluyen la minería, los relaves, los desechos industriales, la escorrentía agrícola, la exposición ocupacional, las pinturas y la madera tratada.
Historia
Prehistoria
El cobre, que se presenta en forma nativa, puede haber sido el primer metal descubierto dada su apariencia distintiva, pesadez y maleabilidad en comparación con otras piedras o guijarros. El oro, la plata y el hierro (como hierro meteórico) y el plomo también se descubrieron en la prehistoria. Las formas de latón, una aleación de cobre y zinc fabricada fundiendo simultáneamente los minerales de estos metales, se originan en este período (aunque el zinc puro no se aisló hasta el siglo XIII). La maleabilidad de los metales sólidos condujo a los primeros intentos de fabricar adornos, herramientas y armas de metal. El hierro meteórico que contenía níquel se descubrió de vez en cuando y, en algunos aspectos, era superior a cualquier acero industrial fabricado hasta la década de 1880, cuando los aceros aleados se hicieron prominentes.
 Cobre nativo
Cobre nativo cristales de oro
cristales de oro Plata cristalina
Plata cristalina Una rebanada de hierro meteórico
Una rebanada de hierro meteórico nódulos de plomo oxidado y cubode 1 cm
nódulos de plomo oxidado y cubode 1 cm Una pesa de latón (35 g)
Una pesa de latón (35 g)
Antigüedad
El descubrimiento del bronce (una aleación de cobre con arsénico o estaño) permitió a las personas crear objetos de metal que eran más duros y duraderos de lo que era posible anteriormente. Las herramientas, armas, armaduras y materiales de construcción de bronce, como los azulejos decorativos, eran más duros y duraderos que sus predecesores de piedra y cobre ("Calcolítico"). Inicialmente, el bronce estaba hecho de cobre y arsénico (formando bronce de arsénico) mediante la fundición de minerales de cobre y arsénico mezclados de forma natural o artificial. Los primeros artefactos conocidos hasta ahora provienen de la meseta iraní en el quinto milenio a. Solo más tarde se utilizó el estaño, que se convirtió en el principal ingrediente del bronce sin cobre a finales del tercer milenio a. El estaño puro en sí mismo fue aislado por primera vez en 1800 a. C. por trabajadores metalúrgicos chinos y japoneses.
Mercurio era conocido por los antiguos chinos e indios antes del 2000 a. C., y se encontró en tumbas egipcias que datan del 1500 a.
La producción de acero más antigua conocida, una aleación de hierro y carbono, se ve en piezas de artículos de hierro excavados en un sitio arqueológico en Anatolia (Kaman-Kalehöyük) y tienen casi 4000 años de antigüedad, datan del 1800 a.
Aproximadamente desde el año 500 a. C., los fabricantes de espadas de Toledo, España, fabricaban formas tempranas de aleación de acero agregando un mineral llamado wolframita, que contenía tungsteno y manganeso, al mineral de hierro (y carbono). El acero de Toledo resultante llamó la atención de Roma cuando lo usó Aníbal en las Guerras Púnicas. Pronto se convirtió en la base del armamento de las legiones romanas; se decía que sus espadas eran "tan afiladas que no hay yelmo que no puedan atravesar".
En la América precolombina, los objetos hechos de tumbaga, una aleación de cobre y oro, comenzaron a producirse en Panamá y Costa Rica entre los años 300 y 500 d.C. Las pequeñas esculturas de metal eran comunes y una amplia gama de adornos de tumbaga (y oro) componían las insignias habituales de las personas de alto estatus.
Aproximadamente al mismo tiempo, los indígenas ecuatorianos combinaban oro con una aleación de platino natural que contenía pequeñas cantidades de paladio, rodio e iridio, para producir miniaturas y máscaras compuestas de una aleación de oro blanco y platino. Los trabajadores metalúrgicos involucraron oro calentado con granos de la aleación de platino hasta que el oro se derritió, momento en el cual los metales del grupo del platino se unieron dentro del oro. Después de enfriar, el conglomerado resultante se martilló y recalentó repetidamente hasta que se volvió tan homogéneo como si todos los metales en cuestión se hubieran fundido juntos (alcanzar los puntos de fusión de los metales del grupo del platino en cuestión estaba más allá de la tecnología de la época).
 Una gota de estaño fundido solidificado
Una gota de estaño fundido solidificado Se vierte mercurioen una placa de Petri
Se vierte mercurioen una placa de Petri El electrum, una aleación natural de plata y oro, se usaba a menudo para fabricar monedas. Se muestra el dios romano Apolo y, en el anverso, un trípode de Delfos (circa 310-305 a. C.).
El electrum, una aleación natural de plata y oro, se usaba a menudo para fabricar monedas. Se muestra el dios romano Apolo y, en el anverso, un trípode de Delfos (circa 310-305 a. C.). Una placa hecha de peltre, una aleación de 85 a 99% de estaño y (generalmente) cobre. El peltre se utilizó por primera vez a principios de la Edad del Bronce en el Cercano Oriente.
Una placa hecha de peltre, una aleación de 85 a 99% de estaño y (generalmente) cobre. El peltre se utilizó por primera vez a principios de la Edad del Bronce en el Cercano Oriente. Un pectoral (peto ornamental) hecho de tumbaga, una aleación de oro y cobre.
Un pectoral (peto ornamental) hecho de tumbaga, una aleación de oro y cobre.
Edad media
El oro es para la señora, la plata para la doncella, el
cobre para el artesano hábil en su oficio.
"¡Bueno!" dijo el Barón, sentado en su salón,
"Pero el Hierro, el Hierro Frío, es el amo de todos ellos".
de Cold Iron de Rudyard Kipling
Los alquimistas árabes y medievales creían que todos los metales y la materia estaban compuestos por el principio del azufre, el padre de todos los metales y portador de la propiedad combustible, y el principio del mercurio, la madre de todos los metales y portador de la liquidez, la fusibilidad y la volatilidad. propiedades. Estos principios no eran necesariamente las sustancias comunes de azufre y mercurio que se encuentran en la mayoría de los laboratorios. Esta teoría reforzaba la creencia de que todos los metales estaban destinados a convertirse en oro en las entrañas de la tierra mediante las combinaciones adecuadas de calor, digestión, tiempo y eliminación de contaminantes, todo lo cual podía desarrollarse y acelerarse mediante el conocimiento y los métodos de la alquimia..
Se conocieron el arsénico, el zinc, el antimonio y el bismuto, aunque en un principio se los llamó semimetales o metales bastardos por su inmaleabilidad. Los cuatro pueden haber sido utilizados incidentalmente en épocas anteriores sin reconocer su naturaleza. Se cree que Albertus Magnus fue el primero en aislar el arsénico de un compuesto en 1250, calentando jabón junto con trisulfuro de arsénico. El zinc metálico, que es quebradizo si está impuro, se aisló en la India en el año 1300 d.C. La primera descripción de un procedimiento para aislar antimonio se encuentra en el libro de 1540 De la pirotechnia de Vannoccio Biringuccio. El bismuto fue descrito por Agricola en De Natura Fossilium (c. 1546); se había confundido en los primeros tiempos con el estaño y el plomo por su parecido con esos elementos.
 Arsénico, sellado en un recipiente para evitar el deslustre
Arsénico, sellado en un recipiente para evitar el deslustre Fragmentos de zinc y un cubo de 1 cm.
Fragmentos de zinc y un cubo de 1 cm. Antimonio, mostrando su brillo brillante
Antimonio, mostrando su brillo brillante Bismuto en forma cristalina, con una capa de oxidación muy fina, y un cubo de bismuto de 1 cm.
Bismuto en forma cristalina, con una capa de oxidación muy fina, y un cubo de bismuto de 1 cm.
El Renacimiento
El primer texto sistemático sobre las artes de la minería y la metalurgia fue De la Pirotechnia (1540) de Vannoccio Biringuccio, que trata sobre el examen, la fusión y el trabajo de los metales.
Dieciséis años después, Georgius Agricola publicó De Re Metallica en 1556, un relato claro y completo de la profesión de la minería, la metalurgia y las artes y ciencias accesorias, además de calificarse como el mayor tratado sobre la industria química durante el siglo XVI.
Dio la siguiente descripción de un metal en su De Natura Fossilium (1546):
El metal es un cuerpo mineral, por naturaleza líquido o algo duro. Este último puede derretirse por el calor del fuego, pero cuando se ha enfriado nuevamente y ha perdido todo el calor, se endurece nuevamente y recupera su forma adecuada. En este aspecto se diferencia de la piedra que se derrite en el fuego, pues aunque esta recupera su dureza, pierde su forma y propiedades prístinas.
Tradicionalmente hay seis tipos diferentes de metales, a saber, oro, plata, cobre, hierro, estaño y plomo. Hay realmente otros, porque el mercurio es un metal, aunque los alquimistas no están de acuerdo con nosotros en este asunto, y el bismuto también lo es. Los antiguos escritores griegos parecen haber ignorado el bismuto, por lo que Amonio afirma con razón que hay muchas especies de metales, animales y plantas que nos son desconocidas. El estibio, cuando se funde en el crisol y se refina, tiene tanto derecho a ser considerado como un metal propio como el que los escritores conceden al plomo. Si al fundirse se le añade cierta parte al estaño, se hace una aleación de librero de la que se hace el tipo que usan los que imprimen libros en papel.
Cada metal tiene su propia forma que conserva cuando se separa de los metales que se mezclaron con él. Por lo tanto, ni el electrum ni el estaño [no se refiere a nuestro estaño] son en sí mismos un metal real, sino más bien una aleación de dos metales. Electrum es una aleación de oro y plata, Stannum de plomo y plata. Y sin embargo, si la plata se separa del electrum, entonces queda el oro y no el electrum; si se le quita plata a Stannum, queda plomo y no Stannum.
Sin embargo, si el latón se encuentra como un metal nativo o no, no se puede determinar con certeza. Solo conocemos el latón artificial, que consiste en cobre teñido con el color del mineral calamina. Y, sin embargo, si se desenterrara alguno, sería un metal adecuado. El cobre blanco y negro parece ser diferente del tipo rojo.
El metal, por lo tanto, es por naturaleza sólido, como he dicho, o fluido, como en el caso único del mercurio.
Pero basta ya de los tipos simples.
El platino, el tercer metal precioso después del oro y la plata, fue descubierto en Ecuador durante el período 1736 a 1744, por el astrónomo español Antonio de Ulloa y su colega el matemático Jorge Juan y Santacilia. Ulloa fue el primero en escribir una descripción científica del metal, en 1748.
En 1789, el químico alemán Martin Heinrich Klaproth aisló un óxido de uranio, que pensó que era el metal mismo. Klaproth fue posteriormente acreditado como el descubridor de uranio. No fue hasta 1841, que el químico francés Eugène-Melchior Péligot, preparó la primera muestra de uranio metálico. Henri Becquerel descubrió posteriormente la radiactividad en 1896 mediante el uso de uranio.
En la década de 1790, Joseph Priestley y el químico holandés Martinus van Marum observaron la acción transformadora de las superficies metálicas en la deshidrogenación del alcohol, un desarrollo que posteriormente condujo, en 1831, a la síntesis a escala industrial de ácido sulfúrico utilizando un catalizador de platino.
En 1803, el cerio fue el primero de los metales lantánidos en ser descubierto, en Bastnäs, Suecia por Jöns Jakob Berzelius y Wilhelm Hisinger, e independientemente por Martin Heinrich Klaproth en Alemania. Los metales lantánidos se consideraban en gran medida como rarezas hasta la década de 1960, cuando se desarrollaron métodos para separarlos de manera más eficiente. Posteriormente, han encontrado usos en teléfonos celulares, imanes, láseres, iluminación, baterías, convertidores catalíticos y en otras aplicaciones que permiten tecnologías modernas.
Otros metales descubiertos y preparados durante este tiempo fueron cobalto, níquel, manganeso, molibdeno, tungsteno y cromo; y algunos de los metales del grupo del platino, paladio, osmio, iridio y rodio.
Metales ligeros
Todos los metales descubiertos hasta 1809 tenían densidades relativamente altas; su pesadez se consideraba un criterio singularmente distintivo. A partir de 1809 se aislaron metales ligeros como el sodio, el potasio y el estroncio. Sus bajas densidades desafiaron la sabiduría convencional en cuanto a la naturaleza de los metales. Sin embargo, se comportaron químicamente como metales y posteriormente fueron reconocidos como tales.
El aluminio se descubrió en 1824 pero no fue hasta 1886 que se desarrolló un método de producción industrial a gran escala. Los precios del aluminio cayeron y el aluminio se volvió ampliamente utilizado en joyería, artículos cotidianos, marcos de anteojos, instrumentos ópticos, vajillas y láminas en la década de 1890 y principios del siglo XX. La capacidad del aluminio para formar aleaciones duras pero ligeras con otros metales proporcionó al metal muchos usos en ese momento. Durante la Primera Guerra Mundial, los principales gobiernos exigieron grandes envíos de aluminio para fuselajes ligeros y resistentes. El metal más común en uso para la transmisión de energía eléctrica en la actualidad es el conductor de aluminio reforzado con acero. También se ve mucho uso el conductor de aleación de aluminio. El aluminio se usa porque tiene aproximadamente la mitad del peso de un cable de cobre de resistencia comparable (aunque de mayor diámetro debido a una conductividad específica más baja), además de ser más barato. El cobre era más popular en el pasado y todavía se usa, especialmente a voltajes más bajos y para conexión a tierra.
Si bien el titanio metálico puro (99,9 %) se preparó por primera vez en 1910, no se usó fuera del laboratorio hasta 1932. En las décadas de 1950 y 1960, la Unión Soviética fue pionera en el uso de titanio en aplicaciones militares y submarinas como parte de programas relacionados con el Frío. Guerra. A principios de la década de 1950, el titanio comenzó a usarse ampliamente en la aviación militar, particularmente en aviones a reacción de alto rendimiento, comenzando con aviones como el F-100 Super Sabre y Lockheed A-12 y SR-71.
El escandio metálico se produjo por primera vez en 1937. La primera libra de escandio metálico con una pureza del 99 % se produjo en 1960. La producción de aleaciones de aluminio y escandio comenzó en 1971 tras una patente estadounidense. Las aleaciones de aluminio y escandio también se desarrollaron en la URSS.
 Sodio
Sodio Perlas de potasio bajo aceite de parafina. El tamaño de la perla más grande es de 0,5 cm.
Perlas de potasio bajo aceite de parafina. El tamaño de la perla más grande es de 0,5 cm. cristales de estroncio
cristales de estroncio Trozo de aluminio,2,6 gramos, 1 x 2 cm
Trozo de aluminio,2,6 gramos, 1 x 2 cmUna barra de cristales de titanio.
 Escandio, incluido un cubo de 1 cm.
Escandio, incluido un cubo de 1 cm.
La era del acero
La era moderna en la fabricación de acero comenzó con la introducción del proceso Bessemer de Henry Bessemer en 1855, cuya materia prima era el arrabio. Su método le permitió producir acero en grandes cantidades a bajo precio, por lo que el acero dulce se utilizó para la mayoría de los fines para los que anteriormente se usaba el hierro forjado. El proceso Gilchrist-Thomas (o proceso Bessemer básico ) fue una mejora del proceso Bessemer, realizado recubriendo el convertidor con un material básico para eliminar el fósforo.
Debido a su alta resistencia a la tracción y bajo costo, el acero se convirtió en un componente principal utilizado en edificios, infraestructura, herramientas, barcos, automóviles, máquinas, electrodomésticos y armas.
En 1872, los ingleses Clark y Woods patentaron una aleación que hoy sería considerada acero inoxidable. La resistencia a la corrosión de las aleaciones de hierro y cromo había sido reconocida en 1821 por el metalúrgico francés Pierre Berthier. Señaló su resistencia al ataque de algunos ácidos y sugirió su uso en cuchillería. Los metalúrgicos del siglo XIX no pudieron producir la combinación de bajo contenido de carbono y alto contenido de cromo que se encuentra en la mayoría de los aceros inoxidables modernos, y las aleaciones con alto contenido de cromo que podían producir eran demasiado frágiles para ser prácticas. No fue hasta 1912 que se produjo la industrialización de las aleaciones de acero inoxidable en Inglaterra, Alemania y Estados Unidos.
Los últimos elementos metálicos estables
Para 1900 quedaban por descubrir tres metales con números atómicos menores que el plomo (#82), el metal estable más pesado: los elementos 71, 72, 75.
Von Welsbach, en 1906, demostró que el antiguo iterbio también contenía un nuevo elemento (#71), al que denominó casiopeio. Urbain probó esto simultáneamente, pero sus muestras eran muy impuras y solo contenían trazas del nuevo elemento. A pesar de esto, se adoptó su nombre elegido, lutecio.
En 1908, Ogawa encontró el elemento 75 en la torianita, pero lo asignó como elemento 43 en lugar de 75 y lo denominó nipponio. En 1925, Walter Noddack, Ida Eva Tacke y Otto Berg anunciaron su separación de la gadolinita y le dieron el nombre actual, renio.
Georges Urbain afirmó haber encontrado el elemento 72 en residuos de tierras raras, mientras que Vladimir Vernadsky lo encontró de forma independiente en ortita. Ninguno de los reclamos se confirmó debido a la Primera Guerra Mundial, y tampoco se pudo confirmar más tarde, ya que la química que informaron no coincide con la que ahora se conoce para el hafnio. Después de la guerra, en 1922, Coster y Hevesy lo encontraron mediante análisis espectroscópico de rayos X en circón noruego. El hafnio fue, por tanto, el último elemento estable que se descubrió.
 Lutecio, incluido un cubo de 1 cm
Lutecio, incluido un cubo de 1 cm Renio, incluido un cubo de 1 cm
Renio, incluido un cubo de 1 cm Hafnio, en forma de barra de 1,7 kg
Hafnio, en forma de barra de 1,7 kg
Al final de la Segunda Guerra Mundial, los científicos habían sintetizado cuatro elementos posteriores al uranio, todos los cuales son metales radiactivos (inestables): neptunio (en 1940), plutonio (1940–41) y curio y americio (1944), que representan elementos 93 a 96. Los primeros dos de estos finalmente se encontraron también en la naturaleza. El curio y el americio fueron subproductos del proyecto Manhattan, que produjo la primera bomba atómica del mundo en 1945. La bomba se basó en la fisión nuclear del uranio, un metal que se pensó que se había descubierto por primera vez casi 150 años antes.
Desarrollos posteriores a la Segunda Guerra Mundial
Superaleaciones
Las superaleaciones compuestas de combinaciones de Fe, Ni, Co y Cr, y cantidades menores de W, Mo, Ta, Nb, Ti y Al se desarrollaron poco después de la Segunda Guerra Mundial para su uso en motores de alto rendimiento, operando a temperaturas elevadas (por encima de 650 °C (1200 °F)). Conservan la mayor parte de su resistencia en estas condiciones, durante períodos prolongados, y combinan una buena ductilidad a baja temperatura con resistencia a la corrosión o la oxidación. Las superaleaciones ahora se pueden encontrar en una amplia gama de aplicaciones, incluidas turbinas terrestres, marítimas y aeroespaciales, y plantas químicas y petroleras.
Metales de transcurio
El desarrollo exitoso de la bomba atómica al final de la Segunda Guerra Mundial provocó nuevos esfuerzos para sintetizar nuevos elementos, casi todos los cuales son, o se espera que sean, metales, y todos son radiactivos. No fue sino hasta 1949 que el elemento 97 (berkelio), siguiente al elemento 96 (curio), se sintetizó disparando partículas alfa a un objetivo de americio. En 1952, se encontró el elemento 100 (fermio) entre los escombros de la primera explosión de una bomba de hidrógeno; el hidrógeno, un no metal, había sido identificado como un elemento casi 200 años antes. Desde 1952, se han sintetizado los elementos 101 (mendelevio) a 118 (oganesón).
Vasos metalizados a granel
Un vidrio metálico (también conocido como metal amorfo o vítreo) es un material metálico sólido, generalmente una aleación, con una estructura atómica desordenada. La mayoría de los metales puros y aleados, en su estado sólido, tienen átomos dispuestos en una estructura cristalina altamente ordenada. Los metales amorfos tienen una estructura similar al vidrio no cristalino. Pero a diferencia de los vidrios comunes, como el vidrio de una ventana, que suelen ser aislantes eléctricos, los metales amorfos tienen una buena conductividad eléctrica. Los metales amorfos se producen de varias maneras, incluido el enfriamiento extremadamente rápido, la deposición física de vapor, la reacción de estado sólido, la irradiación de iones y la aleación mecánica. El primer vidrio metálico reportado fue una aleación (Au 75 Si 25) producido en Caltech en 1960. Más recientemente, se han producido lotes de acero amorfo con tres veces la resistencia de las aleaciones de acero convencionales. Actualmente, las aplicaciones más importantes se basan en las propiedades magnéticas especiales de algunos vidrios metálicos ferromagnéticos. La baja pérdida de magnetización se utiliza en transformadores de alta eficiencia. Las etiquetas de identificación de control de robo y otros esquemas de vigilancia de artículos a menudo usan vidrios metálicos debido a estas propiedades magnéticas.
Aleaciones con memoria de forma
Una aleación con memoria de forma (SMA) es una aleación que "recuerda" su forma original y, cuando se deforma, vuelve a su forma predeformada cuando se calienta. Si bien el efecto de memoria de forma se observó por primera vez en 1932, en una aleación de Au-Cd, no fue sino hasta 1962, con el descubrimiento accidental del efecto en una aleación de Ni-Ti, que comenzó la investigación en serio, y otros diez años antes de que se comercializara. surgieron aplicaciones. Los SMA tienen aplicaciones en las industrias robótica y automotriz, aeroespacial y biomédica. Hay otro tipo de SMA, llamado aleación ferromagnética con memoria de forma (FSMA), que cambia de forma bajo fuertes campos magnéticos. Estos materiales son de particular interés ya que la respuesta magnética tiende a ser más rápida y eficiente que las respuestas inducidas por la temperatura.
Aleaciones cuasicristalinas
En 1984, el químico israelí Dan Shechtman encontró una aleación de aluminio y manganeso que tenía una simetría quíntuple, en violación de la convención cristalográfica en ese momento que decía que las estructuras cristalinas solo podían tener una simetría de dos, tres, cuatro o seis veces. Por temor a la reacción de la comunidad científica, tardó dos años en publicar los resultados por los que recibió el Premio Nobel de Química en 2011. Desde entonces, se han reportado y confirmado cientos de cuasicristales. Existen en muchas aleaciones metálicas (y algunos polímeros). Los cuasicristales se encuentran con mayor frecuencia en aleaciones de aluminio (Al-Li-Cu, Al-Mn-Si, Al-Ni-Co, Al-Pd-Mn, Al-Cu-Fe, Al-Cu-V, etc.), pero también se conocen otras numerosas composiciones (Cd-Yb, Ti-Zr-Ni, Zn-Mg-Ho, Zn-Mg-Sc, In-Ag-Yb, Pd-U-Si, etc.). Los cuasicristales tienen efectivamente celdas unitarias infinitamente grandes. Icosaedrita Al63 Cu 24 Fe 13, el primer cuasicristal encontrado en la naturaleza, fue descubierto en 2009. La mayoría de los cuasicristales tienen propiedades similares a las de la cerámica, incluida una baja conductividad eléctrica (valores que se acercan a los de los aisladores) y baja conductividad térmica, alta dureza, fragilidad y resistencia a la corrosión, y antiadherencia. propiedades. Los cuasicristales se han utilizado para desarrollar aislamiento térmico, LED, motores diésel y nuevos materiales que convierten el calor en electricidad. Las nuevas aplicaciones pueden aprovechar el bajo coeficiente de fricción y la dureza de algunos materiales cuasicristalinos, por ejemplo, incrustando partículas en plástico para fabricar engranajes de plástico fuertes, resistentes y de baja fricción. Otras aplicaciones potenciales incluyen absorbentes solares selectivos para la conversión de energía, reflectores de longitud de onda ancha y aplicaciones de prótesis y reparación ósea donde la biocompatibilidad, la baja fricción,
Aleaciones metálicas complejas
Las aleaciones metálicas complejas (CMA) son compuestos intermetálicos caracterizados por grandes celdas unitarias que comprenden desde decenas hasta miles de átomos; la presencia de grupos de átomos bien definidos (frecuentemente con simetría icosaédrica); y desorden parcial dentro de sus redes cristalinas. Están compuestos por dos o más elementos metálicos, a veces con metaloides o calcogenuros añadidos. Incluyen, por ejemplo, NaCd2, con 348 átomos de sodio y 768 átomos de cadmio en la celda unitaria. Linus Pauling intentó describir la estructura de NaCd 2 en 1923, pero no tuvo éxito hasta 1955. Al principio llamados "cristales de celdas unitarias gigantes", el interés en los CMA, como se los llamó, no repuntó hasta 2002, con el publicación de un artículo llamado "Fases de aleación estructuralmente complejas", dado en elVIII Congreso Internacional de Cuasicristales. Las aplicaciones potenciales de los CMA incluyen aislamiento térmico; calefacción solar; refrigeradores magnéticos; utilizar el calor residual para generar electricidad; y revestimientos para álabes de turbinas en motores militares.
Aleaciones de alta entropía
Las aleaciones de alta entropía (HEA) como AlLiMgScTi se componen de cantidades iguales o casi iguales de cinco o más metales. En comparación con las aleaciones convencionales con solo uno o dos metales base, los HEA tienen una relación resistencia-peso considerablemente mejor, mayor resistencia a la tracción y mayor resistencia a la fractura, la corrosión y la oxidación. Aunque los HEA se describieron ya en 1981, no se desarrolló un interés significativo hasta la década de 2010; continúan siendo el foco de la investigación en ciencia e ingeniería de materiales debido a su potencial para propiedades deseables.
Aleaciones de fase MAX
| MÁX. | METRO | UN | X |
|---|---|---|---|
| Hf 2 SnC | H.f. | sn | C |
| Ti4AlN3 _ _ _ | ti | Alabama | norte |
| Ti 3 SiC 2 | ti | Si | C |
| Ti2AlC _ _ | ti | Alabama | C |
| Cr 2 AlC 2 | cr | Alabama | C |
| Ti 3 AlC 2 | ti | Alabama | C |
En una aleación de fase MAX, M es un metal de transición temprana, A es un elemento del grupo A (principalmente grupo IIIA y IVA, o grupos 13 y 14), y X es carbono o nitrógeno. Los ejemplos son Hf 2 SnC y Ti 4 AlN 3. Estas aleaciones tienen algunas de las mejores propiedades de los metales y las cerámicas. Estas propiedades incluyen alta conductividad eléctrica y térmica, resistencia al choque térmico, tolerancia al daño, maquinabilidad, alta rigidez elástica y bajos coeficientes de expansión térmica. </ref> Pueden pulirse hasta obtener un brillo metálico debido a sus excelentes conductividades eléctricas. Durante las pruebas mecánicas, se ha encontrado que el Ti 3 SiC 2 policristalinoLos cilindros pueden comprimirse repetidamente a temperatura ambiente, hasta tensiones de 1 GPa, y recuperarse por completo al retirar la carga. Algunas fases MAX también son muy resistentes al ataque químico (p. ej., Ti 3 SiC 2 ) ya la oxidación a alta temperatura en el aire (Ti 2 AlC, Cr 2 AlC 2 y Ti 3 AlC 2 ). Las aplicaciones potenciales para las aleaciones de la fase MAX incluyen: como refractarios duros, maquinables y resistentes al choque térmico; elementos calefactores de alta temperatura; revestimientos para contactos eléctricos; y piezas resistentes a la radiación de neutrones para aplicaciones nucleares. Si bien las aleaciones de fase MAX se descubrieron en la década de 1960, el primer artículo sobre el tema no se publicó hasta 1996.
Contenido relacionado
Gardena, California
Geoquímica
Titanita