Melanoma
El melanoma, también conocido redundantemente como melanoma maligno, es un tipo de cáncer de piel que se desarrolla a partir de las células productoras de pigmento conocidas como melanocitos. Los melanomas generalmente ocurren en la piel, pero rara vez pueden ocurrir en la boca, los intestinos o los ojos (melanoma uveal). En las mujeres, ocurren con mayor frecuencia en las piernas, mientras que en los hombres, ocurren con mayor frecuencia en la espalda. Alrededor del 25% de los melanomas se desarrollan a partir de lunares. Los cambios en un lunar que pueden indicar melanoma incluyen un aumento de tamaño, bordes irregulares, cambio de color, picazón o ruptura de la piel.
La causa principal del melanoma es la exposición a la luz ultravioleta (UV) en personas con niveles bajos del pigmento melanina de la piel. La luz ultravioleta puede provenir del sol o de otras fuentes, como dispositivos de bronceado. Las personas con muchos lunares, un historial de familiares afectados y una función inmunológica deficiente corren un mayor riesgo. Varias condiciones genéticas raras, como el xeroderma pigmentoso, también aumentan el riesgo. El diagnóstico se realiza mediante biopsia y análisis de cualquier lesión cutánea que presente signos de ser potencialmente cancerosa.
Usar protector solar y evitar la luz ultravioleta puede prevenir el melanoma. El tratamiento suele ser la extirpación mediante cirugía. En aquellos con cánceres un poco más grandes, se pueden analizar los ganglios linfáticos cercanos para detectar diseminación (metástasis). La mayoría de las personas se curan si no se ha producido la propagación. Para aquellos en quienes el melanoma se ha propagado, la inmunoterapia, la terapia biológica, la radioterapia o la quimioterapia pueden mejorar la supervivencia. Con tratamiento, las tasas de supervivencia a cinco años en los Estados Unidos son del 99 % entre las personas con enfermedad localizada, del 65 % cuando la enfermedad se ha diseminado a los ganglios linfáticos y del 25 % entre las personas con diseminación a distancia. La probabilidad de que el melanoma vuelva a aparecer o se propague depende de su grosor, de la rapidez con la que se dividen las células y de si la piel que las recubre se ha roto o no.
El melanoma es el tipo de cáncer de piel más peligroso. A nivel mundial, en 2012, se produjo de nuevo en 232.000 personas. En 2015, 3,1 millones de personas tenían la enfermedad activa, lo que resultó en 59.800 muertes. Australia y Nueva Zelanda tienen las tasas más altas de melanoma en el mundo. Las tasas altas también ocurren en el norte de Europa y América del Norte, mientras que es menos común en Asia, África y América Latina. En los Estados Unidos, el melanoma ocurre aproximadamente 1,6 veces más en los hombres que en las mujeres. El melanoma se ha vuelto más común desde la década de 1960 en áreas pobladas principalmente por personas de ascendencia europea.
Signos y síntomas
Los primeros signos de melanoma son cambios en la forma o el color de los lunares existentes o, en el caso del melanoma nodular, la aparición de un nuevo bulto en cualquier parte de la piel. En etapas posteriores, el lunar puede picar, ulcerarse o sangrar. Los primeros signos de melanoma se resumen en el nemotécnico "ABCDEF":
- una simetría
- Órdenes B (irregular con bordes y esquinas)
- Color (variegado)
- D iámetro (más de 6 mm (0,24 pulgadas), aproximadamente del tamaño de un borrador de lápiz)
- Evolucionando con el tiempo
Esta clasificación no se aplica al melanoma nodular, que tiene sus propias clasificaciones:
- Elevado por encima de la superficie de la piel
- Firme al tacto
- creciendo _
El melanoma metastásico puede causar síntomas paraneoplásicos inespecíficos, como pérdida de apetito, náuseas, vómitos y fatiga. La metástasis (diseminación) del melanoma temprano es posible, pero relativamente rara; menos de una quinta parte de los melanomas diagnosticados a tiempo se vuelven metastásicos. Las metástasis cerebrales son particularmente comunes en pacientes con melanoma metastásico. También se puede propagar al hígado, los huesos, el abdomen o los ganglios linfáticos distantes.
Causa
Los melanomas generalmente son causados por daños en el ADN como resultado de la exposición a la luz ultravioleta del sol. La genética también juega un papel. El melanoma también puede ocurrir en áreas de la piel con poca exposición al sol (es decir, boca, plantas de los pies, palmas de las manos, áreas genitales). Las personas con síndrome de nevus displásico, también conocido como melanoma de lunares múltiples atípico familiar, tienen un mayor riesgo de desarrollar melanoma.
Tener más de 50 lunares indica un mayor riesgo de que surja un melanoma. Un sistema inmunitario debilitado facilita el desarrollo del cáncer debido a la capacidad debilitada del cuerpo para combatir las células cancerosas.
Radiación UV
La radiación ultravioleta de las camas de bronceado aumenta el riesgo de melanoma. La Agencia Internacional para la Investigación del Cáncer encuentra que las camas de bronceado son "cancerígenas para los humanos" y que las personas que comienzan a usar dispositivos de bronceado antes de los treinta años tienen un 75% más de probabilidades de desarrollar melanoma.
Aquellos que trabajan en aviones también parecen tener un mayor riesgo, que se cree que se debe a una mayor exposición a los rayos UV.
La luz UVB (longitudes de onda entre 315 y 280 nm) del sol es absorbida por el ADN de las células de la piel y provoca un tipo de daño directo en el ADN llamado dímeros de ciclobutano y pirimidina. Los dímeros timina-timina, citosina-citosina o citosina-timina se forman por la unión de dos bases de pirimidina adyacentes dentro de una hebra de ADN. De manera algo similar a los rayos UVB, la luz UVA (longitudes de onda más largas entre 400 y 315 nm) del sol o de las camas de bronceado también puede ser absorbida directamente por el ADN de la piel (alrededor de 1/100 a 1/1000 de la eficiencia de los rayos UVB).
La exposición a la radiación (UVA y UVB) es uno de los principales contribuyentes al desarrollo del melanoma. La exposición solar extrema ocasional (que da como resultado "quemaduras solares") está causalmente relacionada con el melanoma. El melanoma es más común en la espalda de los hombres y en las piernas de las mujeres (áreas de exposición solar intermitente). El riesgo parece estar fuertemente influenciado por las condiciones socioeconómicas más que por las ocupaciones en interiores versus al aire libre; es más común en trabajadores profesionales y administrativos que en trabajadores no calificados. Otros factores son mutaciones o pérdida total de genes supresores de tumores. El uso de camas solares (con rayos UVA de penetración profunda) se ha relacionado con el desarrollo de cánceres de piel, incluido el melanoma.
Los posibles elementos significativos para determinar el riesgo incluyen la intensidad y la duración de la exposición al sol, la edad a la que se produce la exposición al sol y el grado de pigmentación de la piel. Las tasas de melanoma tienden a ser más altas en los países asentados por inmigrantes del norte de Europa que tienen una gran cantidad de luz solar directa e intensa a la que la piel de los colonos no está adaptada, sobre todo Australia. La exposición durante la niñez es un factor de riesgo más importante que la exposición en la edad adulta. Esto se ve en los estudios de migración en Australia.
Tener múltiples quemaduras solares graves aumenta la probabilidad de que futuras quemaduras solares se conviertan en melanoma debido al daño acumulativo. El sol y las camas de bronceado son las principales fuentes de radiación ultravioleta que aumentan el riesgo de melanoma y vivir cerca del ecuador aumenta la exposición a la radiación ultravioleta.
Genética
Varias mutaciones raras, que a menudo son hereditarias, aumentan en gran medida la susceptibilidad al melanoma. Varios genes aumentan los riesgos. Algunos genes raros tienen un riesgo relativamente alto de causar melanoma; algunos genes más comunes, como un gen llamado MC1R que causa el cabello rojo, tienen un riesgo elevado relativamente menor. Las pruebas genéticas se pueden utilizar para buscar las mutaciones.
Una clase de mutaciones afecta al gen CDKN2A. Una mutación del marco de lectura alternativo en este gen conduce a la desestabilización de p53, un factor de transcripción implicado en la apoptosis y en el 50 % de los cánceres humanos. Otra mutación en el mismo gen da como resultado un inhibidor no funcional de CDK4, una cinasa dependiente de ciclina que promueve la división celular. Las mutaciones que causan la condición de la piel xeroderma pigmentosum (XP) también aumentan la susceptibilidad al melanoma. Dispersas por todo el genoma, estas mutaciones reducen la capacidad de una célula para reparar el ADN. Tanto las mutaciones de CDKN2A como las de XP son altamente penetrantes (las posibilidades de que un portador exprese el fenotipo son altas).
El melanoma familiar es genéticamente heterogéneo y los loci del melanoma familiar aparecen en los brazos cromosómicos 1p, 9p y 12q. Múltiples eventos genéticos se han relacionado con la patogénesis del melanoma (desarrollo de la enfermedad). El gen supresor de tumores múltiples 1 (CDKN2A/MTS1) codifica p16INK4a, una proteína inhibidora de bajo peso molecular de las proteínas quinasas dependientes de ciclina (CDK), que se ha localizado en la región p21 del cromosoma 9 humano. FAMMM se caracteriza típicamente por tener 50 o más lunares combinados además de antecedentes familiares de melanoma. Se transmite de forma autosómica dominante y se asocia principalmente con las mutaciones CDKN2A. Las personas que tienen la mutación CDKN2A asociada a FAMMM tienen un riesgo 38 veces mayor de cáncer de páncreas.
Otras mutaciones confieren menor riesgo, pero son más frecuentes en la población. Las personas con mutaciones en el gen MC1R tienen de dos a cuatro veces más probabilidades de desarrollar melanoma que aquellas con dos copias de tipo salvaje (tipo no afectado típico). Las mutaciones de MC1R son muy comunes y todas las personas pelirrojas tienen una copia mutada. La mutación del gen MDM2 SNP309 se asocia con mayores riesgos para las mujeres más jóvenes.
Las personas de cabello rubio y pelirrojo, las personas con múltiples nevos atípicos o nevos displásicos y las personas nacidas con nevos melanocíticos congénitos gigantes tienen un mayor riesgo.
Los antecedentes familiares de melanoma aumentan en gran medida el riesgo de una persona, porque se han encontrado mutaciones en varios genes en familias propensas al melanoma. Las personas con antecedentes de un melanoma tienen un mayor riesgo de desarrollar un segundo tumor primario.
La piel clara es el resultado de tener menos melanina en la piel, lo que significa que existe menos protección contra la radiación UV. Un historial familiar podría indicar una predisposición genética al melanoma.
Fisiopatología
La etapa más temprana del melanoma comienza cuando los melanocitos comienzan a crecer sin control. Los melanocitos se encuentran entre la capa externa de la piel (la epidermis) y la siguiente capa (la dermis). Esta etapa temprana de la enfermedad se denomina fase de crecimiento radial, cuando el tumor tiene menos de 1 mm de espesor y se disemina al nivel de la epidermis basal. Debido a que las células cancerosas aún no han llegado a los vasos sanguíneos más profundos de la piel, es muy poco probable que este melanoma en etapa temprana se propague a otras partes del cuerpo. Si el melanoma se detecta en esta etapa, generalmente se puede extirpar por completo con cirugía.
Cuando las células tumorales comienzan a moverse en una dirección diferente, verticalmente hacia la epidermis y hacia la dermis papilar, el comportamiento celular cambia drásticamente.
El siguiente paso en la evolución es la fase de crecimiento radial invasivo, en la que las células individuales comienzan a adquirir potencial invasivo. A partir de este momento, el melanoma es capaz de propagarse. La profundidad de la lesión de Breslow suele ser inferior a 1 mm (0,04 pulgadas), mientras que el nivel de Clark suele ser de 2.
La siguiente fase de crecimiento vertical (VGP) es el melanoma invasivo. El tumor puede crecer en el tejido circundante y puede diseminarse por el cuerpo a través de los vasos sanguíneos o linfáticos. El grosor del tumor suele ser de más de 1 mm (0,04 pulgadas) y el tumor afecta las partes más profundas de la dermis.
El huésped provoca una reacción inmunológica contra el tumor durante la VGP, que se juzga por la presencia y actividad de los linfocitos infiltrantes del tumor (TIL). Estas células a veces destruyen por completo el tumor primario; esto se llama regresión, que es la última etapa de desarrollo. En ciertos casos, el tumor primario se destruye por completo y solo se descubre el tumor metastásico. Alrededor del 40% de los melanomas humanos contienen mutaciones activadoras que afectan la estructura de la proteína B-Raf, lo que da como resultado una señalización constitutiva a través de la vía de la cinasa Raf a MAP.
Un insulto común a la mayoría de los cánceres es el daño al ADN. La luz UVA causa principalmente dímeros de timina. UVA también produce especies reactivas de oxígeno y estas infligen otros daños en el ADN, principalmente roturas de una sola hebra, pirimidinas oxidadas y la purina 8-oxoguanina oxidada (un cambio mutagénico en el ADN) a 1/10, 1/10 y 1/3 de las frecuencias de dímeros de timina inducidos por UVA, respectivamente.
Si no se reparan, los fotoproductos de CPD pueden provocar mutaciones debido a una síntesis de translesión inexacta durante la replicación o reparación del ADN. Las mutaciones más frecuentes debidas a una síntesis imprecisa más allá de los CPD son las mutaciones de transición de citosina a timina (C>T) o CC>TT. Estas se conocen comúnmente como mutaciones de huellas dactilares UV, ya que son la mutación más específica causada por los rayos UV y se encuentran con frecuencia en la piel expuesta al sol, pero rara vez se encuentran en los órganos internos. Los errores en la reparación del ADN de los fotoproductos UV, o la síntesis inexacta más allá de estos fotoproductos, también pueden provocar deleciones, inserciones y translocaciones cromosómicas.
Se secuenciaron los genomas completos de 25 melanomas. En promedio, se encontraron alrededor de 80 000 bases mutadas (principalmente transiciones C>T) y alrededor de 100 reordenamientos estructurales por genoma de melanoma. Esto es mucho más alto que las aproximadamente 70 mutaciones entre generaciones (de padre a hijo). Entre los 25 melanomas, alrededor de 6000 genes codificadores de proteínas tenían mutaciones sin sentido, sin sentido o en el sitio de empalme. También se han secuenciado y analizado los transcriptomas de más de 100 melanomas. Casi el 70% de todos los genes humanos que codifican proteínas se expresan en el melanoma. La mayoría de estos genes también se expresan en otros tejidos normales y cancerosos, con unos 200 genes que muestran un patrón de expresión más específico en el melanoma en comparación con otras formas de cáncer. Ejemplos de genes específicos de melanoma son tirosinasa, MLANA y PMEL.
La radiación ultravioleta causa daño al ADN de las células, típicamente dimerización de la timina, que cuando no se repara puede crear mutaciones en los genes de la célula. Este fuerte factor mutagénico hace que el melanoma cutáneo sea el tipo de tumor con mayor número de mutaciones. Cuando la célula se divide, estas mutaciones se propagan a nuevas generaciones de células. Si las mutaciones ocurren en protooncogenes o genes supresores de tumores, la tasa de mitosis en las células portadoras de mutaciones puede descontrolarse, lo que lleva a la formación de un tumor. Los datos de los pacientes sugieren que los niveles aberrantes del factor de transcripción activador en el núcleo de las células de melanoma están asociados con una mayor actividad metastásica de las células de melanoma; los estudios de ratones sobre el cáncer de piel tienden a confirmar un papel para activar el factor de transcripción 2 en la progresión del cáncer.
Las células madre cancerosas también pueden estar involucradas.
Mutaciones genéticas
Los estudios a gran escala, como The Cancer Genome Atlas, han caracterizado las alteraciones somáticas recurrentes que probablemente impulsan el inicio y el desarrollo del melanoma cutáneo.
La mutación más frecuente ocurre en el codón 600 de BRAF (50% de los casos). BRAF normalmente está involucrado en el crecimiento celular, y esta mutación específica hace que la proteína sea constitutivamente activa e independiente de la regulación fisiológica normal, fomentando así el crecimiento tumoral. Los genes RAS (NRAS, HRAS y KRAS) también están mutados de forma recurrente (30% de los casos de TCGA) y las mutaciones en los codones 61 o 12 desencadenan actividad oncogénica. Las mutaciones de pérdida de función a menudo afectan a genes supresores de tumores como NF1, TP53 y CDKN2A. Otras alteraciones oncogénicas incluyen fusiones que involucran varias quinasas como BRAF, RAF1, ALK, RET, ROS1, NTRK1., NTRK3 y MET BRAF, RAS y NF1las mutaciones y las fusiones de cinasas son notablemente excluyentes entre sí, ya que ocurren en diferentes subgrupos de pacientes. Por lo tanto, la evaluación del estado de la mutación puede mejorar la estratificación de los pacientes e informar la terapia dirigida con inhibidores específicos.
En algunos casos (3-7 %) las versiones mutadas de BRAF y NRAS experimentan una amplificación del número de copias.
Metástasis
La investigación realizada por el equipo de Sarna demostró que las células de melanoma muy pigmentadas tienen un módulo de Young de alrededor de 4,93, cuando en las no pigmentadas era de solo 0,98. En otro experimento encontraron que la elasticidad de las células de melanoma es importante para su metástasis y crecimiento: los tumores no pigmentados eran más grandes que los pigmentados y les era mucho más fácil propagarse. Demostraron que hay células pigmentadas y no pigmentadas en los tumores de melanoma, por lo que pueden ser resistentes a los medicamentos y metastásicos.
Diagnóstico
Mirar el área en cuestión es el método más común para sospechar un melanoma. Los lunares que son irregulares en color o forma generalmente se tratan como candidatos. Para detectar melanomas (y aumentar las tasas de supervivencia), se recomienda aprender a reconocerlos (consulte la regla mnemotécnica "ABCDE"), examinar regularmente los lunares en busca de cambios (forma, tamaño, color, picazón o sangrado) y consultar a un médico calificado cuando aparece un candidato.
Sin embargo, muchos melanomas se presentan como lesiones de menos de 6 mm de diámetro y todos los melanomas son malignos cuando aparecen por primera vez como un pequeño punto. Los médicos suelen examinar todos los lunares, incluidos los que tienen menos de 6 mm de diámetro. La queratosis seborreica puede cumplir algunos o todos los criterios ABCD y puede dar lugar a falsas alarmas. Los médicos generalmente pueden distinguir la queratosis seborreica del melanoma mediante un examen o con una dermatoscopia.
Algunos abogan por reemplazar "agrandando" con "en evolución": los lunares que cambian y evolucionan son una preocupación. Alternativamente, algunos practicantes prefieren "elevación". La elevación puede ayudar a identificar un melanoma, pero la falta de elevación no significa que la lesión no sea un melanoma. La mayoría de los melanomas en los EE. UU. se detectan antes de que se eleven. Para cuando la elevación sea visible, es posible que hayan progresado a la etapa invasiva más peligrosa.
La inspección en persona de lesiones cutáneas sospechosas es más precisa que la inspección visual de imágenes de lesiones cutáneas sospechosas. Cuando la utilizan especialistas capacitados, la dermatoscopia es más útil para identificar lesiones malignas que el uso exclusivo del ojo desnudo. La microscopía confocal de reflectancia puede tener mejor sensibilidad y especificidad que la dermatoscopia para diagnosticar el melanoma cutáneo, pero se necesitan más estudios para confirmar este resultado.
 Melanoma en biopsia de piel con tinción H&E: este caso puede representar un melanoma de extensión superficial.
Melanoma en biopsia de piel con tinción H&E: este caso puede representar un melanoma de extensión superficial. Ganglio linfático con reemplazo casi completo por melanoma metastásico. El pigmento marrón es un depósito focal de melanina.
Ganglio linfático con reemplazo casi completo por melanoma metastásico. El pigmento marrón es un depósito focal de melanina.un dermatoscopio
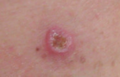 Melanoma maligno, muslo posterior derecho
Melanoma maligno, muslo posterior derecho Melanoma in situ, vértice del cuero cabelludo marcado para biopsia
Melanoma in situ, vértice del cuero cabelludo marcado para biopsia Melanoma maligno in situ, en evolución, clavícula derecha marcada para biopsia
Melanoma maligno in situ, en evolución, clavícula derecha marcada para biopsia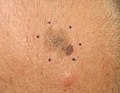 Melanoma maligno, vértice del cuero cabelludo marcado para biopsia
Melanoma maligno, vértice del cuero cabelludo marcado para biopsia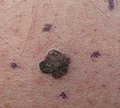 Melanoma maligno, muslo medial derecho marcado para biopsia
Melanoma maligno, muslo medial derecho marcado para biopsia Melanoma maligno, hombro posterior derecho marcado con un círculo para biopsia
Melanoma maligno, hombro posterior derecho marcado con un círculo para biopsia Melanoma maligno, antebrazo izquierdo marcado para biopsia
Melanoma maligno, antebrazo izquierdo marcado para biopsia Melanoma maligno antebrazo izquierdo post escisión con cierre en bolsa de tabaco
Melanoma maligno antebrazo izquierdo post escisión con cierre en bolsa de tabaco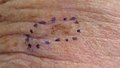 Melanoma in situ, frente derecha marcada para biopsia
Melanoma in situ, frente derecha marcada para biopsia Melanoma in situ, imagen dermatoscópica, frente derecha marcada para biopsia
Melanoma in situ, imagen dermatoscópica, frente derecha marcada para biopsia Melanoma maligno in situ, en evolución, sien medial derecha con hiperplasia sebácea adyacente, lateral
Melanoma maligno in situ, en evolución, sien medial derecha con hiperplasia sebácea adyacente, lateral Melanoma maligno in situ, hombro anterior izquierdo marcado para biopsia
Melanoma maligno in situ, hombro anterior izquierdo marcado para biopsia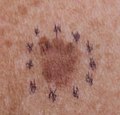 Melanoma maligno in situ, hombro anterior derecho marcado para biopsia
Melanoma maligno in situ, hombro anterior derecho marcado para biopsia Melanoma maligno in situ, parte superior interna del brazo izquierdo
Melanoma maligno in situ, parte superior interna del brazo izquierdo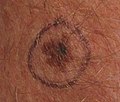 Melanoma maligno in situ marcado para biopsia, antebrazo izquierdo
Melanoma maligno in situ marcado para biopsia, antebrazo izquierdo Melanoma maligno in situ, parte medial superior derecha de la espalda, marcado para biopsia
Melanoma maligno in situ, parte medial superior derecha de la espalda, marcado para biopsia Melanoma maligno, cuero cabelludo frontal medio
Melanoma maligno, cuero cabelludo frontal medio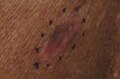 Melanoma maligno, parte media de la espalda izquierda marcada para biopsia
Melanoma maligno, parte media de la espalda izquierda marcada para biopsia Melanoma maligno, parte media de la espalda izquierda marcada para biopsia, a través de un dermatoscopio
Melanoma maligno, parte media de la espalda izquierda marcada para biopsia, a través de un dermatoscopio Patología macroscópica de metástasis de melanoma, que forma pigmentos en la gran mayoría de los casos, lo que le da un aspecto oscuro.
Patología macroscópica de metástasis de melanoma, que forma pigmentos en la gran mayoría de los casos, lo que le da un aspecto oscuro.
Patito feo
Un método es el "signo del patito feo". Se realiza la correlación de las características comunes de las lesiones. Las lesiones que se desvían de las características comunes se denominan "patito feo" y se requiere un examen profesional adicional. El letrero de "Caperucita Roja" sugiere que las personas con piel clara y cabello de color claro pueden tener melanomas amelanóticos difíciles de diagnosticar. Se requiere especial cuidado al examinar a tales individuos, ya que pueden tener múltiples melanomas y nevus severamente displásicos. Se debe usar un dermatoscopio para detectar "patitos feos", ya que muchos melanomas en estos individuos se parecen a los no melanomas o se consideran "lobos con piel de cordero".Estas personas de piel clara a menudo tienen melanomas ligeramente pigmentados o amelanóticos que no presentan cambios y variaciones de color fáciles de observar. Sus bordes a menudo son poco definidos, lo que complica la identificación visual sin un dermatoscopio.
Los melanomas amelanóticos y los melanomas que surgen en personas de piel clara son muy difíciles de detectar, ya que no muestran muchas de las características de la regla ABCD, rompen el signo del "patito feo" y son difíciles de distinguir de las cicatrices del acné, las picaduras de insectos, dermatofibromas o lentigos.
Biopsia
Después de un examen visual y un examen dermatoscópico, o herramientas de diagnóstico in vivo como un microscopio confocal, el médico puede realizar una biopsia del lunar sospechoso. A menudo se requiere una biopsia de piel realizada bajo anestesia local para ayudar a hacer o confirmar el diagnóstico y definir la gravedad. Las biopsias por escisión elíptica pueden extirpar el tumor, seguidas de un análisis histológico y una puntuación de Breslow. Las biopsias por incisión, como las biopsias con sacabocados, suelen estar contraindicadas cuando se sospechan melanomas, debido a la posibilidad de error de muestreo o de implantación local que provoque una estimación errónea del grosor del tumor. Sin embargo, los temores de que tales biopsias puedan aumentar el riesgo de enfermedad metastásica parecen infundados.
La fotografía de cuerpo completo, que implica la documentación fotográfica de la mayor superficie corporal posible, se utiliza a menudo durante el seguimiento de pacientes de alto riesgo. Se ha informado que la técnica permite la detección temprana y proporciona un enfoque rentable (con cualquier cámara digital), pero su eficacia ha sido cuestionada debido a su incapacidad para detectar cambios macroscópicos. El método de diagnóstico debe usarse junto con (y no como un reemplazo de) la imagenología dermatoscópica, con una combinación de ambos métodos que parece dar tasas de detección extremadamente altas.
Tipos histopatológicos
El melanoma es un tipo de neoplasia neuroectodérmica. Hay cuatro tipos principales de melanoma:
| Tipo | Características | Incidencia | Fotografía | Micrografía |
|---|---|---|---|---|
| Melanoma de extensión superficial | Células de melanoma con formación de nido a lo largo de la unión dermoepidérmica. | 70% |  |  |
| Melanoma nodular | Crece relativamente más en profundidad que en ancho. | 15% - 20% |  | 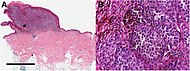 |
| Melanoma maligno léntigo | Propagación lineal de melanocitos epidérmicos atípicos, así como invasión de la dermis. | 5% - 10% |  |  |
| Melanoma lentiginoso acral | Proliferación continua de melanocitos atípicos en la unión dermoepidérmica. | 7% - 10% | 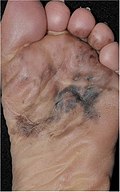 | 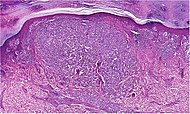 |
Otros tipos histopatológicos son:
- Melanoma mucoso; Cuando el melanoma se presenta en las membranas mucosas.
- Melanoma desmoplásico
- Melanoma con pequeñas células nevus-like
- Melanoma con características de un nevus de Spitz
- Melanoma uveal
- Melanoma vaginal
- Melanoma polipoide, una subclase de melanoma nodular.
In situ o invasivo
Un melanoma in situ no ha invadido más allá de la membrana basal, mientras que un melanoma invasivo se ha diseminado más allá de ella.
Algunos tipos histopatológicos de melanoma son intrínsecamente invasivos, incluidos el melanoma nodular y el melanoma lentigo maligno, donde la contraparte in situ del melanoma lentigo maligno es el lentigo maligno. El lentigo maligno a veces se clasifica como un melanoma muy temprano y, a veces, como un precursor del melanoma.
Los melanomas de extensión superficial y los melanomas lentiginosos acrales pueden ser in situ o invasivos, pero los melanomas lentiginosos acrales son casi siempre invasivos.
Puesta en escena
Más contexto sobre la estadificación del cáncer está disponible en TNM.
Los melanomas metastásicos se pueden detectar mediante rayos X, tomografías computarizadas, resonancias magnéticas, PET y PET/CT, ecografía, pruebas de LDH y detección fotoacústica. Sin embargo, faltan pruebas sobre la precisión de la estadificación de las personas con melanoma con diversos métodos de diagnóstico por la imagen.
Estadios del melanoma según AJCC, 8ª edición:
- TX: no se puede evaluar el grosor del tumor primario (como un diagnóstico por legrado)
- T0: sin evidencia de tumor primario (como melanoma primario desconocido o completamente revertido)
| Escenario | categoría T | Grosor | Ulceración |
|---|---|---|---|
| Etapa 0 | Melanoma in situ | ||
| Etapa I | T1a | Menos de 0,8 mm | No |
| T1b | Menos de 0,8 mm | Sí | |
| >0,8 a 1,0 mm | sí o no | ||
| T2a | >1,0 a 2,0 mm | No | |
| Etapa II | T2b | >1,0 a 2,0 mm | Sí |
| T3a | >2,0 a 4,0 mm | No | |
| T3b | >2,0 a 4,0 mm | Sí | |
| T4a | >4,0 mm | No | |
| T4b | >4,0 mm | Sí |
Las etapas 1 y 2 requieren una clase N (ganglio linfático) de:
- N0: sin metástasis regionales.
| Escenario | categoría N | Número de ganglios linfáticos regionales afectados por el tumor | Presencia de metástasis en tránsito, satélite y/o microsatélite |
|---|---|---|---|
| N / A | NX | Ganglios regionales no evaluados (como biopsia de ganglio linfático centinela no realizada o ganglios regionales extirpados previamente por otro motivo) | |
| Etapa III | N1 | Uno involucró un ganglio linfático, o cualquier número de metástasis en tránsito, satélite y/o microsatélite sin ganglios involucrados en el tumor. | |
| N1a | Uno clínicamente oculto (es decir, detectado por biopsia de ganglio centinela) | No | |
| N1b | Uno clínicamente detectado | No | |
| N1c | Sin enfermedad de los ganglios linfáticos regionales | Sí | |
| N2 | Dos o tres ganglios afectados por el tumor o cualquier número de metástasis en tránsito, satélite o microsatélite con un ganglio afectado por el tumor | ||
| N2a | Dos o tres clínicamente ocultos (es decir, detectados por biopsia del ganglio centinela) | No | |
| N2b | Dos o 3, al menos uno de los cuales fue detectado clínicamente | No | |
| N2c | Uno clínicamente oculto o clínicamente detectado | Sí | |
| N3 | Cuatro o más ganglios afectados por el tumor o cualquier número de metástasis en tránsito, satélite y/o microsatélite con 2 o más ganglios afectados por el tumor, o cualquier número de ganglios enmarañados sin o con metástasis en tránsito, satélite y/o microsatélite metástasis | ||
| N3a | Cuatro o más clínicamente ocultos (es decir, detectados por biopsia del ganglio centinela) | No | |
| N3b | Cuatro o más, al menos uno de los cuales se detectó clínicamente, o la presencia de cualquier número de ganglios enmarañados | No | |
| N3c | Dos o más clínicamente ocultos o clínicamente detectados y/o presencia de cualquier número de ganglios enmarañados | Sí |
Las etapas 1, 2 y 3 requieren una M (estado de metástasis) de:
- M0: Sin evidencia de metástasis a distancia
| Escenario | categoría M | sitio anatómico | nivel de lactato deshidrogenasa (LDH) |
|---|---|---|---|
| Etapa IV | M1 | Evidencia de metástasis a distancia | |
| M1a | Metástasis a distancia en la piel, tejidos blandos incluidos los músculos y/o ganglios linfáticos no regionales | No registrado o no especificado | |
| M1a(0) | no elevado | ||
| M1a(1) | Elevado | ||
| M1b | Metástasis a distancia en pulmón con o sin metástasis en sitios M1a | No registrado o no especificado | |
| M1b(0) | no elevado | ||
| M1b(1) | Elevado | ||
| M1c | Metástasis a distancia en sitios viscerales fuera del SNC, con o sin metástasis en sitios M1a o M1b | No registrado o no especificado | |
| M1c(0) | no elevado | ||
| M1c(1) | Elevado | ||
| M1d | Metástasis a distancia en el SNC, con o sin metástasis en los sitios M1a, M1b o M1c | No registrado o no especificado | |
| M1d (0) | no elevado | ||
| M1d (1) | Elevado |
Los sistemas más antiguos incluyen el "nivel de Clark" y la "profundidad de Breslow", que cuantifican la profundidad microscópica de la invasión tumoral.
Laboratorio
Las pruebas de lactato deshidrogenasa (LDH) a menudo se usan para detectar metástasis, aunque muchos pacientes con metástasis (incluso en etapa terminal) tienen una LDH normal; LDH extraordinariamente alta a menudo indica la diseminación metastásica de la enfermedad al hígado.
Es común que a los pacientes diagnosticados con melanoma se les realicen radiografías de tórax y una prueba de LDH y, en algunos casos, tomografías computarizadas, resonancias magnéticas, tomografías por emisión de positrones y/o tomografías computarizadas por emisión de positrones. Aunque son controversiales, las biopsias de ganglios linfáticos centinela y el examen de los ganglios linfáticos también se realizan en pacientes para evaluar la diseminación a los ganglios linfáticos. El diagnóstico de melanoma está respaldado por la presencia del marcador de proteína S-100.
HMB-45 es un anticuerpo monoclonal que reacciona contra un antígeno presente en tumores melanocíticos como los melanomas. Se utiliza en patología anatómica como marcador de este tipo de tumores. El anticuerpo se generó para un extracto de melanoma. Reacciona positivamente contra los tumores melanocíticos pero no contra otros tumores, demostrando así especificidad y sensibilidad. El anticuerpo también reacciona positivamente contra las células del nevo de unión, pero no contra los nevus intradérmicos, y contra los melanocitos fetales, pero no contra los melanocitos adultos normales.
HMB-45 no es reactivo con casi todas las neoplasias malignas humanas no melanoma, con la excepción de tumores raros que muestran evidencia de melanogénesis (p. ej., schwannoma pigmentado, sarcoma de células claras) o tumores asociados con el complejo de esclerosis tuberosa (angiomiolipoma y linfangiomioma).
Prevención
No hay evidencia para apoyar o refutar la detección de melanoma maligno en la población adulta.
Radiación ultravioleta
Minimizar la exposición a las fuentes de radiación ultravioleta (el sol y las hamacas), seguir las medidas de protección solar y llevar ropa de protección solar (camisas de manga larga, pantalones largos y sombreros de ala ancha) puede ofrecer protección.
Antes se creía que el uso de luz artificial para broncearse ayudaba a prevenir el cáncer de piel, pero en realidad puede conducir a una mayor incidencia de melanomas.
Las lámparas de uñas UV, que se utilizan en los salones de uñas para secar el esmalte de uñas, son otra fuente común y extendida de radiación UV que podría evitarse. Aunque el riesgo de desarrollar cáncer de piel a través del uso de lámparas UV para uñas es bajo, aún se recomienda usar guantes sin dedos y/o aplicar protector solar SPF 30 o mayor en las manos antes de usar una lámpara UV para uñas.
El cuerpo utiliza la luz ultravioleta para generar vitamina D, por lo que es necesario equilibrar la cantidad suficiente de luz solar para mantener niveles saludables de vitamina D y reducir el riesgo de melanoma; Se necesita alrededor de media hora de luz solar para que el cuerpo genere su vitamina D para el día y esta es aproximadamente la misma cantidad de tiempo que tardan las personas de piel clara en quemarse con el sol. La exposición a la luz solar puede ser intermitente en lugar de todo a la vez.
Protector solar
El protector solar parece ser efectivo para prevenir el melanoma. En el pasado, se recomendaba el uso de protectores solares con un factor de protección solar (FPS) de 50 o más en las áreas expuestas; ya que los protectores solares más antiguos bloquearon más eficazmente los rayos UVA con un SPF más alto. Actualmente, los ingredientes de protección solar más nuevos (avobenzona, óxido de zinc y dióxido de titanio) bloquean eficazmente tanto los rayos UVA como los UVB incluso con SPF más bajos. El protector solar también protege contra el carcinoma de células escamosas, otro cáncer de piel.
Se han planteado preocupaciones de que el protector solar podría crear una falsa sensación de seguridad contra el daño solar.
Medicamentos
Una revisión de 2005 encontró evidencia tentativa de que los medicamentos con estatinas y fibratos pueden disminuir el riesgo de melanoma. Sin embargo, una revisión de 2006 no apoyó ningún beneficio.
Tratamiento
La confirmación del diagnóstico clínico se realiza con una biopsia de piel. Esto generalmente se sigue con una escisión más amplia de la cicatriz o el tumor. Dependiendo de la etapa, se puede realizar una biopsia de ganglio linfático centinela. Existe controversia en torno a la evidencia del ensayo para la biopsia del ganglio linfático centinela; con evidencia poco clara de beneficio a partir de 2015. El tratamiento del melanoma maligno avanzado se realiza desde un enfoque multidisciplinario.
Cirugía
Las biopsias por escisión pueden extirpar el tumor, pero a menudo es necesaria una cirugía adicional para reducir el riesgo de recurrencia. La escisión quirúrgica completa con márgenes quirúrgicos adecuados y la evaluación de la presencia de enfermedad metastásica detectable junto con el seguimiento a corto y largo plazo es estándar. A menudo, esto se realiza mediante una escisión local amplia (WLE) con márgenes de 1 a 2 cm (0,4 a 0,8 pulgadas). El melanoma in situ y el lentigo maligno se tratan con márgenes quirúrgicos más estrechos, por lo general de 0,2 a 0,5 cm (0,1 a 0,2 pulgadas). Muchos cirujanos consideran 0,5 cm (0,2 pulgadas) el estándar de atención para la escisión estándar de melanoma in situ,pero un margen de 0,2 cm (0,1 pulgadas) podría ser aceptable para la cirugía de margen controlado (cirugía de Mohs o la técnica de doble hoja con control de margen). La escisión amplia tiene como objetivo reducir la tasa de recurrencia del tumor en el sitio de la lesión original. Este es un patrón común de fracaso del tratamiento en el melanoma. Numerosas investigaciones se han dirigido a dilucidar los márgenes apropiados para la escisión con una tendencia general hacia un tratamiento menos agresivo durante las últimas décadas. Un metanálisis de 2009 de ensayos controlados aleatorios encontró una pequeña diferencia en las tasas de supervivencia a favor de la escisión amplia de los melanomas cutáneos primarios, pero estos resultados no fueron estadísticamente significativos.
Se ha informado que la cirugía de Mohs tiene una tasa de curación tan baja como del 77 % y tan alta como del 98,0 % para el melanoma in situ. CCPDMA y la cirugía controlada de margen periférico de "doble bisturí" es equivalente a la cirugía de Mohs en efectividad en este tipo de melanoma "intraepitelial".
Los melanomas que se diseminan generalmente lo hacen a los ganglios linfáticos en el área del tumor antes de diseminarse a otra parte. Los intentos de mejorar la supervivencia mediante la extirpación quirúrgica de los ganglios linfáticos (linfadenectomía) se asociaron con muchas complicaciones, pero ningún beneficio general para la supervivencia. Recientemente, la técnica de biopsia de ganglio centinela se ha desarrollado para reducir las complicaciones de la cirugía de ganglios linfáticos al tiempo que permite evaluar la afectación de los ganglios con el tumor.
La biopsia de ganglio centinela es un procedimiento ampliamente utilizado en el tratamiento del melanoma cutáneo.
No se debe realizar una biopsia de ganglio centinela ni otras pruebas diagnósticas para evaluar el melanoma delgado temprano, incluido el melanoma in situ, el melanoma T1a o el melanoma T1b ≤ 0,5 mm. Es poco probable que las personas con estas afecciones tengan el cáncer diseminado a los ganglios linfáticos o a cualquier otro lugar y tienen una tasa de supervivencia a 5 años del 97 %. Debido a estas consideraciones, la biopsia del ganglio centinela se considera una atención médica innecesaria para ellos. Además, los análisis de sangre y los estudios radiográficos de referencia no deben realizarse solo en función de identificar este tipo de melanoma, ya que existen pruebas más precisas para detectar el cáncer y estas pruebas tienen altas tasas de falsos positivos.Para corregir potencialmente los falsos positivos, el perfil de expresión génica se puede utilizar como prueba auxiliar para lesiones ambiguas y pequeñas.
A menudo se realiza una biopsia del ganglio centinela, especialmente para tumores T1b/T2+, tumores de las mucosas, melanoma ocular y tumores de las extremidades. Se realiza un proceso llamado linfogammagrafía en el que se inyecta un trazador radiactivo en el sitio del tumor para localizar los ganglios centinela. Se proporciona mayor precisión utilizando un colorante trazador azul y se realiza una cirugía para realizar una biopsia de los ganglios. La tinción de rutina con hematoxilina y eosina (H&E) y la inmunoperoxidasa serán adecuadas para descartar la afectación de los ganglios. Las pruebas de reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) en los ganglios, que generalmente se realizan para evaluar el ingreso en ensayos clínicos, ahora demuestran que muchos pacientes con un ganglio linfático centinela negativo en realidad tenían una pequeña cantidad de células positivas en sus ganglios. Alternativamente, se puede realizar una biopsia por aspiración con aguja fina y, a menudo, se usa para evaluar masas.
Si un ganglio linfático es positivo, dependiendo de la extensión de la diseminación de los ganglios linfáticos, a menudo se realizará una disección radical de los ganglios linfáticos. Si la enfermedad se reseca por completo, se considerará al paciente para terapia adyuvante. La biopsia cutánea por escisión es el tratamiento de elección. Aquí, la lesión sospechosa se elimina por completo con una elipse adecuada (pero mínima, generalmente de 1 o 2 mm) de piel y tejido circundantes.Para evitar la interrupción del drenaje linfático local, el margen quirúrgico preferido para la biopsia inicial debe ser estrecho (1 mm). La biopsia debe incluir las capas epidérmica, dérmica y subcutánea de la piel. Esto permite al histopatólogo determinar el grosor del melanoma mediante un examen microscópico. Esto se describe por el espesor de Breslow (medido en milímetros). Sin embargo, para lesiones grandes, como sospecha de lentigo maligno, o para lesiones en áreas quirúrgicamente difíciles (cara, dedos de los pies, dedos de las manos, párpados), una pequeña biopsia con sacabocados en áreas representativas brindará información adecuada y no interrumpirá la estadificación final o la determinación de la profundidad.. En ningún caso la biopsia inicial debe incluir el margen quirúrgico final (0,5 cm, 1,0 cm o 2 cm), ya que un diagnóstico erróneo puede resultar en una cicatrización excesiva y morbilidad del procedimiento. Una escisión inicial grande interrumpirá el drenaje linfático local y puede afectar la disección de ganglios linfáticos dirigida por linfangiografía. Una pequeña biopsia por punción se puede utilizar en cualquier momento en el que, por razones logísticas y personales, un paciente rechace una biopsia por escisión más invasiva. Las biopsias con sacabocados pequeños son mínimamente invasivas y sanan rápidamente, por lo general sin dejar cicatrices notables.
Tratamiento adicional
Los melanomas de alto riesgo pueden requerir tratamiento adyuvante, aunque las actitudes al respecto varían en los diferentes países. En los Estados Unidos, la mayoría de los pacientes que gozan de buena salud comenzarán un tratamiento de interferón en dosis altas durante un año, lo que tiene efectos secundarios graves, pero puede mejorar levemente el pronóstico del paciente. Sin embargo, las pautas de la Asociación Británica de Dermatólogos sobre el melanoma establecen que el interferón no se recomienda como tratamiento adyuvante estándar para el melanoma. Un metanálisis de 2013 sugirió que la adición de interferón alfa aumentó la supervivencia general y sin enfermedad de las personas con melanoma cutáneo en estadio II-III del AJCC TNM.Un metanálisis de 2011 mostró que el interferón podría prolongar el tiempo antes de que regrese un melanoma, pero aumentó la supervivencia en solo un 3 % a los 5 años. Los efectos secundarios desagradables también reducen en gran medida la calidad de vida.
En la Unión Europea, el interferón generalmente no se usa fuera del alcance de los ensayos clínicos.
Quimioterapia
Los medicamentos de quimioterapia como la dacarbazina han sido la columna vertebral del tratamiento del melanoma metastásico desde la aprobación de la FDA en 1975; sin embargo, su eficacia en términos de supervivencia nunca se ha probado en un ECA.
En personas con cánceres cutáneos localmente avanzados y sarcoma, se ha descubierto que la infusión de extremidades aisladas (ILI, por sus siglas en inglés) es un procedimiento mínimamente invasivo y bien tolerado para administrar quimioterapia regional.
Terapia dirigida
Las células de melanoma tienen mutaciones que les permiten sobrevivir y crecer indefinidamente en el cuerpo. Las terapias dirigidas a moléculas pequeñas funcionan bloqueando los genes implicados en las vías de proliferación y supervivencia de los tumores. Los principales tratamientos son los inhibidores de BRAF, C-Kit y NRAS. Estos inhibidores funcionan para inhibir las vías posteriores involucradas en la proliferación celular y el desarrollo de tumores debido a mutaciones genéticas específicas. Las personas pueden recibir tratamiento con inhibidores dirigidos de molécula pequeña si son positivos para la mutación específica. Los inhibidores de BRAF, como vemurafenib y dabrafenib, y un inhibidor de MEK, trametinib, son los tratamientos aprobados más efectivos para el melanoma BRAF positivo.Los tumores de melanoma pueden desarrollar resistencia durante la terapia, lo que puede hacer que la terapia ya no sea efectiva, pero la combinación del uso de inhibidores de BRAF y MEK puede crear una respuesta rápida y duradera a la terapia del melanoma.
Varios tratamientos mejoran la supervivencia en comparación con la quimioterapia tradicional. La bioquimioterapia (quimioterapia con citocinas IL-2 e IFN-α) combinada con inhibidores de BRAF mejoró la supervivencia de las personas con melanoma BRAF positivo. La bioquimioterapia por sí sola no mejoró la supervivencia general y tuvo mayor toxicidad que la quimioterapia. La combinación de múltiples agentes de quimioterapia (poliquimioterapia) no mejoró la supervivencia en comparación con la monoquimioterapia. Las terapias dirigidas dan como resultado tiempos de supervivencia sin progresión (PFS, por sus siglas en inglés) relativamente cortos. La combinación de terapia de dabrafenib y trametinib tiene una SLP a 3 años del 23 % y una SLP a 5 años del 13 %.
Inmunoterapia
La inmunoterapia tiene como objetivo estimular el sistema inmunitario de la persona contra el tumor, mejorando la capacidad del propio cuerpo para reconocer y destruir las células cancerosas. El enfoque actual para tratar el melanoma con inmunoterapia incluye tres amplias categorías de tratamientos que incluyen citocinas, inhibidores de puntos de control inmunitarios y transferencia de células adoptivas. Estas opciones de tratamiento se usan con mayor frecuencia en personas con melanoma metastásico y mejoran significativamente la supervivencia general. Sin embargo, estos tratamientos suelen ser costosos. Por ejemplo, un tratamiento con un inhibidor del punto de control inmunitario, pembrolizumab, cuesta entre $10 000 y $12 000 USD por una sola dosis administrada cada 3 semanas.
Las terapias con citocinas utilizadas para el melanoma incluyen IFN-a e IL-2. IL-2 (Proleukin) fue la primera terapia nueva aprobada (1990 UE, 1992 EE. UU.) para el tratamiento del melanoma metastásico en 20 años. La IL-2 puede ofrecer la posibilidad de una remisión completa y duradera de esta enfermedad en un pequeño porcentaje de personas con melanoma. La IL-2 intralesional para metástasis en tránsito tiene una alta tasa de respuesta completa que oscila entre el 40 y el 100%. De manera similar, el IFN-a ha mostrado solo modestos beneficios de supervivencia y alta toxicidad, lo que limita su uso como terapia independiente.
Los inhibidores del punto de control inmunitario incluyen anticuerpos monoclonales anti-CTLA-4 (ipilimumab y tremelimumab), agonistas del receptor tipo toll (TLR), agonistas de CD40, anti-PD-1 (pembrolizumab, pidilizumab y nivolumab) y anticuerpos PD-L1. La evidencia sugiere que los anticuerpos anti-PD-1 son más efectivos que los anticuerpos anti-CTLA4 con menos toxicidad sistémica. La supervivencia libre de progresión a cinco años para la inmunoterapia con pembrolizumab es del 21 %. Un enfoque terapéutico que incluye la combinación de diferentes terapias mejora la supervivencia general y la supervivencia libre de progresión en comparación con el tratamiento con los fármacos de inmunoterapia separados solos.
La investigación en curso está analizando el tratamiento mediante transferencia celular adoptiva. La transferencia celular adoptiva se refiere a la aplicación de células T o células dendríticas preestimuladas y modificadas y se usa actualmente para minimizar las complicaciones de la enfermedad de injerto contra huésped.
La combinación nivolumab/relatlimab (Opdualag) fue aprobada para uso médico en los Estados Unidos en marzo de 2022.
Desaceleración maligna
La mayoría de los cirujanos aún realizan la escisión estándar. Desafortunadamente, la tasa de recurrencia es extremadamente alta (hasta un 50%). Esto se debe al margen quirúrgico visible mal definido y la ubicación facial de las lesiones (que a menudo obliga al cirujano a utilizar un margen quirúrgico estrecho). El estrecho margen quirúrgico utilizado, combinado con la limitación de la técnica estándar de "pan de pan" de histología de tejido fijo, da como resultado una alta tasa de error de "falsos negativos" y recurrencias frecuentes. El control de márgenes (márgenes periféricos) es necesario para eliminar los errores de falsos negativos. Si se utiliza la formación de pan, las distancias de las secciones deben acercarse a 0,1 mm para garantizar que el método se acerque al control total del margen.
La cirugía de Mohs se ha realizado con una tasa de curación informada que es tan baja como 77% y tan alta como 95% por otro autor. El método de escisión controlada del margen periférico con "bisturí doble" se aproxima al método de Mohs en el control del margen, pero requiere un patólogo íntimamente familiarizado con la complejidad del manejo del margen vertical en las secciones periféricas delgadas y los métodos de tinción.
Algunos nevus melanocíticos y melanoma in situ (lentigo maligno) se han resuelto con un tratamiento experimental, crema tópica de imiquimod (Aldara), un agente potenciador del sistema inmunitario. Algunos dermacirujanos combinan los 2 métodos: extirpar quirúrgicamente el cáncer y luego tratar el área con crema Aldara después de la operación durante tres meses. Si bien algunos estudios han sugerido el uso adyuvante de tazaroteno tópico, la evidencia actual es insuficiente para recomendarlo y sugiere que aumenta la inflamación tópica, lo que lleva a un menor cumplimiento por parte del paciente.
Radiación
La radioterapia a menudo se usa después de la resección quirúrgica para pacientes con melanoma local o regionalmente avanzado o para pacientes con metástasis a distancia irresecables. Los haces de rayos X de kilovoltaje se utilizan a menudo para estos tratamientos y tienen la propiedad de que la dosis máxima de radiación se produce cerca de la superficie de la piel. Puede reducir la tasa de recurrencia local pero no prolonga la supervivencia. Actualmente se está investigando la radioinmunoterapia del melanoma metastásico. La radioterapia tiene un papel en la paliación del melanoma metastásico.
Pronóstico
Los factores que afectan el pronóstico incluyen:
- espesor del tumor en milímetros (profundidad de Breslow),
- profundidad relacionada con las estructuras de la piel (nivel de Clark),
- tipo de melanoma,
- presencia de ulceración,
- presencia de invasión linfática/perineural,
- presencia de linfocitos infiltrantes de tumores (si están presentes, el pronóstico es mejor),
- ubicación de la lesión,
- presencia de lesiones satélite, y
- presencia de metástasis regionales oa distancia.
Ciertos tipos de melanoma tienen peor pronóstico pero esto se explica por su grosor. Los melanomas menos invasivos, incluso con metástasis en los ganglios linfáticos, tienen un mejor pronóstico que los melanomas profundos sin metástasis regionales en el momento de la estadificación. Las recurrencias locales tienden a comportarse de manera similar a las primarias, a menos que estén en el sitio de una escisión local amplia (a diferencia de una escisión por etapas o una escisión con sacabocados/afeitado), ya que estas recurrencias tienden a indicar invasión linfática.
Cuando los melanomas se han diseminado a los ganglios linfáticos, uno de los factores más importantes es la cantidad de ganglios con malignidad. La extensión de la malignidad dentro de un ganglio también es importante; las micrometástasis en las que la malignidad es solo microscópica tienen un pronóstico más favorable que las macrometástasis. En algunos casos, las micrometástasis solo pueden detectarse mediante una tinción especial, y si la malignidad solo es detectable mediante una prueba raramente utilizada conocida como reacción en cadena de la polimerasa (PCR), el pronóstico es mejor. Las macrometástasis en las que la malignidad es clínicamente aparente (en algunos casos, el cáncer reemplaza completamente un ganglio) tienen un pronóstico mucho peor, y si los ganglios están enmarañados o si hay extensión extracapsular, el pronóstico es aún peor. Además de estas variables,
El melanoma en estadio IV, en el que ha hecho metástasis, es la neoplasia maligna de la piel más letal: la supervivencia a cinco años es del 22,5 %. Cuando hay metástasis a distancia, el cáncer generalmente se considera incurable. La tasa de supervivencia a cinco años es inferior al 10%. La mediana de supervivencia es de 6 a 12 meses. El tratamiento es paliativo, centrándose en la extensión de la vida y la calidad de vida. En algunos casos, los pacientes pueden vivir muchos meses o incluso años con melanoma metastásico (dependiendo de la agresividad del tratamiento). Las metástasis en piel y pulmones tienen mejor pronóstico. Las metástasis en cerebro, hueso e hígado se asocian con un peor pronóstico. La supervivencia es mejor con metástasis en las que se desconoce la ubicación del tumor primario.
No hay suficientes pruebas definitivas para estadificar adecuadamente y, por lo tanto, dar un pronóstico para el melanoma ocular y el melanoma de partes blandas, o el melanoma de las mucosas (p. ej., melanoma rectal), aunque estos tienden a hacer metástasis con mayor facilidad. Aunque la regresión puede aumentar la supervivencia, cuando un melanoma ha retrocedido, es imposible saber su tamaño original y, por lo tanto, el tumor original suele ser peor de lo que podría indicar un informe patológico.
Alrededor de 200 genes son pronósticos en el melanoma, con genes desfavorables donde la alta expresión se correlaciona con una supervivencia pobre y genes favorables donde la alta expresión se asocia con tiempos de supervivencia más largos. Ejemplos de genes desfavorables son MCM6 y TIMELESS; un ejemplo de un gen favorable es WIPI1.
Una mayor proporción de neutrófilos a linfocitos se asocia con peores resultados.
Epidemiología
A nivel mundial, en 2012, el melanoma se presentó en 232 000 personas y resultó en 55 000 muertes. Australia y Nueva Zelanda tienen las tasas más altas de melanoma en el mundo. Se ha vuelto más común en los últimos 20 años en áreas que son en su mayoría caucásicas.
La tasa de melanoma ha aumentado en los últimos años, pero no está claro en qué medida están implicados cambios en el comportamiento, en el entorno o en la detección precoz.
Australia
Australia tiene una tasa muy alta y creciente de melanoma. En 2012, las muertes por melanoma ocurrieron en 7,3 a 9,8 por 100 000 habitantes. En Australia, el melanoma es el tercer cáncer más común en ambos sexos; de hecho, su incidencia es mayor que la del cáncer de pulmón, aunque este último causa más muertes. Se estima que en 2012, más de 12 000 australianos fueron diagnosticados con melanoma: dada la modesta población de Australia, esto se expresa mejor como 59,6 nuevos casos por 100 000 habitantes por año; >1 de cada 10 de todos los nuevos casos de cáncer fueron melanomas. La incidencia de melanoma en Australia es importante por las siguientes razones:
- La incidencia de melanoma australiano ha aumentado en más del 30 por ciento entre 1991 y 2009.
- Las tasas de incidencia estandarizadas por edad del melanoma australiano fueron, a partir de 2008, al menos 12 veces más altas que el promedio mundial.
- La incidencia de melanoma en Australia es, por cierto margen, la más alta del mundo.
- La incidencia general de cáncer estandarizada por edad en Australia es la más alta del mundo, y esto se atribuye solo al melanoma. La incidencia general de cáncer estandarizada por edad es similar a la de Nueva Zelanda, pero existe una diferencia estadísticamente significativa entre Australia y todas las demás partes del mundo desarrollado, incluidos América del Norte, Europa Occidental y el Mediterráneo.
Estados Unidos
| Tasas de melanoma por raza y etnia en los EE. UU. | ||
|---|---|---|
| Carrera | ||
| Blanco | 25 | |
| indio americano | 5 | |
| Hispano | 4 | |
| asiático | 1 | |
| Negro | 1 | |
| Melanomas diagnosticados en los EE. UU. por cada 100 000 personas en 2018. Los melanomas afectan a las personas blancas con mucha más frecuencia que a las personas de cualquier otra clasificación racial o étnica. |
En los Estados Unidos, alrededor de 9000 personas mueren de melanoma al año. En 2011 afectó a 19,7 por 100.000 y resultó en muerte en 2,7 por 100.000.
En 2013:
- 71 943 personas en los Estados Unidos fueron diagnosticadas con melanomas de la piel, incluidos 42 430 hombres y 29 513 mujeres.
- 9394 personas en los Estados Unidos murieron de melanomas de la piel, incluidos 6239 hombres y 3155 mujeres.
Las estimaciones de la Sociedad Estadounidense del Cáncer para la incidencia de melanoma en los Estados Unidos para 2017 son:
- Se diagnosticarán unos 87.110 nuevos melanomas (unos 52.170 en hombres y 34.940 en mujeres).
- Se espera que alrededor de 9730 personas mueran de melanoma (alrededor de 6380 hombres y 3350 mujeres).
El melanoma es más de 20 veces más común en los blancos que en los afroamericanos. En general, el riesgo de contraer melanoma a lo largo de la vida es de aproximadamente 2,5 % (1 en 40) para los blancos, 0,1 % (1 en 1000) para los afroamericanos y 0,5 % (1 en 200) para los hispanos.
El riesgo de melanoma aumenta a medida que las personas envejecen. La edad promedio de las personas cuando se diagnostica la enfermedad es de 63 años.
Historia
Aunque el melanoma no es una enfermedad nueva, la evidencia de su aparición en la antigüedad es bastante escasa. Sin embargo, un ejemplo se encuentra en un examen de la década de 1960 de nueve momias peruanas, fechadas por radiocarbono en aproximadamente 2400 años, que mostraban signos aparentes de melanoma: masas melanóticas en la piel y metástasis difusas en los huesos.
Se informa que John Hunter fue el primero en operar un melanoma metastásico en 1787. Aunque no sabía con precisión qué era, lo describió como una "excrecencia fungosa cancerosa". El tumor extirpado se conservó en el Museo Hunterian del Royal College of Surgeons of England. No fue hasta 1968 que el examen microscópico del espécimen reveló que era un ejemplo de melanoma metastásico.
El médico francés René Laennec fue el primero en describir el melanoma como una entidad patológica. Su informe se presentó inicialmente durante una conferencia para la Faculté de Médecine de Paris en 1804 y luego se publicó como boletín en 1806.
El primer informe en inglés sobre melanoma fue presentado por un médico general inglés de Stourbridge, William Norris, en 1820. En su trabajo posterior de 1857, señaló que existe una predisposición familiar para el desarrollo de melanoma (Eight Cases of Melanosis with Pathological and Therapeutical Comentarios sobre esa enfermedad). Norris también fue pionero en sugerir un vínculo entre los nevos y el melanoma y la posibilidad de una relación entre el melanoma y las exposiciones ambientales, al observar que la mayoría de sus pacientes tenían tez pálida. También describió que los melanomas podrían ser amelanóticos y luego mostró la naturaleza metastásica del melanoma al observar que pueden diseminarse a otros órganos viscerales.
El primer reconocimiento formal del melanoma avanzado como intratable provino de Samuel Cooper en 1840. Afirmó que la única posibilidad de curación depende de la extirpación temprana de la enfermedad (es decir, la escisión temprana del lunar maligno)...'
Más de un siglo y medio después, esta situación permanece prácticamente sin cambios.
Terminología
La palabra melanoma llegó al inglés del nuevo latín del siglo XIX y utiliza formas combinadas derivadas de raíces griegas antiguas: melano- (que denota melanina) + -oma (que denota una masa de tejido y especialmente una neoplasia), a su vez del griego μέλας melas, " oscuro", y -ωμα oma, "proceso". La palabra melanoma tiene una larga historia de uso en un sentido más amplio para referirse a cualquier tumor melanocítico, por lo general, pero no siempre maligno, pero hoy en día el sentido más estricto que se refiere solo a los tipos malignos se ha vuelto tan dominante que los tumores benignos generalmente no se llaman melanomas. más y la palabra melanomaahora generalmente se considera melanoma maligno a menos que se especifique lo contrario. Términos como "tumor melanocítico benigno" etiquetan inequívocamente los tipos benignos, y las clasificaciones histopatológicas de tumores modernas que se usan en medicina no usan la palabra para tumores benignos.
Investigar
La investigación farmacoterapéutica para el melanoma maligno no resecable o metastásico está en curso.
Terapias dirigidas
En la investigación clínica, se están probando la terapia celular adoptiva y la terapia génica.
Se han utilizado dos tipos de tratamientos experimentales desarrollados en el Instituto Nacional del Cáncer (NCI) en el melanoma metastásico con un éxito tentativo.
El primer tratamiento consiste en la terapia celular adoptiva (ACT) utilizando células inmunitarias TIL (linfocitos infiltrantes de tumores) aisladas del propio tumor de melanoma de una persona. Estas células se cultivan en grandes cantidades en un laboratorio y se devuelven al paciente después de un tratamiento que reduce temporalmente las células T normales en el cuerpo del paciente. La terapia TIL después del agotamiento de los linfocitos puede dar como resultado una respuesta completa duradera en una variedad de configuraciones.
El segundo tratamiento, la transferencia adoptiva de linfocitos autólogos alterados genéticamente, depende de la entrega de genes que codifican los llamados receptores de células T (TCR) en los linfocitos del paciente. Después de esa manipulación, los linfocitos reconocen y se unen a ciertas moléculas que se encuentran en la superficie de las células de melanoma y las matan.
Una vacuna contra el cáncer mostró un beneficio modesto en las últimas pruebas en 2009 contra el melanoma.
Inhibidores de BRAF
Alrededor del 60% de los melanomas contienen una mutación en el gen B-Raf. Los primeros ensayos clínicos sugirieron que los inhibidores de B-Raf, incluido el vemurafenib de Plexxicon, podrían conducir a una regresión sustancial del tumor en la mayoría de los pacientes si su tumor contiene la mutación B-Raf. En junio de 2011, un gran ensayo clínico confirmó los resultados positivos de esos ensayos anteriores.
En agosto de 2011, Vemurafenib recibió la aprobación de la FDA para el tratamiento del melanoma en etapa tardía. En mayo de 2013, la FDA de EE. UU. aprobó dabrafenib como tratamiento de agente único para pacientes con melanoma avanzado con mutación BRAF V600E positiva.
Algunos investigadores creen que las terapias combinadas que bloquean simultáneamente múltiples vías pueden mejorar la eficacia al dificultar la mutación de las células tumorales antes de ser destruidas. En octubre de 2012, un estudio informó que la combinación de dabrafenib con trametinib, un inhibidor de MEK, condujo a resultados aún mejores. En comparación con dabrafenib solo, la supervivencia libre de progresión aumentó del 9 % al 41 %, y la mediana de supervivencia libre de progresión aumentó a 9,4 meses frente a 5,8 meses. Sin embargo, algunos efectos secundarios aumentaron en el estudio combinado.
En enero de 2014, la FDA aprobó la combinación de dabrafenib y trametinib para el tratamiento de personas con melanoma metastásico con mutación BRAF V600E/K. En junio de 2018, la FDA aprobó la combinación de un inhibidor de BRAF, encorafenib, y un inhibidor de MEK, binimetinib, para el tratamiento del melanoma irresecable o metastásico con una mutación BRAF V600E o V600K.
La eventual resistencia a los inhibidores de BRAF y MEK puede deberse a una proteína de superficie celular conocida como EphA2 que ahora se está investigando.
Ipilimumab
En la Conferencia de la Sociedad Estadounidense de Oncología Clínica en junio de 2010, la compañía farmacéutica Bristol-Myers Squibb informó sobre los hallazgos clínicos de su fármaco ipilimumab. El estudio encontró un aumento en la mediana de supervivencia de 6,4 a 10 meses en pacientes con melanomas avanzados tratados con ipilimumab monoclonal, en comparación con una vacuna experimental. También encontró una tasa de supervivencia de un año del 25 % en el grupo de control que usaba la vacuna, del 44 % en el grupo de la vacuna e ipilimumab, y del 46 % en el grupo tratado con ipilimumab solo. Sin embargo, algunos han expresado su preocupación acerca de este estudio por el uso del brazo de control no convencional, en lugar de comparar el fármaco con un placebo o un tratamiento estándar.La crítica fue que, aunque el ipilimumab funcionó mejor que la vacuna, la vacuna no se ha probado antes y puede estar causando toxicidad, lo que hace que el fármaco parezca mejor en comparación.
Ipilimumab fue aprobado por la FDA en marzo de 2011 para tratar pacientes con melanoma en etapa avanzada que se ha propagado o no se puede extirpar mediante cirugía.
En junio de 2011, un ensayo clínico de ipilimumab más dacarbazina combinó este refuerzo del sistema inmunitario con el fármaco de quimioterapia estándar que se dirige a la división celular. Mostró un aumento en la mediana de supervivencia para estos pacientes en etapa tardía a 11 meses en lugar de los 9 meses normalmente vistos. Los investigadores también tenían la esperanza de mejorar la tasa de supervivencia de cinco años, aunque se observaron efectos secundarios adversos graves en algunos pacientes. Un ciclo de tratamiento cuesta $120,000. El nombre comercial de la droga es Yervoy.
Métodos de vigilancia
Los avances en la ecografía de alta resolución han permitido la vigilancia de la carga metastásica en los ganglios linfáticos centinela. El ensayo Screening and Surveillance of Ultrasound in Melanoma (SUNMEL) está evaluando el ultrasonido como una alternativa a los métodos quirúrgicos invasivos.
Viroterapia oncolítica
En algunos países se estudian y utilizan métodos de viroterapia oncolítica para tratar el melanoma. La viroterapia oncolítica es una rama prometedora de la viroterapia, donde los virus oncolíticos se utilizan para tratar enfermedades; los virus pueden aumentar el metabolismo, reducir la inmunidad antitumoral y desorganizar la vasculatura. Talimogene laherparepvec (T-VEC) (que es una inmunoterapia oncolítica derivada del virus del herpes simple tipo 1), demostró ser útil contra el melanoma metastásico en 2015 con una mayor supervivencia de 4,4 meses.
Contenido relacionado
Usos Médicos de la Plata
Memoria episódica
Terapia física