Masa atómica
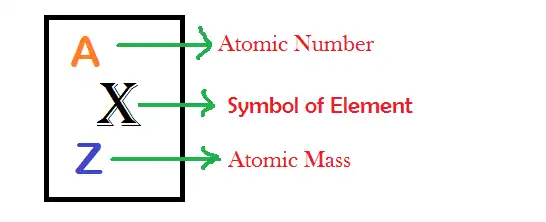
La masa atómica (ma o m) es la masa de un átomo. Aunque la unidad de masa del SI es el kilogramo (símbolo: kg), la masa atómica a menudo se expresa en la unidad de masa atómica (amu) o masa unificada (u) o dalton (símbolo: Da), que no pertenece al SI, donde 1 amu o 1 u o 1 Da se define como 1 ⁄ 12 de la masa de un solo átomo de carbono-12, en reposo.Los protones y neutrones del núcleo representan casi toda la masa total de los átomos, y los electrones y la energía de enlace nuclear hacen contribuciones menores. Por lo tanto, el valor numérico de la masa atómica cuando se expresa en daltons tiene casi el mismo valor que el número de masa. La conversión entre masa en kilogramos y masa en daltons se puede hacer usando la constante de masa atómica 
La fórmula utilizada para la conversión es:
donde 


La masa isotópica relativa (consulte la sección a continuación) se puede obtener dividiendo la masa atómica m a de un isótopo por la constante de masa atómica m u, lo que arroja un valor adimensional. Por lo tanto, la masa atómica de un átomo de carbono-12 es12 Da por definición, pero la masa isotópica relativa de un átomo de carbono-12 es simplemente 12. La suma de las masas isotópicas relativas de todos los átomos en una molécula es la masa molecular relativa.
La masa atómica de un isótopo y la masa isotópica relativa se refieren a cierto isótopo específico de un elemento. Debido a que las sustancias generalmente no son isotópicamente puras, es conveniente utilizar la masa atómica elemental, que es la masa atómica promedio (media) de un elemento, ponderada por la abundancia de los isótopos. El peso atómico adimensional (estándar) es la masa isotópica relativa media ponderada de una mezcla (típica de origen natural) de isótopos.
La masa atómica de los átomos, iones o núcleos atómicos es ligeramente menor que la suma de las masas de sus protones, neutrones y electrones constituyentes, debido a la pérdida de masa de energía de enlace (por E = mc).
Masa isotópica relativa
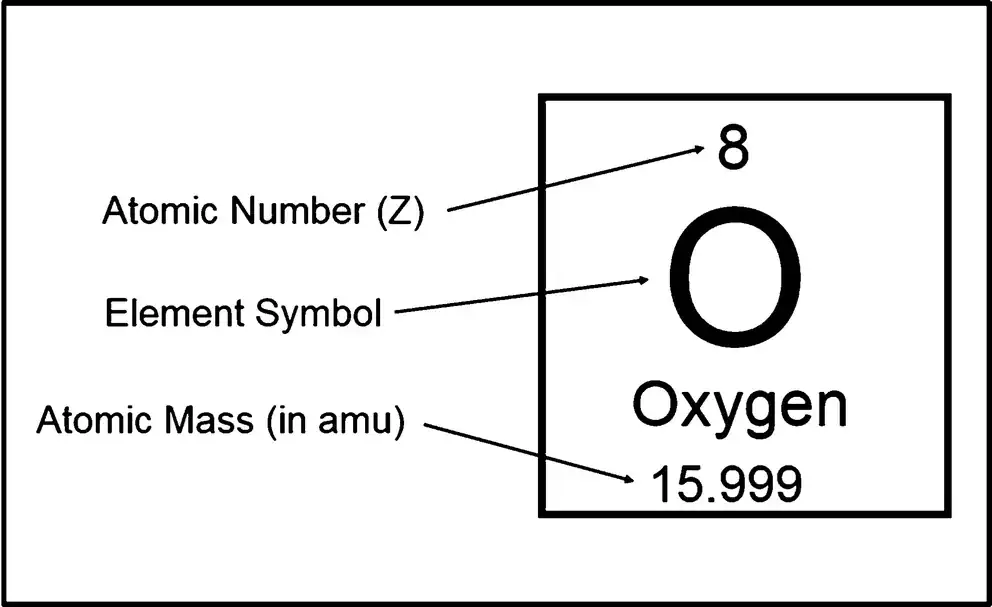
La masa isotópica relativa (una propiedad de un solo átomo) no debe confundirse con el peso atómico de cantidad promedio (ver arriba), que es un promedio de valores para muchos átomos en una muestra dada de un elemento químico.
Mientras que la masa atómica es una masa absoluta, la masa isotópica relativa es un número adimensional sin unidades. Esta pérdida de unidades resulta del uso de una relación de escala con respecto a un estándar de carbono-12, y la palabra "relativa" en el término "masa isotópica relativa" se refiere a esta escala en relación con el carbono-12.
La masa isotópica relativa, entonces, es la masa de un isótopo dado (en concreto, cualquier nucleido único), cuando este valor se escala por la masa de carbono-12, donde esta última debe determinarse experimentalmente. De manera equivalente, la masa isotópica relativa de un isótopo o nucleido es la masa del isótopo relativa a 1/12 de la masa de un átomo de carbono-12.
Por ejemplo, la masa isotópica relativa de un átomo de carbono-12 es exactamente 12. En comparación, la masa atómica de un átomo de carbono-12 es exactamente 12 daltons. Alternativamente, la masa atómica de un átomo de carbono-12 puede expresarse en cualquier otra unidad de masa: por ejemplo, la masa atómica de un átomo de carbono-12 es1.992 646 879 92 (60) × 10 kg.
Como es el caso de la masa atómica relacionada cuando se expresa en daltons, los números de masa isotópicos relativos de nucleidos distintos del carbono-12 no son números enteros, pero siempre están cerca de los números enteros. Esto se discute completamente a continuación.
Términos similares para diferentes cantidades

La masa atómica o la masa isotópica relativa a veces se confunden, o se usan incorrectamente, como sinónimos de masa atómica relativa (también conocida como peso atómico) o peso atómico estándar (una variedad particular de peso atómico, en el sentido de que está estandarizado). Sin embargo, como se señaló en la introducción, la masa atómica es una masa absoluta, mientras que todos los demás términos son adimensionales. La masa atómica relativa y el peso atómico estándar representan términos para promedios (ponderados en abundancia) de masas atómicas relativas en muestras elementales, no para nucleidos individuales. Como tal, la masa atómica relativa y el peso atómico estándar a menudo difieren numéricamente de la masa isotópica relativa.
La masa atómica (masa isotópica relativa) se define como la masa de un solo átomo, que solo puede ser un isótopo (núclido) a la vez, y no es un promedio ponderado por abundancia, como en el caso de masa atómica relativa/atómica. peso. La masa atómica o masa isotópica relativa de cada isótopo y nucleido de un elemento químico es, por lo tanto, un número que, en principio, puede medirse con gran precisión, ya que se espera que cada espécimen de tal nucleido sea exactamente idéntico a cualquier otro espécimen. ya que se espera que todos los átomos de un tipo dado en el mismo estado de energía, y cada espécimen de un nucleido en particular, sea exactamente idéntico en masa a cualquier otro espécimen de ese nucleido. Por ejemplo, se espera que cada átomo de oxígeno-16 tenga exactamente la misma masa atómica (masa isotópica relativa) que cualquier otro átomo de oxígeno-16.
En el caso de muchos elementos que tienen un isótopo natural (elementos mononucleídicos) o un isótopo dominante, la diferencia entre la masa atómica del isótopo más común y la masa atómica relativa (estándar) o el peso atómico (estándar) puede ser pequeña. o incluso nulo, y no afecta a la mayoría de los cálculos masivos. Sin embargo, tal error puede existir e incluso ser importante cuando se consideran átomos individuales para elementos que no son mononucleídicos.
Para los elementos no mononucleídicos que tienen más de un isótopo común, la diferencia numérica en la masa atómica relativa (peso atómico) incluso de la masa isotópica relativa más común puede ser de media unidad de masa o más (por ejemplo, ver el caso del cloro donde peso y el peso atómico estándar son aproximadamente 35,45). La masa atómica (masa isotópica relativa) de un isótopo poco común puede diferir de la masa atómica relativa, el peso atómico o el peso atómico estándar en varias unidades de masa.
Las masas isotópicas relativas siempre están cerca de los valores de números enteros, pero nunca (excepto en el caso del carbono-12) exactamente un número entero, por dos razones:
- protones y neutrones tienen diferentes masas, y diferentes nucleidos tienen diferentes proporciones de protones y neutrones.
- las masas atómicas se reducen, en diferentes grados, por sus energías de enlace.
La relación entre la masa atómica y el número de masa (número de nucleones) varía de0.998 838 1346 (51) para Fe a1.007 825 031 898 (14) para H.
Cualquier defecto de masa debido a la energía de enlace nuclear es experimentalmente una pequeña fracción (menos del 1%) de la masa de un número igual de nucleones libres. Cuando se compara con la masa promedio por nucleón en el carbono 12, que tiene un enlace moderadamente fuerte en comparación con otros átomos, el defecto de masa del enlace para la mayoría de los átomos es una fracción aún más pequeña de un dalton (unidad de masa atómica unificada, basada en el carbono-12). 12). Dado que los protones libres y los neutrones difieren entre sí en masa por una pequeña fracción de un dalton (1.388 449 33 (49) × 10 Da), redondeando la masa isotópica relativa, o la masa atómica de cualquier nucleido dada dada en daltons al número entero más cercano, siempre da el conteo de nucleones, o número de masa. Además, el recuento de neutrones (número de neutrones) se puede obtener restando el número de protones (número atómico) del número de masa (recuento de nucleones).
Defectos de masa en masas atómicas
La cantidad en que la relación de masas atómicas a número de masa se desvía de 1 es la siguiente: la desviación comienza positiva en el hidrógeno-1, luego disminuye hasta que alcanza un mínimo local en el helio-4. Los isótopos de litio, berilio y boro se unen con menos fuerza que el helio, como lo demuestran sus crecientes proporciones de masa a masa.
En el carbono, la relación entre la masa (en daltons) y el número de masa se define como 1, y después del carbono se vuelve inferior a uno hasta que se alcanza un mínimo en el hierro-56 (con valores ligeramente superiores para el hierro-58 y el níquel-62).), luego aumenta a valores positivos en los isótopos pesados, con un número atómico creciente. Esto corresponde al hecho de que la fisión nuclear en un elemento más pesado que el zirconio produce energía, y la fisión en cualquier elemento más liviano que el niobio requiere energía. Por otra parte, la fusión nuclear de dos átomos de un elemento más ligero que el escandio (excepto el helio) produce energía, mientras que la fusión de elementos más pesados que el calcio requiere energía. La fusión de dos átomos de He que producen berilio-8 requeriría energía, y el berilio se desmoronaría rápidamente de nuevo. Puede fusionarse con tritio (H) o con Él; estos procesos ocurrieron durante la nucleosíntesis del Big Bang. La formación de elementos con más de siete nucleones requiere la fusión de tres átomos de He en el proceso triple alfa, saltándose el litio, el berilio y el boro para producir carbono-12.
Aquí hay algunos valores de la relación entre la masa atómica y el número de masa:
| nucleido | Relación de masa atómica a número de masa |
|---|---|
| H | 1.007 825 031 898 (14) |
| H | 1.007 050 888 9220 (75) |
| H | 1.005 349 760 440 (27) |
| Él | 1.005 343 107 322 (20) |
| Él | 1.000 650 813 533 (40) |
| li | 1.002 520 481 24 (26) |
| C | 1 |
| norte | 1.000 219 571 732 (17) |
| O | 0.999 682 163 704 (20) |
| Fe | 0.998 838 1346 (51) |
| Correos | 0.999 918 4461 (59) |
| el | 1.000 164 0242 (66) |
| tu | 1.000 213 3905 (67) |
Medición de masas atómicas
La comparación directa y la medición de las masas de los átomos se logran con espectrometría de masas.
Relación entre masas atómicas y moleculares
Definiciones similares se aplican a las moléculas. Se puede calcular la masa molecular de un compuesto sumando las masas atómicas (no los pesos atómicos estándar) de sus átomos constituyentes. Por el contrario, la masa molar generalmente se calcula a partir de los pesos atómicos estándar (no las masas atómicas o de nucleidos). Por lo tanto, la masa molecular y la masa molar difieren ligeramente en valor numérico y representan conceptos diferentes. La masa molecular es la masa de una molécula, que es la suma de sus masas atómicas constituyentes. La masa molar es un promedio de las masas de las moléculas constituyentes en un conjunto químicamente puro pero isotópicamente heterogéneo. En ambos casos hay que tener en cuenta la multiplicidad de los átomos (el número de veces que se da), normalmente multiplicando cada masa única por su multiplicidad.
| Masa molar of CH 4 | |||
|---|---|---|---|
| peso atómico estándar | Número | Masa molar total (g/mol)o peso molecular (Da o g/mol) | |
| C | 12.011 | 1 | 12.011 |
| H | 1.008 | 4 | 4.032 |
| Canal 4 | 16.043 | ||
| Masa molecular de C H 4 | |||
| Masa de nucleidos | Número | Masa molecular total (Da o u) | |
| C | 12.00 | 1 | 12.00 |
| H | 1.007825 | 4 | 4.0313 |
| Canal 4 | 16.0313 |
Historia
Los primeros científicos en determinar las masas atómicas relativas fueron John Dalton y Thomas Thomson entre 1803 y 1805 y Jöns Jakob Berzelius entre 1808 y 1826. Masa atómica relativa (peso atómico) se definió originalmente en relación con la del elemento más ligero, el hidrógeno, que se tomó como 1,00, y en la década de 1820, la hipótesis de Prout establecía que las masas atómicas de todos los elementos demostrarían ser múltiplos exactos de la del hidrógeno. Berzelius, sin embargo, pronto demostró que esto no era ni siquiera aproximadamente cierto, y para algunos elementos, como el cloro, la masa atómica relativa, alrededor de 35,5, cae casi exactamente a la mitad entre dos múltiplos enteros de la del hidrógeno. Aún más tarde, se demostró que esto se debe en gran parte a una mezcla de isótopos, y que las masas atómicas de los isótopos puros, o nucleidos, son múltiplos de la masa de hidrógeno, con una precisión de alrededor del 1%.
En la década de 1860, Stanislao Cannizzaro refinó las masas atómicas relativas aplicando la ley de Avogadro (en particular, en el Congreso de Karlsruhe de 1860). Formuló una ley para determinar las masas atómicas relativas de los elementos: las diferentes cantidades del mismo elemento contenidas en diferentes moléculas son múltiplos enteros del peso atómico y determinó las masas atómicas relativas y las masas moleculares comparando la densidad de vapor de una colección de gases con moléculas que contienen uno o más del elemento químico en cuestión.
En el siglo XX, hasta la década de 1960, los químicos y los físicos usaban dos escalas de masa atómica diferentes. Los químicos utilizaron una escala de "unidad de masa atómica" (uma) tal que la mezcla natural de isótopos de oxígeno tenía una masa atómica 16, mientras que los físicos asignaron el mismo número 16 solo a la masa atómica del isótopo de oxígeno más común (O, que contiene ocho protones y ocho neutrones). Sin embargo, debido a que el oxígeno-17 y el oxígeno-18 también están presentes en el oxígeno natural, esto llevó a dos tablas diferentes de masa atómica. La escala unificada basada en el carbono-12,C, satisfizo la necesidad de los físicos de basar la escala en un isótopo puro, siendo numéricamente cercano a la escala de los químicos. Esto fue adoptado como la 'unidad de masa atómica unificada'. La recomendación principal actual del Sistema Internacional de Unidades (SI) para el nombre de esta unidad es el dalton y el símbolo 'Da'. El nombre 'unidad de masa atómica unificada' y el símbolo 'u' son nombres y símbolos reconocidos para la misma unidad.
El término peso atómico se está eliminando gradualmente y se está reemplazando por masa atómica relativa, en el uso más actual. Este cambio en la nomenclatura se remonta a la década de 1960 y ha sido fuente de mucho debate en la comunidad científica, que fue desencadenado por la adopción de la unidad de masa atómica unificada y la comprensión de que el peso era, en cierto modo, un término inapropiado. El argumento para mantener el término "peso atómico" fue principalmente que era un término bien entendido por aquellos en el campo, que el término "masa atómica" ya estaba en uso (como se define actualmente) y que el término "peso atómico relativo". masa" podría confundirse fácilmente con la masa isotópica relativa(la masa de un solo átomo de un nucleido dado, expresada adimensionalmente en relación con 1/12 de la masa de carbono-12; consulte la sección anterior).
En 1979, como compromiso, se introdujo el término "masa atómica relativa" como sinónimo secundario de peso atómico. Veinte años más tarde se invirtió la primacía de estos sinónimos, y el término "masa atómica relativa" es ahora el término preferido.
Sin embargo, el término " pesos atómicos estándar " (que se refiere a los pesos atómicos esperados estandarizados de diferentes muestras) no se ha cambiado, porque el simple reemplazo de "peso atómico" por "masa atómica relativa" habría dado como resultado el término "peso atómico relativo estándar". masa."
Contenido relacionado
Carl bosch
Modelo atómico de Thomson
Fenotiazina
