Malaria
La malaria es una enfermedad infecciosa transmitida por mosquitos que afecta a humanos y otros animales. La malaria causa síntomas que típicamente incluyen fiebre, cansancio, vómitos y dolores de cabeza. En casos severos, puede causar ictericia, convulsiones, coma o la muerte. Los síntomas generalmente comienzan de diez a quince días después de haber sido picado por un mosquito infectado. Si no se trata adecuadamente, las personas pueden tener recurrencias de la enfermedad meses después. En aquellos que han sobrevivido recientemente a una infección, la reinfección suele causar síntomas más leves. Esta resistencia parcial desaparece durante meses o años si la persona no tiene una exposición continua a la malaria.
La malaria es causada por microorganismos unicelulares del grupo Plasmodium. Se transmite exclusivamente a través de la picadura de mosquitos Anopheles infectados. La picadura de mosquito introduce los parásitos de la saliva del mosquito en la sangre de una persona. Los parásitos viajan al hígado donde maduran y se reproducen. Cinco especies de Plasmodium pueden infectar y ser propagadas por humanos. La mayoría de las muertes son causadas por P. falciparum, mientras que P. vivax, P. ovale, y P. malariae generalmente causan una forma más leve de malaria. La especie P. knowlesi rara vez causa enfermedad en humanos. La malaria generalmente se diagnostica mediante el examen microscópico de sangre utilizando frotis de sangre o con pruebas de diagnóstico rápido basadas en antígenos. Se han desarrollado métodos que usan la reacción en cadena de la polimerasa para detectar el ADN del parásito, pero no se usan mucho en áreas donde la malaria es común, debido a su costo y complejidad.
El riesgo de enfermedad se puede reducir previniendo las picaduras de mosquitos mediante el uso de mosquiteros y repelentes de insectos o con medidas de control de mosquitos, como rociar insecticidas y drenar el agua estancada. Hay varios medicamentos disponibles para prevenir la malaria para los viajeros en áreas donde la enfermedad es común. Se recomiendan dosis ocasionales del medicamento combinado sulfadoxina/pirimetamina en bebés y después del primer trimestre del embarazo en áreas con altas tasas de malaria. A partir de 2020, hay una vacuna que ha demostrado reducir el riesgo de paludismo en aproximadamente un 40 % en los niños de África. Un estudio previo a la impresión de otra vacuna ha demostrado una eficacia de la vacuna del 77%, pero este estudio aún no ha pasado la revisión por pares. Se están realizando esfuerzos para desarrollar vacunas más eficaces. El tratamiento recomendado para la malaria es una combinación de medicamentos antipalúdicos que incluye artemisinina. El segundo medicamento puede ser mefloquina, lumefantrina o sulfadoxina/pirimetamina. Se puede usar quinina, junto con doxiciclina, si no se dispone de artemisinina. Se recomienda que en áreas donde la enfermedad es común, la malaria se confirme si es posible antes de comenzar el tratamiento debido a la preocupación por el aumento de la resistencia a los medicamentos. Se ha desarrollado resistencia entre los parásitos a varios medicamentos antipalúdicos; por ejemplo, P resistente a la cloroquina. falciparum se ha extendido a la mayoría de las áreas palúdicas y la resistencia a la artemisinina se ha convertido en un problema en algunas partes del sudeste asiático.
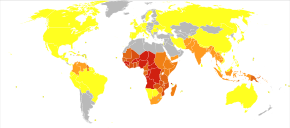
La enfermedad está muy extendida en las regiones tropicales y subtropicales que existen en una amplia banda alrededor del ecuador. Esto incluye gran parte del África subsahariana, Asia y América Latina. En 2020 hubo 241 millones de casos de paludismo en todo el mundo, lo que provocó unas 627 000 muertes. Aproximadamente el 95% de los casos y muertes ocurrieron en el África subsahariana. Las tasas de enfermedad han disminuido de 2010 a 2014, pero aumentaron de 2015 a 2020. La malaria se asocia comúnmente con la pobreza y tiene un efecto negativo significativo en el desarrollo económico. En África, se estima que genera pérdidas de 12 000 millones de dólares estadounidenses al año debido al aumento de los costos de atención médica, la pérdida de capacidad para trabajar y los efectos adversos en el turismo.
Signos y complicaciones
Los adultos con paludismo tienden a experimentar escalofríos y fiebre (clásicamente en episodios intensos periódicos que duran alrededor de seis horas, seguidos de un período de sudoración y alivio de la fiebre), así como dolor de cabeza, fatiga, malestar abdominal y dolor muscular. Los niños tienden a tener síntomas más generales: fiebre, tos, vómitos y diarrea.
Las manifestaciones iniciales de la enfermedad, comunes a todas las especies de paludismo, son similares a los síntomas de la gripe y pueden parecerse a otras afecciones, como sepsis, gastroenteritis y enfermedades virales. La presentación puede incluir dolor de cabeza, fiebre, escalofríos, dolor en las articulaciones, vómitos, anemia hemolítica, ictericia, hemoglobina en la orina, daño en la retina y convulsiones.
El síntoma clásico de la malaria es el paroxismo: una aparición cíclica de frío repentino seguido de escalofríos y luego fiebre y sudoración, que ocurre cada dos días (fiebre terciaria) en P. vivax y P. ovale infecciones, y cada tres días (fiebre cuartana) para P. malariae. P. falciparum puede causar fiebre recurrente cada 36 a 48 horas, o una fiebre menos pronunciada y casi continua.
Los síntomas generalmente comienzan entre 10 y 15 días después de la picadura inicial del mosquito, pero pueden ocurrir hasta varios meses después de la infección con algo de P. cepas vivax. Los viajeros que toman medicamentos preventivos contra la malaria pueden desarrollar síntomas una vez que dejan de tomarlos.
La malaria grave generalmente es causada por P. falciparum (a menudo denominada paludismo falciparum). Los síntomas del paludismo falciparum surgen entre 9 y 30 días después de la infección. Las personas con paludismo cerebral presentan con frecuencia síntomas neurológicos, que incluyen posturas anormales, nistagmo, parálisis de la mirada conjugada (incapacidad de los ojos para girar juntos en la misma dirección), opistótonos, convulsiones o coma.
Complicaciones
La malaria tiene varias complicaciones graves. Entre estos se encuentra el desarrollo de dificultad respiratoria, que ocurre hasta en el 25% de los adultos y en el 40% de los niños con P grave. falciparum paludismo. Las posibles causas incluyen la compensación respiratoria de la acidosis metabólica, el edema pulmonar no cardiogénico, la neumonía concomitante y la anemia grave. Aunque es raro en niños pequeños con paludismo grave, el síndrome de dificultad respiratoria aguda ocurre en 5 a 25% de los adultos y hasta en 29% de las mujeres embarazadas. La coinfección del VIH con la malaria aumenta la mortalidad. La insuficiencia renal es una característica de la fiebre de aguas negras, donde la hemoglobina de los glóbulos rojos lisados se filtra a la orina.
Infección por P. falciparum puede provocar paludismo cerebral, una forma de paludismo grave que implica encefalopatía. Se asocia con blanqueamiento de la retina, que puede ser un signo clínico útil para distinguir el paludismo de otras causas de fiebre. Se puede producir agrandamiento del bazo, agrandamiento del hígado o ambos, dolor de cabeza intenso, niveles bajos de azúcar en la sangre y hemoglobina en la orina con insuficiencia renal. Las complicaciones pueden incluir sangrado espontáneo, coagulopatía y shock.
La malaria en mujeres embarazadas es una causa importante de mortinatalidad, mortalidad infantil, aborto espontáneo y bajo peso al nacer, particularmente en P. falciparum, pero también con P. vivax.
Causa
La malaria es causada por la infección con parásitos del género Plasmodium. En humanos, la malaria es causada por seis especies de Plasmodium: P. falciparum, P. malariae, P. ovale curtisi, P. ovale wallikeri, P. vivax y P. knowlesi. Entre los infectados, P. falciparum es la especie más común identificada (~75 %), seguida de P. vivax (~20%). Aunque P. falciparum representa tradicionalmente la mayoría de las muertes, la evidencia reciente sugiere que P. vivax la malaria se asocia con condiciones potencialmente mortales con tanta frecuencia como con un diagnóstico de P. falciparum infección. P. vivax proporcionalmente es más común fuera de África. Se han documentado infecciones humanas con varias especies de Plasmodium de simios superiores; sin embargo, a excepción de P. knowlesi, una especie zoonótica que causa la malaria en los macacos, estos son en su mayoría de importancia limitada para la salud pública.
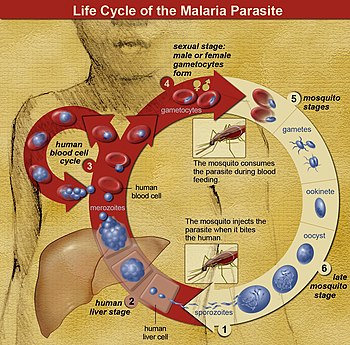
Los parásitos generalmente se introducen por la picadura de un mosquito Anopheles infectado. Lo que estos parásitos inoculados, llamados 'esporozoítos', hacen exactamente en la piel y los vasos linfáticos, aún no se ha determinado con precisión. Sin embargo, un porcentaje de esporozoítos siguen el torrente sanguíneo hasta el hígado, donde invaden los hepatocitos. Crecen y se dividen en el hígado durante 2 a 10 días, y cada hepatocito infectado finalmente alberga hasta 40 000 parásitos. Los hepatocitos infectados se degradan y liberan esta forma invasiva de células Plasmodium, denominadas "merozoitos" al torrente sanguíneo. En la sangre, los merozoítos invaden rápidamente los glóbulos rojos individuales y se replican durante 24 a 72 horas para formar de 16 a 32 merozoítos nuevos. Los glóbulos rojos infectados se lisan y los nuevos merozoítos infectan nuevos glóbulos rojos, lo que da como resultado un ciclo que aumenta continuamente la cantidad de parásitos en una persona infectada. Sin embargo, la mayoría de los P. vivax ahora se sabe (desde 2021) que la biomasa de merozoítos replicante está oculta en el bazo y la médula ósea (quizás también en otros lugares), lo que respalda la teoría astuta, de larga data (desde 2011) pero previamente ignorada de que los no circulantes los merozoítos son la fuente de muchos P. vivax recurrencias de paludismo (consulte la sección “Paludismo recurrente” a continuación). Durante las rondas de este ciclo de infección de glóbulos rojos en el torrente sanguíneo y en otros lugares, una pequeña porción de parásitos no se replica, sino que se convierte en parásitos en etapa sexual temprana llamados "gametocitos" masculinos y femeninos. Estos gametocitos se desarrollan en la médula ósea durante 11 días, luego regresan a la circulación sanguínea para esperar que los absorba la picadura de otro mosquito. Una vez dentro de un mosquito, los gametocitos se reproducen sexualmente y eventualmente forman esporozoitos hijos que migran a las glándulas salivales del mosquito para inyectarse en un nuevo huésped cuando el mosquito pica.
La infección del hígado no causa síntomas; todos los síntomas de la malaria resultan de la infección de los glóbulos rojos. Los síntomas se desarrollan una vez que hay más de 100 000 parásitos por mililitro de sangre. Muchos de los síntomas asociados con la malaria grave son causados por la tendencia de P. falciparum para unirse a las paredes de los vasos sanguíneos y dañar los vasos afectados y el tejido circundante. Los parásitos secuestrados en los vasos sanguíneos del pulmón contribuyen a la insuficiencia respiratoria. En el cerebro, contribuyen al coma. En la placenta contribuyen al bajo peso al nacer y al trabajo de parto prematuro, y aumentan el riesgo de aborto y muerte fetal. La destrucción de los glóbulos rojos durante la infección a menudo provoca anemia, exacerbada por la reducción de la producción de nuevos glóbulos rojos durante la infección.
Solo los mosquitos hembra se alimentan de sangre; los mosquitos machos se alimentan del néctar de las plantas y no transmiten la enfermedad. Las hembras del género de mosquitos Anopheles prefieren alimentarse por la noche. Por lo general, comienzan a buscar comida al anochecer y continúan durante la noche hasta que lo logran. Los parásitos de la malaria también pueden transmitirse por transfusiones de sangre, aunque esto es raro.
Paludismo recurrente
Los síntomas de la malaria pueden reaparecer después de varios períodos sin síntomas. Dependiendo de la causa, la recurrencia se puede clasificar como recrudecimiento, recaída o reinfección. El recrudecimiento es cuando los síntomas regresan después de un período sin síntomas y el origen son parásitos que sobrevivieron en la sangre como resultado de un tratamiento inadecuado o ineficaz. La recaída es cuando los síntomas reaparecen después de que los parásitos han sido eliminados de la sangre y la fuente de recurrencia son parásitos activados que habían persistido como hipnozoitos latentes en las células del hígado. La recaída comúnmente ocurre después de 8 a 24 semanas y a menudo se observa en P. vivax y P. ovale infecciones. Sin embargo, P. vivax es probable que las recurrencias se atribuyan en exceso a la activación de hipnozoítos. Algunos de ellos pueden tener un origen extravascular o merozoito secuestrado, haciendo que esas recurrencias sean recrudecimientos, no recaídas. Posibles fuentes contribuyentes recientemente reconocidas, no hipnozoítas, a la P periférica recurrente. vivax parasitemia son formas eritrocitarias en la médula ósea y el bazo. P. vivax los casos de malaria en áreas templadas a menudo implican la hibernación de los hipnozoítos, con recaídas que comienzan un año después de la picadura del mosquito. La reinfección significa que los parásitos responsables de la infección pasada fueron eliminados del cuerpo pero se introdujeron nuevos parásitos. La reinfección no se puede distinguir fácilmente de la recaída y el recrudecimiento, aunque la recurrencia de la infección dentro de las dos semanas posteriores al tratamiento de las manifestaciones palúdicas iniciales generalmente se atribuye al fracaso del tratamiento. Pero hacer esto no es necesariamente correcto. Las personas pueden desarrollar cierta inmunidad cuando se exponen a infecciones frecuentes.
Fisiopatología
La infección por paludismo se desarrolla a través de dos fases: una que involucra al hígado (fase exoeritrocítica) y otra que involucra a los glóbulos rojos o eritrocitos (fase eritrocítica). Cuando un mosquito infectado perfora la piel de una persona para alimentarse de sangre, los esporozoítos de la saliva del mosquito ingresan al torrente sanguíneo y migran al hígado, donde infectan los hepatocitos y se multiplican de forma asexual y asintomática durante un período de 8– 30 dias.
Después de un posible período de inactividad en el hígado, estos organismos se diferencian para producir miles de merozoítos que, luego de la ruptura de sus células huésped, escapan a la sangre e infectan los glóbulos rojos para comenzar la etapa eritrocítica del ciclo de vida. El parásito escapa del hígado sin ser detectado envolviéndose en la membrana celular de la célula hepática huésped infectada.
Dentro de los glóbulos rojos, los parásitos se multiplican aún más, nuevamente de forma asexual, saliendo periódicamente de sus células anfitrionas para invadir glóbulos rojos frescos. Se producen varios de estos ciclos de amplificación. Por lo tanto, las descripciones clásicas de olas de fiebre surgen de olas simultáneas de merozoítos que escapan e infectan los glóbulos rojos.
Algunas P. vivax los esporozoitos no se convierten inmediatamente en merozoitos en fase exoeritrocítica, sino que producen hipnozoitos que permanecen latentes durante períodos que van desde varios meses (7 a 10 meses es típico) hasta varios años. Después de un período de latencia, se reactivan y producen merozoítos. Los hipnozoítos son responsables de la incubación prolongada y las recaídas tardías en P. vivax infecciones, aunque su existencia en P. ovale es incierto.
El parásito está relativamente protegido del ataque del sistema inmunitario del cuerpo porque durante la mayor parte de su ciclo de vida humano reside dentro del hígado y las células sanguíneas y es relativamente invisible para la vigilancia inmunitaria. Sin embargo, las células sanguíneas infectadas circulantes se destruyen en el bazo. Para evitar este destino, el P. falciparum muestra proteínas adhesivas en la superficie de las células sanguíneas infectadas, lo que hace que las células sanguíneas se adhieran a las paredes de los vasos sanguíneos pequeños, impidiendo así que el parásito pase a través de la circulación general y el bazo. El bloqueo de la microvasculatura causa síntomas como los de la malaria placentaria. Los glóbulos rojos secuestrados pueden romper la barrera hematoencefálica y causar paludismo cerebral.
Resistencia genética
Según una revisión de 2005, debido a los altos niveles de mortalidad y morbilidad causados por la malaria, especialmente la P. falciparum, ha ejercido la mayor presión selectiva sobre el genoma humano en la historia reciente. Varios factores genéticos le brindan cierta resistencia, incluidos el rasgo de células falciformes, los rasgos de talasemia, la deficiencia de glucosa-6-fosfato deshidrogenasa y la ausencia de antígenos de Duffy en los glóbulos rojos.
El impacto del rasgo de células falciformes en la inmunidad contra la malaria ilustra algunas compensaciones evolutivas que han ocurrido debido a la malaria endémica. El rasgo de células falciformes provoca un cambio en la molécula de hemoglobina en la sangre. Normalmente, los glóbulos rojos tienen una forma bicóncava muy flexible que les permite moverse a través de capilares estrechos; sin embargo, cuando las moléculas de hemoglobina S modificada se exponen a cantidades bajas de oxígeno o se amontonan debido a la deshidratación, pueden unirse formando hebras que hacen que la célula se distorsione en forma de hoz curva. En estas hebras, la molécula no es tan efectiva para tomar o liberar oxígeno, y la célula no es lo suficientemente flexible para circular libremente. En las primeras etapas de la malaria, el parásito puede hacer que los glóbulos rojos infectados se vuelvan falciformes, por lo que se eliminan antes de la circulación. Esto reduce la frecuencia con la que los parásitos de la malaria completan su ciclo de vida en la célula. Las personas que son homocigotas (con dos copias del alelo beta de hemoglobina anormal) tienen anemia de células falciformes, mientras que las que son heterocigotas (con un alelo anormal y un alelo normal) experimentan resistencia a la malaria sin anemia grave. Aunque la expectativa de vida más corta para aquellos con la condición homocigota tendería a desfavorecer la supervivencia del rasgo, el rasgo se conserva en las regiones propensas a la malaria debido a los beneficios proporcionados por la forma heterocigota.
Disfunción hepática
La disfunción hepática como resultado de la malaria es poco común y, por lo general, solo ocurre en personas con otra afección hepática, como hepatitis viral o enfermedad hepática crónica. El síndrome a veces se denomina hepatitis palúdica. Si bien se ha considerado una ocurrencia rara, la hepatopatía palúdica ha experimentado un aumento, particularmente en el sudeste asiático y la India. El compromiso hepático en personas con paludismo se correlaciona con una mayor probabilidad de complicaciones y muerte.
Diagnóstico
Debido a la naturaleza no específica de los síntomas de la malaria, el diagnóstico generalmente se sospecha en función de los síntomas y el historial de viaje, y luego se confirma con una prueba de laboratorio para detectar la presencia del parásito en la sangre (prueba parasitológica). En áreas donde la malaria es común, la Organización Mundial de la Salud (OMS) recomienda que los médicos sospechen malaria en cualquier persona que informe tener fiebre o que tenga una temperatura actual superior a 37,5 °C sin ninguna otra causa obvia. La malaria debe sospecharse en niños con signos de anemia: palmas pálidas o una prueba de laboratorio que muestre niveles de hemoglobina por debajo de 8 gramos por decilitro de sangre. En áreas del mundo con poca o ninguna malaria, la OMS recomienda solo evaluar a personas con posible exposición a la malaria (generalmente viajan a un área endémica de malaria) y fiebre inexplicable.
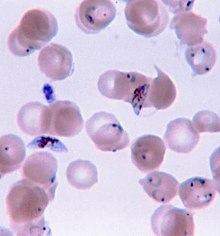
La malaria generalmente se confirma mediante el examen microscópico de extensiones de sangre o mediante pruebas de diagnóstico rápido (RDT) basadas en antígenos. La microscopía, es decir, examinar sangre teñida con Giemsa con un microscopio óptico, es el estándar de oro para el diagnóstico de la malaria. Los microscopistas suelen examinar tanto una "película gruesa" de sangre, lo que les permite escanear muchas células sanguíneas en poco tiempo, y una "película delgada" de sangre, lo que les permite ver claramente los parásitos individuales e identificar las especies de Plasmodium infectantes. Bajo condiciones típicas de laboratorio de campo, un microscopista puede detectar parásitos cuando hay al menos 100 parásitos por microlitro de sangre, que está alrededor del rango más bajo de infección sintomática. El diagnóstico microscópico es relativamente intensivo en recursos, requiere personal capacitado, equipo específico, electricidad y un suministro constante de portaobjetos y colorantes de microscopía.
En lugares donde no se dispone de microscopía, la malaria se diagnostica con RDT, pruebas rápidas de antígenos que detectan proteínas del parásito en una muestra de sangre por punción digital. Hay una variedad de RDT disponibles comercialmente, dirigidas a las proteínas del parásito proteína 2 rica en histidina (HRP2, detecta P. falciparum solamente), lactato deshidrogenasa o aldolasa. La prueba HRP2 se usa ampliamente en África, donde P. falciparum predomina. Sin embargo, dado que HRP2 persiste en la sangre hasta cinco semanas después de que se trata una infección, una prueba de HRP2 a veces no puede distinguir si alguien tiene actualmente malaria o la tuvo anteriormente. Además, algunos P. falciparum en la región amazónica carecen del gen HRP2, lo que complica su detección. Los RDT se implementan rápida y fácilmente en lugares sin laboratorios de diagnóstico completos. Sin embargo, brindan mucha menos información que la microscopía y, a veces, varían en calidad de un productor a otro y de un lote a otro.
Se han desarrollado pruebas serológicas para detectar anticuerpos contra Plasmodium en la sangre, pero no se utilizan para el diagnóstico de la malaria debido a su sensibilidad y especificidad relativamente bajas. Se han desarrollado pruebas de amplificación de ácidos nucleicos de alta sensibilidad, pero no se usan clínicamente debido a su costo relativamente alto y poca especificidad para infecciones activas.
Clasificación
La malaria se clasifica en "grave" o "sin complicaciones" por la Organización Mundial de la Salud (OMS). Se considera grave cuando cualquiera de los siguientes criterios están presentes, de lo contrario se considera sin complicaciones.
- Conciencia disminuyeda
- Debilidad significativa tal que la persona no pueda caminar
- Incapacidad de alimentar
- Dos o más convulsiones
- Presión arterial baja (menos de 70 mmHg en adultos y 50 mmHg en niños)
- Problemas respiratorios
- shock circulatorio
- Insuficiencia renal o hemoglobina en la orina
- Problemas de sangrado, o hemoglobina menos de 50 g/L (5 g/dL)
- Edema pulmonar
- glucosa sanguínea inferior a 2.2 mmol/L (40 mg/dL)
- Acidosis o niveles de lactancia superiores a 5 mmol/L
- Nivel parásito en la sangre de más de 100.000 por microlitro (μL) en áreas de transmisión de baja intensidad, o 250.000 por μL en áreas de transmisión de alta intensidad
La malaria cerebral se define como una P. falciparum-malaria que se presenta con síntomas neurológicos, incluido el coma (con una escala de coma de Glasgow inferior a 11 o una escala de coma de Blantyre inferior a 3), o con un coma que dura más de 30 minutos después de una convulsión.
Prevención
Los métodos utilizados para prevenir la malaria incluyen medicamentos, eliminación de mosquitos y prevención de picaduras. A partir de 2020, existe una vacuna contra la malaria (conocida como RTS,S) cuyo uso está autorizado. La presencia de malaria en un área requiere una combinación de alta densidad de población humana, alta densidad de población de mosquitos Anopheles y altas tasas de transmisión de humanos a mosquitos y de mosquitos a humanos. Si alguno de estos se reduce lo suficiente, el parásito eventualmente desaparece de esa área, como sucedió en América del Norte, Europa y partes del Medio Oriente. Sin embargo, a menos que el parásito sea eliminado de todo el mundo, podría restablecerse si las condiciones vuelven a una combinación que favorezca la reproducción del parásito. Además, el costo por persona de eliminar los mosquitos anofeles aumenta con la disminución de la densidad de población, lo que lo hace económicamente inviable en algunas áreas.
La prevención de la malaria puede ser más rentable que el tratamiento de la enfermedad a largo plazo, pero los costos iniciales necesarios están fuera del alcance de muchas de las personas más pobres del mundo. Existe una gran diferencia en los costos de control (es decir, mantenimiento de baja endemicidad) y programas de eliminación entre países. Por ejemplo, en China, cuyo gobierno anunció en 2010 una estrategia para buscar la eliminación de la malaria en las provincias chinas, la inversión requerida es una pequeña proporción del gasto público en salud. Por el contrario, un programa similar en Tanzania costaría aproximadamente una quinta parte del presupuesto de salud pública. En 2021, la Organización Mundial de la Salud confirma que China ha eliminado la malaria.
En áreas donde la malaria es común, los niños menores de cinco años a menudo tienen anemia, que a veces se debe a la malaria. Administrar a los niños con anemia en estas áreas medicamentos antipalúdicos preventivos mejora ligeramente los niveles de glóbulos rojos, pero no afecta el riesgo de muerte o la necesidad de hospitalización.
Control de mosquitos
El control de vectores se refiere a los métodos utilizados para disminuir la malaria al reducir los niveles de transmisión por mosquitos. Para la protección individual, los repelentes de insectos más eficaces son los basados en DEET o picaridina. Sin embargo, no hay pruebas suficientes de que los repelentes de mosquitos puedan prevenir la infección por paludismo. Los mosquiteros tratados con insecticida (MTI) y la fumigación de interiores con efecto residual (IRS) son efectivos, se han usado comúnmente para prevenir la malaria y su uso ha contribuido significativamente a la disminución de la malaria en el siglo XXI. Es posible que los MTI y el RRI no sean suficientes para eliminar la enfermedad, ya que estas intervenciones dependen de cuántas personas usen mosquiteros, cuántas lagunas haya en el insecticida (áreas de baja cobertura), si las personas no están protegidas cuando están fuera del hogar y un aumento en mosquitos que son resistentes a los insecticidas. Las modificaciones en las casas de las personas para evitar la exposición a los mosquitos pueden ser una importante medida de prevención a largo plazo.
Mallas tratadas con insecticida
Los mosquiteros ayudan a mantener a los mosquitos alejados de las personas y reducen las tasas de infección y la transmisión de la malaria. Los mosquiteros no son una barrera perfecta y, a menudo, se tratan con un insecticida diseñado para matar al mosquito antes de que tenga tiempo de encontrar la manera de pasar el mosquitero. Se estima que los mosquiteros tratados con insecticida (MTI) son dos veces más efectivos que los mosquiteros no tratados y ofrecen más del 70% de protección en comparación con ningún mosquitero. Entre 2000 y 2008, el uso de MTI salvó la vida de unos 250 000 niños en el África subsahariana. Alrededor del 13 % de los hogares en los países subsaharianos tenían MTI en 2007 y se estimaba que el 31 % de los hogares africanos tenían al menos un MTI en 2008. En 2000, 1,7 millones (1,8 %) de niños africanos que vivían en áreas del mundo donde la malaria es común que estuvieran protegidos por un MTI. Ese número aumentó a 20,3 millones (18,5 %) de niños africanos que usaban MTI en 2007, dejando a 89,6 millones de niños sin protección y a 68 % de niños africanos que usaban mosquiteros en 2015. La mayoría de los mosquiteros están impregnados con piretroides, una clase de insecticidas con baja toxicidad. Son más efectivos cuando se usan desde el anochecer hasta el amanecer. Se recomienda colgar un gran "mosquitero" sobre el centro de una cama y meta los bordes debajo del colchón o asegúrese de que sea lo suficientemente grande como para que toque el suelo. Los MTI son beneficiosos para los resultados del embarazo en regiones endémicas de malaria en África, pero se necesitan más datos en Asia y América Latina.
En áreas de alta resistencia a la malaria, el butóxido de piperonilo (PBO) combinado con piretroides en mosquiteros es eficaz para reducir las tasas de infección por malaria. Quedan dudas sobre la durabilidad del PBO en los mosquiteros, ya que el impacto en la mortalidad de los mosquitos no se mantuvo después de veinte lavados en ensayos experimentales.
Pulverización residual en interiores
La fumigación residual interior es la fumigación de insecticidas en las paredes dentro de una casa. Después de alimentarse, muchos mosquitos descansan en una superficie cercana mientras digieren la harina de sangre, por lo que si las paredes de las casas han sido cubiertas con insecticidas, los mosquitos que descansan pueden morir antes de que puedan picar a otra persona y transferir el parásito de la malaria. A partir de 2006, la Organización Mundial de la Salud recomienda 12 insecticidas en las operaciones del IRS, incluido el DDT y los piretroides ciflutrina y deltametrina. Este uso de salud pública de pequeñas cantidades de DDT está permitido por el Convenio de Estocolmo, que prohíbe su uso agrícola. Un problema con todas las formas de IRS es la resistencia a los insecticidas. Los mosquitos afectados por el IRS tienden a descansar y vivir en el interior, y debido a la irritación que causan las fumigaciones, sus descendientes tienden a descansar y vivir al aire libre, por lo que son menos afectados por el IRS. Comunidades que utilizan mosquiteros tratados con insecticida, además de la fumigación de interiores con residuos 'no similares a los piretroides' los insecticidas encontraron reducciones asociadas en la malaria. Además, el uso de 'similares a los piretroides' los insecticidas además de la fumigación de interiores con efecto residual no dieron como resultado un beneficio adicional detectable en las comunidades que usaban mosquiteros tratados con insecticida.
Modificaciones de viviendas
La vivienda es un factor de riesgo para la malaria y modificar la casa como medida de prevención puede ser una estrategia sostenible que no dependa de la eficacia de insecticidas como los piretroides. El entorno físico dentro y fuera del hogar que puede mejorar la densidad de mosquitos son consideraciones. Ejemplos de posibles modificaciones incluyen qué tan cerca está la casa de los criaderos de mosquitos, drenaje y suministro de agua cerca de la casa, disponibilidad de sitios de descanso para mosquitos (vegetación alrededor de la casa), proximidad al ganado y animales domésticos, y mejoras físicas o modificaciones a el diseño de la vivienda para evitar la entrada de mosquitos.
Otros métodos de control de mosquitos
La gente ha probado otros métodos para reducir las picaduras de mosquitos y retrasar la propagación de la malaria. Los esfuerzos para disminuir las larvas de mosquitos al disminuir la disponibilidad de aguas abiertas donde se desarrollan, o al agregar sustancias para disminuir su desarrollo, son efectivos en algunos lugares. Los dispositivos electrónicos repelentes de mosquitos, que emiten sonidos de muy alta frecuencia que se supone que mantienen alejados a los mosquitos hembra, no tienen evidencia que respalde su efectividad. Hay evidencia de certeza baja de que la nebulización puede tener un efecto sobre la transmisión de la malaria. La aplicación manual de larvicidas con insecticidas químicos o microbianos en cuerpos de agua que contienen una baja distribución de larvas puede reducir la transmisión de la malaria. No hay evidencia suficiente para determinar si los peces larvívoros pueden disminuir la densidad y transmisión de mosquitos en el área.
Medicamentos
Hay una serie de medicamentos que pueden ayudar a prevenir o interrumpir la malaria en viajeros a lugares donde la infección es común. Muchos de estos medicamentos también se utilizan en el tratamiento. En lugares donde Plasmodium es resistente a uno o más medicamentos, se usan con frecuencia tres medicamentos (mefloquina, doxiciclina o la combinación de atovacuona/proguanil (Malarone)) para la prevención. La doxiciclina y la atovacuona/proguanil se toleran mejor mientras que la mefloquina se toma una vez a la semana. Las áreas del mundo con malaria sensible a la cloroquina son poco comunes. La administración masiva de medicamentos antipalúdicos a toda una población al mismo tiempo puede reducir el riesgo de contraer malaria en la población, sin embargo, la eficacia de la administración masiva de medicamentos puede variar según la prevalencia de la malaria en el área. Otros factores, como la administración de medicamentos más otras medidas de protección, como el control de mosquitos, la proporción de personas tratadas en el área y el riesgo de reinfección con malaria pueden desempeñar un papel en la efectividad de los enfoques de tratamiento farmacológico masivo.
El efecto protector no comienza de inmediato, y las personas que visitan áreas donde existe malaria generalmente comienzan a tomar los medicamentos una o dos semanas antes de llegar y continúan tomándolos durante cuatro semanas después de irse (excepto atovacuona/proguanil, que solo necesita debe comenzar dos días antes y continuar durante siete días después). El uso de medicamentos preventivos a menudo no es práctico para quienes viven en áreas donde existe malaria, y su uso generalmente se da solo a mujeres embarazadas y visitantes de corto plazo. Esto se debe al costo de los medicamentos, los efectos secundarios del uso a largo plazo y la dificultad de obtener medicamentos antipalúdicos fuera de las naciones ricas. Durante el embarazo, se ha descubierto que los medicamentos para prevenir la malaria mejoran el peso del bebé al nacer y disminuyen el riesgo de anemia en la madre. El uso de medicamentos preventivos en presencia de mosquitos portadores de la malaria puede fomentar el desarrollo de resistencia parcial.
Administrar medicamentos antipalúdicos a los bebés a través de una terapia preventiva intermitente puede reducir el riesgo de infección por paludismo, hospitalización y anemia.
La mefloquina es más eficaz que la sulfadoxina-pirimetamina para prevenir la malaria en mujeres embarazadas sin VIH. El cotrimoxazol es eficaz para prevenir la infección por paludismo y reducir el riesgo de anemia en mujeres con VIH. Administrar sulfadoxina-pirimetamina en tres o más dosis como terapia preventiva intermitente es superior a dos dosis para las mujeres con VIH que viven en áreas endémicas de malaria.
El tratamiento oportuno de los casos confirmados con terapias combinadas basadas en artemisinina (ACT) también puede reducir la transmisión.
Otros
Las estrategias de participación comunitaria y educación sanitaria que promueven la concienciación sobre la malaria y la importancia de las medidas de control se han utilizado con éxito para reducir la incidencia de la malaria en algunas áreas del mundo en desarrollo. Reconocer la enfermedad en las primeras etapas puede evitar que se vuelva fatal. La educación también puede informar a las personas para que cubran las áreas de agua estancada y quieta, como los tanques de agua que son caldos de cultivo ideales para el parásito y el mosquito, reduciendo así el riesgo de transmisión entre personas. Esto se usa generalmente en áreas urbanas donde hay grandes centros de población en un espacio confinado y la transmisión sería más probable en estas áreas. La terapia preventiva intermitente es otra intervención que se ha utilizado con éxito para controlar la malaria en mujeres embarazadas y lactantes, y en niños en edad preescolar donde la transmisión es estacional.
Tratamiento
La malaria se trata con medicamentos antipalúdicos; los que se usan dependen del tipo y la gravedad de la enfermedad. Si bien los medicamentos contra la fiebre se usan comúnmente, sus efectos sobre los resultados no están claros. Proporcionar medicamentos antipalúdicos gratuitos a los hogares puede reducir las muertes infantiles cuando se usan adecuadamente. Los programas que presuntamente tratan todas las causas de fiebre con medicamentos antipalúdicos pueden dar lugar a un uso excesivo de antipalúdicos y tratar de forma insuficiente otras causas de fiebre. Sin embargo, el uso de kits de diagnóstico rápido de malaria puede ayudar a reducir el uso excesivo de antipalúdicos.
Paludismo no complicado
La malaria simple o sin complicaciones se puede tratar con medicamentos orales. Los medicamentos de artemisinina son efectivos y seguros en el tratamiento de la malaria no complicada. La artemisinina en combinación con otros antipalúdicos (conocidos como terapia de combinación de artemisinina o ACT) tiene una eficacia de alrededor del 90 % cuando se usa para tratar la malaria no complicada. El tratamiento más efectivo para P. falciparum es el uso de ACT, que disminuye la resistencia a cualquier componente individual del fármaco. El arteméter-lumefantrina (régimen de seis dosis) es más eficaz que el arteméter-lumefantrina (régimen de cuatro dosis) u otros regímenes que no contienen derivados de la artemisinina en el tratamiento del paludismo falciparum. Otra combinación recomendada es dihidroartemisinina y piperaquina. La terapia combinada de artemisinina y naftoquina mostró resultados prometedores en el tratamiento de la malaria falciparum. Sin embargo, se necesita más investigación para establecer su eficacia como un tratamiento confiable. El artesunato más mefloquina funciona mejor que la mefloquina sola en el tratamiento de la malaria falciparum no complicada en entornos de baja transmisión. La atovacuona-proguanil es eficaz contra falciparum sin complicaciones con una posible tasa de fracaso del 5% al 10%; la adición de artesunato puede reducir la tasa de fracaso. La monoterapia o la terapia combinada con azitromicina no ha demostrado eficacia en el tratamiento de la malaria por Plasmodium o vivax. La amodiaquina más sulfadoxina-pirimetamina puede lograr menos fracasos del tratamiento en comparación con la sulfadoxina-pirimetamina sola en el paludismo falciparum no complicado. No hay datos suficientes sobre el clorproguanil-dapsona en el tratamiento del paludismo falciparum no complicado. La adición de primaquina con terapia combinada basada en artemisinina para la malaria falciparum reduce su transmisión en los días 3-4 y 8 de la infección. La sulfadoxina-pirimetamina más artesunato es mejor que la sulfadoxina-pirimetamina más amodiaquina para controlar el fracaso del tratamiento el día 28. Sin embargo, la última es mejor que la primera para reducir los gametocitos en sangre el día 7.
Infección por P. vivax, P. ovale o P. malariae por lo general no requiere hospitalización. Tratamiento de P. vivax requiere tanto la eliminación de las etapas sanguíneas (usando una terapia combinada basada en cloroquina o artemisinina) como la eliminación de las formas hepáticas con un agente de 8-aminoquinolina como la primaquina o la tafenoquina.
La opinión convencional es que los medicamentos con 8-aminoquinolina matan los parásitos en el hígado. Sin embargo, hay razones para creer que la primaquina podría, en un grado actualmente desconocido, también inactivar los merozoítos extrahepáticos no circulantes (se espera que pronto haya claridad al respecto).
Para tratar la malaria durante el embarazo, la OMS recomienda el uso de quinina más clindamicina al principio del embarazo (primer trimestre) y ACT en etapas posteriores (segundo y tercer trimestre). Hay datos de seguridad limitados sobre los medicamentos antipalúdicos en el embarazo.
Paludismo grave y complicado
Los casos de malaria severa y complicada casi siempre son causados por infección con P. falciparum. Las otras especies por lo general sólo causan enfermedad febril. Los casos graves y complicados de malaria son emergencias médicas ya que las tasas de mortalidad son altas (10% a 50%).
El tratamiento recomendado para la malaria grave es el uso intravenoso de medicamentos antipalúdicos. Para la malaria grave, el artesunato parenteral fue superior a la quinina tanto en niños como en adultos. En otra revisión sistemática, los derivados de la artemisinina (arteméter y arteéter) fueron tan eficaces como la quinina en el tratamiento de la malaria cerebral en niños. El tratamiento de la malaria grave implica medidas de apoyo que se realizan mejor en una unidad de cuidados intensivos. Esto incluye el manejo de fiebres altas y las convulsiones que pueden resultar de ello. También incluye el control del esfuerzo respiratorio deficiente, niveles bajos de azúcar en la sangre y niveles bajos de potasio en la sangre. Los derivados de la artemisinina tienen la misma o mejor eficacia que las quinolonas en la prevención de muertes en casos de paludismo grave o complicado. La dosis de carga de quinina ayuda a acortar la duración de la fiebre y aumenta la eliminación de parásitos del cuerpo. No hay diferencia en la efectividad cuando se usa quinina intrarrectal en comparación con quinina intravenosa o intramuscular en el tratamiento del paludismo falciparum no complicado/complicado. No hay pruebas suficientes sobre el arteéter intramuscular para tratar el paludismo grave. La administración de artesunato rectal antes del traslado al hospital puede reducir la tasa de mortalidad de los niños con paludismo grave. En niños con paludismo e hipoglucemia concomitante, la administración sublingual de glucosa parece producir mejores aumentos del azúcar en sangre después de 20 minutos en comparación con la administración oral, según datos muy limitados.
La malaria cerebral es la forma de malaria grave y complicada con los peores síntomas neurológicos. No hay datos suficientes sobre si los agentes osmóticos como el manitol o la urea son efectivos en el tratamiento de la malaria cerebral. El fenobarbital de rutina en la malaria cerebral se asocia con menos convulsiones pero posiblemente con más muertes. No hay evidencia de que los esteroides aporten beneficios al tratamiento de la malaria cerebral.
Manejo de la malaria cerebral
La malaria cerebral generalmente hace que el paciente entre en coma; si la causa del coma está en duda, se deben realizar pruebas para detectar otras causas de encefalopatía predominantes localmente (infección bacteriana, viral o fúngica). En áreas donde hay una alta prevalencia de infección por paludismo (p. ej., regiones tropicales), el tratamiento puede comenzar sin realizar primero una prueba. Para manejar la malaria cerebral cuando se confirma, se puede hacer lo siguiente:
- Los pacientes en coma deben recibir cuidados meticulosos de enfermería (señales vitales del monitor, pacientes cada 2 horas, evitar mentir al paciente en una cama húmeda, etc.)
- Se debe insertar un catéter uretral estéril para ayudar a orinar
- Para aspirar el contenido del estómago, se debe insertar un tubo nasogástrico estéril.
- Con motivo de convulsiones se administra una lenta inyección intravenosa de benzodiazepina.
No hay pruebas suficientes para demostrar que la transfusión de sangre es útil para reducir las muertes de niños con anemia grave o para mejorar su hematocrito en un mes. No hay pruebas suficientes de que los agentes quelantes del hierro, como la deferoxamina y la deferiprona, mejoren los resultados de los pacientes con infección por paludismo falciparum.
Resistencia
La resistencia a los medicamentos plantea un problema creciente en el tratamiento de la malaria del siglo XXI. En la década de 2000 (década), surgió la malaria con resistencia parcial a las artemisinas en el sudeste asiático. La resistencia ahora es común contra todas las clases de medicamentos antipalúdicos, excepto las artemisininas. El tratamiento de cepas resistentes se volvió cada vez más dependiente de esta clase de fármacos. El costo de las artemisininas limita su uso en el mundo en desarrollo. Las cepas de malaria que se encuentran en la frontera entre Camboya y Tailandia son resistentes a las terapias combinadas que incluyen artemisininas y, por lo tanto, pueden ser intratables. La exposición de la población de parásitos a monoterapias con artemisinina en dosis subterapéuticas durante más de 30 años y la disponibilidad de artemisininas de calidad inferior probablemente impulsaron la selección del fenotipo resistente. Se ha detectado resistencia a la artemisinina en Camboya, Myanmar, Tailandia y Vietnam, y ha surgido resistencia en Laos. La resistencia a la combinación de artemisinina y piperaquina se detectó por primera vez en 2013 en Camboya, y para 2019 se había extendido por Camboya y Laos, Tailandia y Vietnam (con hasta el 80 % de los parásitos de la malaria resistentes en algunas regiones).
No hay pruebas suficientes en los medicamentos antipalúdicos envasados en unidades para prevenir los fracasos del tratamiento de la infección por paludismo. Sin embargo, si se respalda con la capacitación de los proveedores de atención médica y la información del paciente, hay una mejora en el cumplimiento de quienes reciben el tratamiento.
Pronóstico
Cuando se les trata adecuadamente, las personas con paludismo generalmente pueden esperar una recuperación completa. Sin embargo, la malaria grave puede progresar extremadamente rápido y causar la muerte en cuestión de horas o días. En los casos más graves de la enfermedad, las tasas de mortalidad pueden alcanzar el 20 %, incluso con cuidados y tratamiento intensivos. A más largo plazo, se han documentado alteraciones del desarrollo en niños que han tenido episodios de paludismo grave. La infección crónica sin enfermedad grave puede ocurrir en un síndrome de inmunodeficiencia asociado con una disminución de la capacidad de respuesta a la bacteria Salmonella y al virus Epstein-Barr.
Durante la niñez, la malaria causa anemia durante un período de rápido desarrollo cerebral y también daño cerebral directo como resultado de la malaria cerebral. Algunos sobrevivientes de paludismo cerebral tienen un mayor riesgo de déficits neurológicos y cognitivos, trastornos del comportamiento y epilepsia. Se demostró que la profilaxis de la malaria mejora la función cognitiva y el rendimiento escolar en ensayos clínicos en comparación con los grupos de placebo.
Epidemiología
La OMS estima que en 2019 hubo 229 millones de nuevos casos de paludismo que resultaron en 409 000 muertes. Los niños menores de 5 años son los más afectados, representando el 67 % de las muertes por paludismo en todo el mundo en 2019. Alrededor de 125 millones de mujeres embarazadas corren el riesgo de infectarse cada año; En el África subsahariana, la malaria materna está asociada con hasta 200 000 muertes infantiles estimadas al año. Hay alrededor de 10 000 casos de paludismo por año en Europa occidental y entre 1300 y 1500 en los Estados Unidos. Estados Unidos erradicó la malaria como un importante problema de salud pública en 1951, aunque persisten pequeños brotes. Alrededor de 900 personas murieron a causa de la enfermedad en Europa entre 1993 y 2003. Tanto la incidencia mundial de la enfermedad como la mortalidad resultante han disminuido en los últimos años. Según la OMS y UNICEF, las muertes atribuibles a la malaria en 2015 se redujeron en un 60 % desde una estimación de 985 000 en 2000, en gran parte debido al uso generalizado de mosquiteros tratados con insecticida y terapias combinadas a base de artemisinina. En 2012 hubo 207 millones de casos de paludismo. Ese año, se estima que la enfermedad mató entre 473.000 y 789.000 personas, muchas de las cuales eran niños en África. Los esfuerzos para disminuir la enfermedad en África desde el año 2000 han sido parcialmente efectivos, y se estima que las tasas de la enfermedad se redujeron en un cuarenta por ciento en el continente.
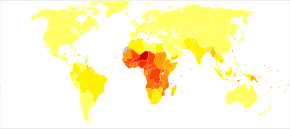
Actualmente, la malaria es endémica en una amplia franja alrededor del ecuador, en áreas de las Américas, muchas partes de Asia y gran parte de África; en el África subsahariana, se produce entre el 85 y el 90 % de las muertes por paludismo. Una estimación para 2009 informó que los países con la tasa de mortalidad más alta por cada 100.000 habitantes eran Costa de Marfil (86,15), Angola (56,93) y Burkina Faso (50,66). Una estimación de 2010 indicó que los países más mortíferos por población eran Burkina Faso, Mozambique y Malí. El Proyecto Malaria Atlas tiene como objetivo mapear los niveles globales de malaria, proporcionando una forma de determinar los límites espaciales globales de la enfermedad y evaluar la carga de la enfermedad. Este esfuerzo condujo a la publicación de un mapa de P. falciparum endemicidad en 2010 y una actualización en 2019. A partir de 2010, alrededor de 100 países tienen malaria endémica. Cada año, 125 millones de viajeros internacionales visitan estos países y más de 30 000 contraen la enfermedad.
La distribución geográfica de la malaria dentro de grandes regiones es compleja, y las áreas afectadas y libres de malaria a menudo se encuentran cerca unas de otras. La malaria prevalece en las regiones tropicales y subtropicales debido a las lluvias, las altas temperaturas constantes y la alta humedad, junto con las aguas estancadas donde las larvas de mosquitos maduran fácilmente, brindándoles el entorno que necesitan para reproducirse continuamente. En áreas más secas, los brotes de malaria se han pronosticado con una precisión razonable mediante el mapeo de las precipitaciones. La malaria es más común en las zonas rurales que en las ciudades. Por ejemplo, varias ciudades en la subregión del Gran Mekong del Sudeste Asiático están esencialmente libres de malaria, pero la enfermedad prevalece en muchas regiones rurales, incluso a lo largo de fronteras internacionales y bordes de bosques. Por el contrario, la malaria en África está presente tanto en áreas rurales como urbanas, aunque el riesgo es menor en las ciudades más grandes.
Cambio climático
Es probable que el cambio climático afecte la transmisión de la malaria, pero el grado de efecto y las áreas afectadas son inciertos. Una mayor precipitación en ciertas áreas de la India y después de un evento de El Niño se asocia con un mayor número de mosquitos.
Desde 1900 ha habido cambios sustanciales en la temperatura y las precipitaciones en África. Sin embargo, los factores que contribuyen a que las lluvias se conviertan en agua para la reproducción de mosquitos son complejos e incluyen, por ejemplo, la medida en que se absorbe en el suelo y la vegetación, o las tasas de escorrentía y evaporación. Investigaciones recientes han proporcionado una imagen más detallada de las condiciones en África, combinando un modelo de idoneidad climática para la malaria con un modelo a escala continental que representa los procesos hidrológicos del mundo real.
Historia
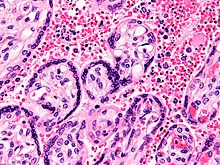
Aunque el parásito responsable de P. falciparum ha existido durante 50.000 a 100.000 años, el tamaño de la población del parásito no aumentó hasta hace unos 10.000 años, al mismo tiempo que los avances en la agricultura y el desarrollo de los asentamientos humanos. Los parientes cercanos de los parásitos de la malaria humana siguen siendo comunes en los chimpancés. Algunas evidencias sugieren que el P. falciparum la malaria puede haberse originado en los gorilas.
Las referencias a las fiebres periódicas únicas de la malaria se encuentran a lo largo de la historia. Hipócrates describió las fiebres periódicas, etiquetándolas como tercianas, cuartanas, subtercianas y cotidianas. La Columella romana asoció la enfermedad con insectos de los pantanos. La malaria puede haber contribuido al declive del Imperio Romano y estaba tan extendida en Roma que se la conocía como la "fiebre romana". Varias regiones de la antigua Roma se consideraban en riesgo de contraer la enfermedad debido a las condiciones favorables presentes para los vectores de la malaria. Esto incluía áreas como el sur de Italia, la isla de Cerdeña, las marismas pontinas, las regiones bajas de la costa de Etruria y la ciudad de Roma a lo largo del Tíber. La presencia de agua estancada en estos lugares era preferida por los mosquitos como caldo de cultivo. Los jardines irrigados, los terrenos pantanosos, la escorrentía de la agricultura y los problemas de drenaje de la construcción de carreteras llevaron al aumento del agua estancada.
El término malaria tiene su origen en el italiano medieval: mala aria—"mal aire"; la enfermedad se llamaba anteriormente fiebre o fiebre de los pantanos debido a su asociación con pantanos y marismas. El término apareció en inglés al menos ya en 1768. La malaria alguna vez fue común en la mayor parte de Europa y América del Norte, donde ya no es endémica, aunque ocurren casos importados.
La malaria no se menciona en los libros de medicina de los mayas o aztecas. A pesar de esto, se han detectado anticuerpos contra la malaria en algunas momias sudamericanas, lo que indica que algunas cepas de malaria en las Américas podrían tener un origen precolombino. Los colonos europeos y los africanos occidentales a los que esclavizaron probablemente trajeron la malaria a las Américas a partir del siglo XVI.
Los estudios científicos sobre la malaria hicieron su primer avance significativo en 1880, cuando Charles Louis Alphonse Laveran, un médico del ejército francés que trabajaba en el hospital militar de Constantine en Argelia, observó parásitos dentro de los glóbulos rojos de las personas infectadas por primera vez. Él, por lo tanto, propuso que la malaria es causada por este organismo, la primera vez que se identificó un protista como causante de la enfermedad. Por este y posteriores descubrimientos, recibió el Premio Nobel de Fisiología o Medicina de 1907. Un año después, Carlos Finlay, un médico cubano que trata a personas con fiebre amarilla en La Habana, proporcionó pruebas sólidas de que los mosquitos transmitían enfermedades a los humanos y desde ellos. Este trabajo siguió las sugerencias anteriores de Josiah C. Nott y el trabajo de Sir Patrick Manson, el "padre de la medicina tropical", sobre la transmisión de la filariasis.
En abril de 1894, un médico escocés, Sir Ronald Ross, visitó a Sir Patrick Manson en su casa de Queen Anne Street, Londres. Esta visita fue el comienzo de cuatro años de colaboración y ferviente investigación que culminó en 1897 cuando Ross, que trabajaba en el Hospital General de la Presidencia en Calcuta, demostró el ciclo de vida completo del parásito de la malaria en los mosquitos. Así probó que el mosquito era el vector de la malaria en los humanos al mostrar que ciertas especies de mosquitos transmiten la malaria a las aves. Aisló parásitos de la malaria de las glándulas salivales de mosquitos que se habían alimentado de aves infectadas. Por este trabajo, Ross recibió el Premio Nobel de Medicina de 1902. Después de renunciar al Servicio Médico de la India, Ross trabajó en la recién establecida Escuela de Medicina Tropical de Liverpool y dirigió los esfuerzos de control de la malaria en Egipto, Panamá, Grecia y Mauricio. Los hallazgos de Finlay y Ross fueron posteriormente confirmados por una junta médica encabezada por Walter Reed en 1900. Sus recomendaciones fueron implementadas por William C. Gorgas en las medidas sanitarias adoptadas durante la construcción del Canal de Panamá. Este trabajo de salud pública salvó la vida de miles de trabajadores y ayudó a desarrollar los métodos utilizados en futuras campañas de salud pública contra la enfermedad.
En 1896, Amico Bignami discutió el papel de los mosquitos en la malaria. En 1898, Bignami, Giovanni Battista Grassi y Giuseppe Bastianelli lograron demostrar experimentalmente la transmisión de la malaria en humanos, utilizando mosquitos infectados para contraer la malaria ellos mismos que presentaron en noviembre de 1898 a la Accademia dei Lincei.
El primer tratamiento efectivo para la malaria provino de la corteza del árbol de quina, que contiene quinina. Este árbol crece en las laderas de los Andes, principalmente en Perú. Los pueblos indígenas del Perú elaboraban una tintura de quina para controlar la fiebre. Se comprobó su eficacia contra la malaria y los jesuitas introdujeron el tratamiento en Europa hacia 1640; en 1677, se incluyó en la Farmacopea de Londres como tratamiento antipalúdico. No fue hasta 1820 que el ingrediente activo, la quinina, fue extraído de la corteza, aislado y nombrado por los químicos franceses Pierre Joseph Pelletier y Joseph Bienaimé Caventou.
La quinina fue el medicamento predominante contra la malaria hasta la década de 1920, cuando comenzaron a aparecer otros medicamentos. En la década de 1940, la cloroquina reemplazó a la quinina como tratamiento de la malaria grave y no complicada hasta que sobrevino la resistencia, primero en el sudeste asiático y América del Sur en la década de 1950 y luego en todo el mundo en la década de 1980.
El valor medicinal de la Artemisia annua ha sido utilizado por los herbolarios chinos en la medicina tradicional china durante 2000 años. En 1596, Li Shizhen recomendó el té hecho de qinghao específicamente para tratar los síntomas de la malaria en su 'Compendio de Materia Médica'. Las artemisininas, descubiertas por el científico chino Tu Youyou y sus colegas en la década de 1970 a partir de la planta Artemisia annua, se convirtieron en el tratamiento recomendado para P. falciparum, administrado en casos graves en combinación con otros antipalúdicos. Tu dice que fue influenciada por una fuente de medicina herbaria china tradicional, El manual de prescripciones para tratamientos de emergencia, escrito en 340 por Ge Hong. Por su trabajo sobre la malaria, Tu Youyou recibió el Premio Nobel de Fisiología o Medicina 2015.
Plasmodium vivax se usó entre 1917 y la década de 1940 para la malarioterapia: inyección deliberada de parásitos de la malaria para inducir fiebre y combatir ciertas enfermedades como la sífilis terciaria. En 1927, el inventor de esta técnica, Julius Wagner-Jauregg, recibió el Premio Nobel de Fisiología o Medicina por sus descubrimientos. La técnica era peligrosa, matando a alrededor del 15% de los pacientes, por lo que ya no se usa.
El primer pesticida utilizado para la fumigación residual en interiores fue el DDT. Aunque inicialmente se utilizó exclusivamente para combatir la malaria, su uso se extendió rápidamente a la agricultura. Con el tiempo, el control de plagas, en lugar del control de enfermedades, llegó a dominar el uso del DDT, y este uso agrícola a gran escala condujo a la evolución de mosquitos resistentes a los pesticidas en muchas regiones. La resistencia al DDT que muestran los mosquitos Anopheles se puede comparar con la resistencia a los antibióticos que muestran las bacterias. Durante la década de 1960, aumentó la conciencia de las consecuencias negativas de su uso indiscriminado, lo que finalmente condujo a la prohibición de las aplicaciones agrícolas del DDT en muchos países en la década de 1970. Antes del DDT, la malaria se eliminaba o controlaba con éxito en áreas tropicales como Brasil y Egipto mediante la eliminación o el envenenamiento de los criaderos de mosquitos o los hábitats acuáticos de los estadios larvarios, por ejemplo mediante la aplicación del compuesto de arsénico Paris Green, altamente tóxico, en lugares con agua.
Las vacunas contra la malaria han sido un objetivo difícil de alcanzar en la investigación. Los primeros estudios prometedores que demostraron el potencial de una vacuna contra la malaria se realizaron en 1967 mediante la inmunización de ratones con esporozoitos vivos atenuados por radiación, que proporcionaron una protección significativa a los ratones tras la inyección posterior con esporozoitos normales y viables. Desde la década de 1970, ha habido un esfuerzo considerable para desarrollar estrategias de vacunación similares para humanos. La primera vacuna, llamada RTS,S, fue aprobada por los reguladores europeos en 2015.
Nombres
Varios tipos de malaria han sido llamados por los siguientes nombres:
| Nombre | Pathogen | Notas |
|---|---|---|
| malaria algid | Plasmodium falciparum | malaria grave que afecta al sistema cardiovascular y causa escalofríos y shock circulatorio |
| malaria bilious | Plasmodium falciparum | malaria grave que afecta al hígado y causa vómitos y ictericia |
| malaria cerebral | Plasmodium falciparum | malaria grave que afecta al cerebro |
| malaria congénita | varios plasmodia | plasmodium introducido de la madre a través de la circulación fetal |
| malaria perniciosa | Plasmodium falciparum | malaria grave que conduce a una enfermedad grave |
| malaria maligna | Plasmodium falciparum | malaria grave que conduce a la muerte |
| malaria falciparum, Plasmodium falciparum malaria | Plasmodium falciparum | |
| ovale malaria, Plasmodium ovale malaria | Plasmodium ovale | |
| malaria, malaria, malaria Plasmodium malariae malaria | Plasmodium malariae | paroxismos cada cuarto día (quartan), contando el día de la ocurrencia como el primer día |
| malaria | Plasmodium falciparum, Plasmodium vivax, Plasmodium knowlesi | paroxysms daily (quotidian) |
| malaria terciaria | Plasmodium falciparum, Plasmodium ovale, Plasmodium vivax | paroxismos cada tercer día (tertiano), contando el día de la ocurrencia como el primer |
| malaria transfusión | varios plasmodia | plasmodium introducido por transfusión sanguínea, intercambio de agujas o lesión de aguja |
| malaria vivax, Plasmodium vivax malaria | Plasmodium vivax |
Esfuerzos de erradicación
La malaria se ha eliminado con éxito o se ha reducido significativamente en ciertas áreas, pero no a nivel mundial. La malaria alguna vez fue común en los Estados Unidos, pero EE. UU. eliminó la malaria de la mayor parte del país a principios del siglo XX mediante programas de control de vectores, que combinaron el monitoreo y el tratamiento de humanos infectados, el drenaje de los criaderos de humedales para la agricultura y otros cambios. en las prácticas de gestión del agua, y los avances en saneamiento, incluido un mayor uso de ventanas y mosquiteros de vidrio en las viviendas. El uso del pesticida DDT y otros medios eliminó la malaria de los focos restantes en los estados del sur de los EE. UU. en la década de 1950, como parte del Programa Nacional de Erradicación de la Malaria. La mayor parte de Europa, América del Norte, Australia, África del Norte y el Caribe, y partes de América del Sur, Asia y África del Sur también han eliminado la malaria. La OMS define "eliminación" (o "libre de malaria") como sin transmisión doméstica (casos autóctonos) durante los últimos tres años. También definen "pre-eliminación" y "eliminación" etapas cuando un país tiene menos de 5 o 1, respectivamente, casos por cada 1000 personas en riesgo por año.
En 1955, la OMS lanzó el Programa Global de Erradicación de la Malaria (GMEP), que apoyó reducciones sustanciales en los casos de malaria en algunos países, incluida la India. Sin embargo, debido a la resistencia de vectores y parásitos y otros factores, la factibilidad de erradicar la malaria con la estrategia utilizada en ese momento y los recursos disponibles hicieron que el apoyo al programa disminuyera. La OMS suspendió el programa en 1969.
La meta 6C de los Objetivos de Desarrollo del Milenio incluía revertir el aumento global de la incidencia de malaria para 2015, con metas específicas para niños menores de 5 años. Desde el año 2000, aumentó el apoyo a la erradicación de la malaria, aunque algunos actores de la comunidad mundial de la salud (incluidas voces dentro de la OMS) ven la erradicación de la malaria como una meta prematura y sugieren que el establecimiento de plazos estrictos para la erradicación de la malaria puede ser contraproducente, ya que es probable que ser extrañado
En 2006, la organización Malaria No More estableció el objetivo público de eliminar la malaria de África para 2015, y la organización afirmó que planeaba disolverse si se lograba ese objetivo. En 2007, el Día Mundial del Paludismo fue establecido por la 60ª sesión de la Asamblea Mundial de la Salud. A partir de 2018, todavía están funcionando.
Desde 2012, el Fondo Mundial para la Lucha contra el SIDA, la Tuberculosis y la Malaria ha distribuido 230 millones de mosquiteros tratados con insecticida destinados a detener la transmisión de la malaria a través de mosquitos. La Fundación Clinton, con sede en EE. UU., ha trabajado para gestionar la demanda y estabilizar los precios en el mercado de la artemisinina. Otros esfuerzos, como el Proyecto Malaria Atlas, se centran en analizar la información climática y meteorológica necesaria para predecir con precisión la propagación de la malaria en función de la disponibilidad del hábitat de los parásitos portadores de la malaria. El Comité Asesor de Políticas sobre Malaria (MPAC) de la Organización Mundial de la Salud (OMS) se formó en 2012, "para brindar asesoramiento estratégico y aportes técnicos a la OMS sobre todos los aspectos del control y la eliminación de la malaria". En noviembre de 2013, la OMS y el grupo de patrocinadores de la vacuna contra la malaria establecieron el objetivo de desarrollar vacunas diseñadas para interrumpir la transmisión de la malaria con el objetivo a largo plazo de erradicación de la malaria.
En 2015, la OMS apuntó a una reducción del 90 % en las muertes por paludismo para 2030, y Bill Gates dijo en 2016 que pensaba que la erradicación mundial sería posible para 2040. Según el Informe mundial sobre paludismo 2015 de la OMS, el La tasa de mortalidad por malaria se redujo en un 60 % entre 2000 y 2015. La OMS apuntó a una reducción adicional del 90 % entre 2015 y 2030, con una reducción del 40 % y la erradicación en 10 países para 2020. Sin embargo, la meta de 2020 no se cumplió con un ligero aumento en casos en comparación con 2015.
Antes de 2016, el Fondo Mundial contra el VIH/SIDA, la Tuberculosis y la Malaria había proporcionado 659 millones de ITN (mosquiteros tratados con insecticida), organizando apoyo y educación para prevenir la malaria. Los desafíos son grandes debido a la falta de fondos, la frágil estructura de salud y la población indígena remota que podría ser difícil de alcanzar y educar. La mayoría de la población indígena depende del autodiagnóstico, el autotratamiento, el sanador y la medicina tradicional. La OMS solicitó fondos a la Fundación Gates que favorecen la acción de erradicación de la malaria en 2007. Seis países, Emiratos Árabes Unidos, Marruecos, Armenia, Turkmenistán, Kirguistán y Sri Lanka lograron no tener casos endémicos de malaria durante tres años consecutivos. y certificado libre de malaria por la OMS a pesar del estancamiento de la financiación en 2010. La financiación es esencial para financiar el costo de la medicación y la hospitalización no puede ser apoyada por los países pobres donde la enfermedad está muy extendida. La meta de erradicación no se ha cumplido; sin embargo, la tasa de disminución de la enfermedad es considerable.
Si bien se estimó que 31 de los 92 países endémicos estaban en camino con los objetivos de la OMS para 2020, 15 países informaron un aumento del 40 % o más entre 2015 y 2020. Entre 2000 y el 30 de junio de 2021, doce países fueron certificados por la OMS como libre de malaria. Argentina y Argelia fueron declarados libres de malaria en 2019. El Salvador y China fueron declarados libres de malaria en el primer semestre de 2021.
Las disparidades regionales eran evidentes: el Sudeste Asiático iba camino de cumplir los objetivos de la OMS para 2020, mientras que las regiones de África, las Américas, el Mediterráneo Oriental y el Pacífico Occidental no iban por buen camino. Los seis países de la Subregión del Gran Mekong tienen como objetivo la eliminación de la malaria transmitida por P. falciparum para 2025 y la eliminación de toda la malaria para 2030, habiendo logrado una reducción de casos del 97% y 90% respectivamente desde 2000. Antes del Día Mundial de la Malaria, el 25 de abril de 2021, La OMS nombró 25 países en los que está trabajando para eliminar la malaria para 2025 como parte de su iniciativa E-2025.
Un desafío importante para la eliminación de la malaria es la persistencia de la malaria en las regiones fronterizas, lo que hace que la cooperación internacional sea crucial.
Una de las metas del Objetivo 3 de los Objetivos de Desarrollo Sostenible de la ONU es poner fin a la epidemia de malaria en todos los países para 2030.
En 2018, la OMS anunció que Paraguay estaba libre de malaria, luego de un esfuerzo nacional de erradicación de la malaria que comenzó en 1950.
A partir de 2019, el proceso de erradicación continúa, pero será difícil lograr un mundo libre de malaria con los enfoques y herramientas actuales. Solo una vacuna contra la malaria está autorizada para su uso y muestra una efectividad relativamente baja, mientras que varias otras vacunas candidatas en ensayos clínicos tienen como objetivo brindar protección a los niños en áreas endémicas y reducir la velocidad de transmisión de la malaria. Los enfoques pueden requerir una mayor inversión en investigación y una mayor atención primaria de la salud. La vigilancia continua también será importante para prevenir el regreso de la malaria en países donde la enfermedad ha sido eliminada.
Sociedad y cultura
Impacto económico
La malaria no es solo una enfermedad comúnmente asociada con la pobreza: alguna evidencia sugiere que también es una causa de pobreza y un obstáculo importante para el desarrollo económico. Aunque las regiones tropicales son las más afectadas, la mayor influencia de la malaria llega a algunas zonas templadas que tienen cambios estacionales extremos. La enfermedad se ha asociado con importantes efectos económicos negativos en las regiones donde está muy extendida. Durante finales del siglo XIX y principios del XX, fue un factor importante en el lento desarrollo económico de los estados del sur de Estados Unidos.
Una comparación del PIB per cápita promedio en 1995, ajustado por paridad de poder adquisitivo, entre países con malaria y países sin malaria arroja una diferencia de cinco veces (US$1.526 versus US$8.268). En el período de 1965 a 1990, los países donde la malaria era común tenían un PIB per cápita promedio que aumentó solo 0,4% por año, en comparación con 2,4% por año en otros países.
La pobreza puede aumentar el riesgo de malaria ya que quienes viven en la pobreza no tienen la capacidad financiera para prevenir o tratar la enfermedad. En su totalidad, se ha estimado que el impacto económico de la malaria le cuesta a África US $ 12 mil millones cada año. El impacto económico incluye costos de atención médica, días de trabajo perdidos por enfermedad, días perdidos en educación, disminución de la productividad debido al daño cerebral por malaria cerebral y pérdida de inversión y turismo. La enfermedad tiene una gran carga en algunos países, donde puede ser responsable del 30% al 50% de los ingresos hospitalarios, hasta el 50% de las visitas ambulatorias y hasta el 40% del gasto público en salud.
La malaria cerebral es una de las principales causas de discapacidad neurológica en los niños africanos. Los estudios que compararon las funciones cognitivas antes y después del tratamiento de la malaria grave continuaron mostrando un rendimiento escolar y capacidades cognitivas significativamente deteriorados incluso después de la recuperación. En consecuencia, la malaria grave y cerebral tiene consecuencias socioeconómicas de largo alcance que se extienden más allá de los efectos inmediatos de la enfermedad.
Medicamentos falsificados y de baja calidad
Se han encontrado falsificaciones sofisticadas en varios países asiáticos, como Camboya, China, Indonesia, Laos, Tailandia y Vietnam, y son una de las principales causas de muerte evitable en esos países. La OMS dijo que los estudios indican que hasta el 40% de los medicamentos contra la malaria a base de artesunato son falsificados, especialmente en la región del Gran Mekong. Han establecido un sistema de alerta rápida para reportar rápidamente información sobre medicamentos falsificados a las autoridades pertinentes en los países participantes. No existe una forma confiable para que los médicos o la gente común detecte medicamentos falsificados sin la ayuda de un laboratorio. Las empresas están intentando combatir la persistencia de medicamentos falsificados mediante el uso de nueva tecnología para brindar seguridad desde la fuente hasta la distribución.
Otra preocupación clínica y de salud pública es la proliferación de medicamentos antipalúdicos de baja calidad como resultado de una concentración inadecuada de ingredientes, contaminación con otros medicamentos o impurezas tóxicas, ingredientes de mala calidad, estabilidad deficiente y empaque inadecuado. Un estudio de 2012 demostró que aproximadamente un tercio de los medicamentos antipalúdicos en el sudeste asiático y el África subsahariana fallaron en el análisis químico, el análisis del empaque o fueron falsificados.
Guerra
A lo largo de la historia, la contracción de la malaria ha desempeñado un papel destacado en el destino de los gobernantes, los estados-nación, el personal militar y las acciones militares. En 1910, el ganador del Premio Nobel de Medicina Ronald Ross (él mismo sobreviviente de la malaria), publicó un libro titulado La prevención de la malaria que incluía un capítulo titulado "La prevención de la malaria en la guerra". El autor del capítulo, el coronel C. H. Melville, profesor de Higiene en el Royal Army Medical College de Londres, abordó el papel destacado que históricamente ha desempeñado la malaria durante las guerras: "La historia de la malaria en la guerra casi podría llevarse a sea la historia de la guerra misma, ciertamente la historia de la guerra en la era cristiana.... Es probable que muchas de las llamadas fiebres de campo, y probablemente también una proporción considerable de la disentería de campo, de las guerras de los siglos XVI, XVII y XVIII, fueran de origen palúdico." En la India ocupada por los británicos, el cóctel de gin tonic puede haber surgido como una forma de tomar quinina, conocida por sus propiedades antipalúdicas.
La malaria fue el peligro para la salud más importante al que se enfrentaron las tropas estadounidenses en el Pacífico Sur durante la Segunda Guerra Mundial, donde se infectaron unos 500 000 hombres. Según Joseph Patrick Byrne, "Sesenta mil soldados estadounidenses murieron de malaria durante las campañas de África y el Pacífico Sur".
Se han realizado importantes inversiones financieras para adquirir los agentes antipalúdicos existentes y crear nuevos. Durante la Primera Guerra Mundial y la Segunda Guerra Mundial, los suministros inconsistentes de los medicamentos antipalúdicos naturales corteza de cinchona y quinina impulsaron una financiación sustancial para la investigación y el desarrollo de otros medicamentos y vacunas. Las organizaciones militares estadounidenses que llevan a cabo tales iniciativas de investigación incluyen el Centro de Investigación Médica de la Marina, el Instituto de Investigación del Ejército Walter Reed y el Instituto de Investigación Médica de Enfermedades Infecciosas del Ejército de los EE. UU. de las Fuerzas Armadas de los EE. UU.
Además, se han fundado iniciativas como Malaria Control in War Areas (MCWA), establecida en 1942, y su sucesor, el Communicable Disease Center (ahora conocido como Centers for Disease Control and Prevention, o CDC) establecido en 1946 Según los CDC, MCWA "se estableció para controlar la malaria alrededor de las bases de entrenamiento militar en el sur de los Estados Unidos y sus territorios, donde la malaria todavía era problemática".
Investigación
La iniciativa Agenda de investigación para la erradicación de la malaria (malERA) fue un proceso de consulta para identificar qué áreas de investigación y desarrollo (I+D) deben abordarse para la erradicación mundial de la malaria.
Vacuna
Los reguladores europeos aprobaron una vacuna contra la malaria llamada RTS,S/AS01 (RTS,S) en 2015. A partir de 2019, se encuentra en pruebas piloto en 3 países del África subsahariana (Ghana, Kenia y Malawi) como parte del Programa de Implementación de la Vacuna contra la Malaria (MVIP) de la OMS.
Inmunidad (o, más exactamente, tolerancia) a P. falciparum la malaria ocurre naturalmente, pero solo en respuesta a años de infección repetida. Un individuo puede estar protegido de un P. falciparum si reciben alrededor de mil picaduras de mosquitos que portan una versión del parásito que se vuelve no infeccioso por una dosis de irradiación de rayos X. La naturaleza altamente polimórfica de muchos P. falciparum resulta en desafíos significativos para el diseño de vacunas. Las vacunas candidatas que se dirigen a antígenos en gametos, cigotos u oocinetos en el intestino medio del mosquito tienen como objetivo bloquear la transmisión de la malaria. Estas vacunas que bloquean la transmisión inducen anticuerpos en la sangre humana; cuando un mosquito se alimenta de sangre de un individuo protegido, estos anticuerpos impiden que el parásito complete su desarrollo en el mosquito. Otras vacunas candidatas, dirigidas a la etapa sanguínea del ciclo de vida del parásito, han sido inadecuadas por sí solas. Por ejemplo, SPf66 se probó ampliamente en áreas donde la enfermedad era común en la década de 1990, pero los ensayos demostraron que no era lo suficientemente efectivo.
En 2021, investigadores de la Universidad de Oxford informaron sobre los resultados de un ensayo de fase IIb de una vacuna candidata contra la malaria, R21/Matrix-M, que demostró una eficacia del 77 % durante 12 meses de seguimiento. Esta vacuna es la primera en cumplir con el objetivo de la hoja de ruta de tecnología de vacunas contra la malaria de la Organización Mundial de la Salud de una vacuna con al menos un 75% de eficacia.
Medicamentos
Los parásitos de la malaria contienen apicoplastos, orgánulos relacionados con los plástidos que se encuentran en las plantas, completos con sus propios genomas. Se cree que estos apicoplastos se originaron a través de la endosimbiosis de las algas y juegan un papel crucial en varios aspectos del metabolismo de los parásitos, como la biosíntesis de ácidos grasos. Se ha descubierto que los apicoplastos producen más de 400 proteínas y ahora se están investigando como posibles objetivos para nuevos fármacos antipalúdicos.
Con la aparición de parásitos Plasmodium resistentes a los medicamentos, se están desarrollando nuevas estrategias para combatir la enfermedad generalizada. Uno de esos enfoques radica en la introducción de aductos sintéticos de piridoxal-aminoácido, que son absorbidos por el parásito y, en última instancia, interfieren con su capacidad para crear varias vitaminas B esenciales. Los medicamentos antipalúdicos que utilizan complejos basados en metales sintéticos están atrayendo el interés de la investigación.
- (+)-SJ733: Parte de una clase más amplia de fármacos experimentales llamados espiroindolona. Inhibe la proteína ATP4 de los glóbulos rojos infectados que hacen que las células se encojan y se vuelvan rígidas como las células del envejecimiento. Esto activa el sistema inmunitario para eliminar las células infectadas del sistema como se demuestra en un modelo de ratón. A partir de 2014, el Howard Hughes Medical Institute planifica un ensayo clínico de fase 1 para evaluar el perfil de seguridad en humanos.
- NITD246 y NITD609: También perteneció a la clase de espiroindolona y se dirigió a la proteína ATP4.
Sobre la base de los resultados del acoplamiento molecular, los compuestos 3j, 4b, 4h, 4m mostraron selectividad hacia PfLDH. El análisis posterior al acoplamiento mostró un comportamiento dinámico estable de todos los compuestos seleccionados en comparación con la cloroquina. El análisis termodinámico del estado final indicó que el compuesto 3j es un inhibidor selectivo y potente de la PfLDH.
Nuevos objetivos
Dirigirse selectivamente a los parásitos Plasmodium en estadio hepático está emergiendo como una estrategia alternativa frente a la resistencia a las últimas terapias combinadas de primera línea contra los estadios sanguíneos del parásito.
En una investigación realizada en 2019, utilizando análisis experimentales con mutantes knockout (KO) de Plasmodium berguei, los autores pudieron identificar genes que son potencialmente esenciales en la etapa hepática. Además, generaron un modelo computacional para analizar el desarrollo preeritrocitario y el metabolismo en etapa hepática. Combinando ambos métodos, identificaron siete subsistemas metabólicos que se vuelven esenciales en comparación con la etapa sanguínea. Algunas de estas rutas metabólicas son la síntesis y elongación de ácidos grasos, el metabolismo de ácidos tricarboxílicos, aminoácidos y hemo, entre otros.
Específicamente, estudiaron 3 subsistemas: síntesis y elongación de ácidos grasos, y biosíntesis de aminoazúcares. Para las dos primeras vías demostraron una clara dependencia del estadio hepático de su propio metabolismo de ácidos grasos.
Probaron por primera vez el papel fundamental de la biosíntesis de aminoazúcares en el estadio hepático de P. berghei. La captación de N-acetil-glucosamina parece estar limitada en el estadio hepático, siendo necesaria su síntesis para el desarrollo del parásito.
Estos hallazgos y el modelo computacional proporcionan una base para el diseño de terapias antipalúdicas dirigidas a las proteínas metabólicas.
Otro
Una estrategia de control de vectores no química implica la manipulación genética de los mosquitos de la malaria. Los avances en las tecnologías de ingeniería genética hacen posible introducir ADN extraño en el genoma del mosquito y disminuir la vida útil del mosquito o hacerlo más resistente al parásito de la malaria. La técnica del insecto estéril es un método de control genético mediante el cual se crían y liberan grandes cantidades de mosquitos macho estériles. El apareamiento con hembras salvajes reduce la población salvaje en la generación siguiente; las liberaciones repetidas eventualmente eliminan la población objetivo.
La genómica es fundamental para la investigación de la malaria. Con la secuenciación de P. falciparum, uno de sus vectores Anopheles gambiae, y el genoma humano, se puede estudiar la genética de los tres organismos en el ciclo de vida de la malaria. Otra nueva aplicación de la tecnología genética es la capacidad de producir mosquitos modificados genéticamente que no transmitan la malaria, lo que podría permitir el control biológico de la transmisión de la malaria.
En un estudio, se creó una cepa modificada genéticamente de Anopheles stephensi que ya no admitía la transmisión de la malaria, y esta resistencia se transmitió a la descendencia de los mosquitos.
La conducción genética es una técnica para cambiar poblaciones silvestres, por ejemplo, para combatir o eliminar insectos para que no puedan transmitir enfermedades (en particular, mosquitos en los casos de malaria, zika, dengue y fiebre amarilla).
En diciembre de 2020, un artículo de revisión encontró que las regiones endémicas de paludismo tenían tasas de letalidad de COVID-19 más bajas en promedio que las regiones donde no se sabía que la malaria fuera endémica.
Además, una investigación realizada en 2015 demostró que, en ratones, la coinfección de la malaria con el nematodo Nippostrongylus brasiliensis, un helminto pulmonar migratorio, ha amortiguado la virulencia del Plasmodium. parásito. Los investigadores demostraron el control de abajo hacia arriba de la infección de malaria por el nematodo; específicamente, la infección por nematodos conduce a una mayor destrucción de eritrocitos. Se sabe que Plasmodium prefiere los eritrocitos más viejos del huésped, que son más fáciles de infectar, por lo que una mayor destrucción, lo que provoca un aumento posterior de la eritropoyesis, conduce a una población general de eritrocitos más jóvenes que da como resultado una disminución de Plasmodium población. Curiosamente, este control de la enfermedad es en gran medida independiente del control inmunitario del huésped de Plasmodium, y puede proporcionar información interesante para el tratamiento futuro.
Otros animales
Si bien no existen reservorios animales para las cepas de malaria que causan infecciones humanas, se han identificado cerca de 200 especies de parásitos Plasmodium que infectan aves, reptiles y otros mamíferos, y unas 30 especies infectan naturalmente primates no humanos. Algunos parásitos de la malaria que afectan a los primates no humanos (NHP) sirven como organismos modelo para los parásitos de la malaria humana, como P. coatneyi (un modelo para P. falciparum) y P. cynomolgi (P. vivax). Las técnicas de diagnóstico utilizadas para detectar parásitos en NHP son similares a las empleadas para humanos. Los parásitos de la malaria que infectan a los roedores se utilizan ampliamente como modelos en la investigación, como P. berghei. La malaria aviar afecta principalmente a las especies del orden Passeriformes y representa una amenaza sustancial para las aves de Hawái, Galápagos y otros archipiélagos. El parásito P. relictum se sabe que desempeña un papel en la limitación de la distribución y abundancia de las aves endémicas de Hawái. Se espera que el calentamiento global aumente la prevalencia y la distribución global de la malaria aviar, ya que las temperaturas elevadas brindan condiciones óptimas para la reproducción del parásito.
Contenido relacionado
P53
Alcoholismo
Aracnofobia