Tetraodontiformes
(leer más)
Isoleucina (símbolo Ile o I) es un α-aminoácido que se utiliza en la biosíntesis de proteínas. Contiene un grupo α-amino (que está en el protonado −NH+
3 en condiciones biológicas), un grupo de ácido α-carboxílico (que se encuentra en el −COO< desprotonado sup>− en condiciones biológicas), y una cadena lateral de hidrocarburo con una ramificación (un átomo de carbono central unido a otros tres átomos de carbono). Se clasifica como un aminoácido alifático de cadena ramificada, no polar, sin carga (a pH fisiológico). Es esencial en los humanos, es decir, el cuerpo no puede sintetizarlo y debe ser ingerido en nuestra dieta. La isoleucina se sintetiza a partir del piruvato empleando enzimas de biosíntesis de leucina en otros organismos como las bacterias. Está codificado por los codones AUU, AUC y AUA.
Como nutriente esencial, no se sintetiza en el organismo, por lo que debe ser ingerido, normalmente como componente de las proteínas. En plantas y microorganismos, se sintetiza a través de varios pasos, a partir de piruvato y alfa-cetobutirato. Las enzimas involucradas en esta biosíntesis incluyen:
La isoleucina es un aminoácido glucogénico y cetogénico. Después de la transaminación con alfa-cetoglutarato, el esqueleto de carbono se oxida y se divide en propionil-CoA y acetil-CoA. El propionil-CoA se convierte en succinil-CoA, un intermedio del ciclo TCA que se puede convertir en oxaloacetato para la gluconeogénesis (por lo tanto, glucogénico). En los mamíferos, el acetil-CoA no se puede convertir en carbohidrato, pero se puede introducir en el ciclo del TCA al condensarse con oxaloacetato para formar citrato o usarse en la síntesis de cuerpos cetónicos (por lo tanto, cetogénicos) o ácidos grasos.
La isoleucina, al igual que otros aminoácidos de cadena ramificada, está asociada con la resistencia a la insulina: se observan niveles más altos de isoleucina en la sangre de ratones, ratas y humanos diabéticos. Los ratones alimentados con una dieta de privación de isoleucina durante un día han mejorado la sensibilidad a la insulina, y la alimentación con una dieta de privación de isoleucina durante una semana reduce significativamente los niveles de glucosa en sangre. En ratones obesos y resistentes a la insulina inducidos por dieta, una dieta con niveles reducidos de isoleucina (con o sin los otros aminoácidos de cadena ramificada) reduce la adiposidad y mejora la sensibilidad a la insulina. Se requieren niveles dietéticos reducidos de isoleucina para los efectos metabólicos beneficiosos de una dieta baja en proteínas. En los seres humanos, una dieta restringida en proteínas reduce los niveles sanguíneos de isoleucina y disminuye los niveles de glucosa en sangre en ayunas. En los seres humanos, los niveles más altos de isoleucina en la dieta se asocian con un mayor índice de masa corporal.
La Junta de Alimentos y Nutrición (FNB, por sus siglas en inglés) del Instituto de Medicina de EE. UU. ha establecido las Ingestas Dietéticas Recomendadas (RDA, por sus siglas en inglés) de aminoácidos esenciales en 2002. Para la isoleucina, para adultos a partir de los 19 años, 19 mg/kg de peso corporal/día se requiere.
Además de su papel biológico como nutriente, también se ha demostrado que la isoleucina participa en la regulación del metabolismo de la glucosa.
Aunque este aminoácido no se produce en animales, se almacena en grandes cantidades. Los alimentos que tienen altas cantidades de isoleucina incluyen huevos, proteína de soja, algas, pavo, pollo, cordero, queso y pescado.
| Formas de Isoleucine | |||||||
|---|---|---|---|---|---|---|---|
| Nombre común: | isoleucine | d- isoleucine | l- isoleucine | ♪- isoleucine | d-Alloisoleucine | l-Alloisoleucine | ♪-Alloisoleucine |
| Sinónimos: | ()R)-Isoleucine | L(+)-Isoleucine | ()R*R*) isoleucina | alloisoleucine | |||
| PubChem: | CID 791 de PubChem | CID 94206 de PubChem | CID 6306 de PubChem | CID 76551 de PubChem | |||
| Número de EINECS: | |||||||
| Número de CAS: | 443-79-8 | 319-78-8 | 73-32-5 | 1509-35-9 | 1509-34-8 | 3107-04-8 | |
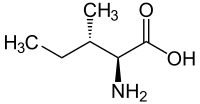  |
| l- isoleucina (2)S,3S) y d- isoleucina (2)R,3R) |
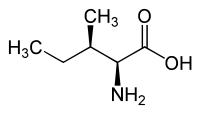  |
| l-alloisoleucina (2)S,3R) y d-alloisoleucina (2)R,3S) |
La isoleucina se puede sintetizar en un procedimiento de varios pasos a partir de 2-bromobutano y dietilmalonato. La isoleucina sintética fue reportada originalmente en 1905 por el químico francés Louis Bouveault.
El químico alemán Felix Ehrlich descubrió la isoleucina en la hemoglobina en 1903.
(leer más)
(leer más)
(leer más)