Inhibidores de enzimas
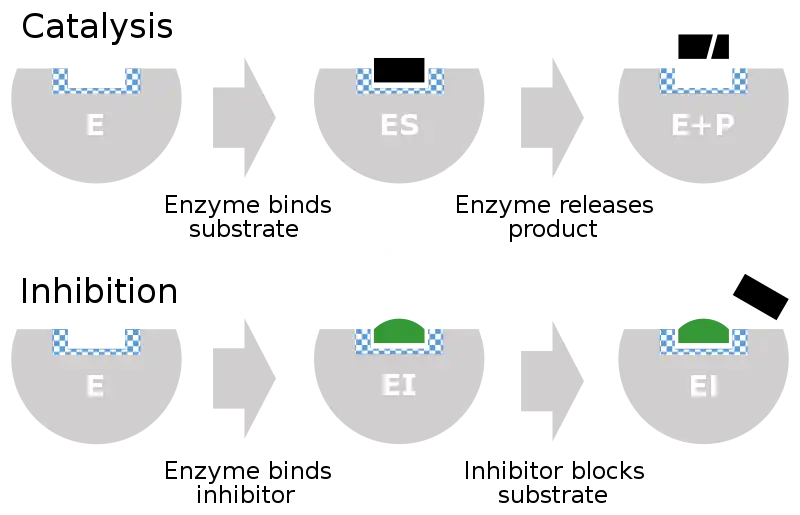
Un inhibidor enzimático es una molécula que se une a una enzima y bloquea su actividad. Las enzimas son proteínas que aceleran las reacciones químicas necesarias para la vida, en las que las moléculas de sustrato se convierten en productos. Una enzima facilita una reacción química específica al unir el sustrato a su sitio activo, un área especializada en la enzima que acelera el paso más difícil de la reacción.
Un inhibidor enzimático obstaculiza ("inhibe") este proceso, ya sea uniéndose al sitio activo de la enzima (evitando así que el sustrato mismo se una) o uniéndose a otro sitio en la enzima de modo que se bloquee la catálisis de la reacción por parte de la enzima. Los inhibidores de enzimas pueden unirse de forma reversible o irreversible. Los inhibidores irreversibles forman un enlace químico con la enzima de manera que la enzima se inhibe hasta que se rompe el enlace químico. Por el contrario, los inhibidores reversibles se unen de forma no covalente y pueden abandonar la enzima espontáneamente, lo que permite que la enzima reanude su función. Los inhibidores reversibles producen diferentes tipos de inhibición dependiendo de si se unen a la enzima, al complejo enzima-sustrato oa ambos.
Los inhibidores de enzimas juegan un papel importante en todas las células, ya que generalmente son específicos de una enzima y sirven para controlar la actividad de esa enzima. Por ejemplo, las enzimas en una ruta metabólica pueden ser inhibidas por moléculas producidas más tarde en la ruta, lo que reduce la producción de moléculas que ya no se necesitan. Este tipo de retroalimentación negativa es una forma importante de mantener la homeostasis en una célula. Los inhibidores de enzimas también controlan enzimas esenciales que, si no se controlan, pueden dañar una célula, como las proteasas o las nucleasas. Un ejemplo bien caracterizado de esto es el inhibidor de la ribonucleasa, que se une a las ribonucleasas en una de las interacciones proteína-proteína más estrechas que se conocen. Muchos venenos que se encuentran en los animales son inhibidores de enzimas que bloquean la actividad de una enzima crucial en la víctima.
Muchas moléculas de fármacos son inhibidores de enzimas que inhiben una enzima humana anómala o una enzima crítica para la supervivencia de un patógeno como un virus, una bacteria o un parásito. Los ejemplos incluyen el metotrexato (usado en la quimioterapia y en el tratamiento de la artritis reumática), así como los inhibidores de la proteasa que se usan para tratar el SIDA. Dado que los inhibidores antipatógenos generalmente se dirigen a una sola enzima, tales fármacos son altamente específicos y generalmente producen pocos efectos secundarios en los seres humanos, siempre que no se encuentre una enzima análoga en los seres humanos. (Este suele ser el caso, ya que tales patógenos y los humanos son genéticamente distantes). Los inhibidores de enzimas medicinales a menudo tienen constantes de disociación bajas, lo que significa que solo se requiere una cantidad mínima del inhibidor para inhibir la enzima. Una baja concentración del inhibidor de la enzima reduce el riesgo de daño hepático y renal y otras reacciones adversas a medicamentos en humanos. Por lo tanto, el descubrimiento y el perfeccionamiento de los inhibidores de enzimas es un área activa de investigación en bioquímica y farmacología.
Inhibidores reversibles
Tipos
Los inhibidores reversibles se adhieren a las enzimas con interacciones no covalentes, como enlaces de hidrógeno, interacciones hidrofóbicas y enlaces iónicos. Múltiples enlaces débiles entre el inhibidor y el sitio activo se combinan para producir una unión fuerte y específica. A diferencia de los inhibidores irreversibles, los inhibidores reversibles generalmente no experimentan reacciones químicas cuando se unen a la enzima y pueden eliminarse fácilmente por dilución o diálisis. Un caso especial son los inhibidores reversibles covalentes que se unen covalentemente a la enzima, pero la reacción química que forma el enlace es completamente reversible.
Hay cuatro tipos de inhibidores enzimáticos reversibles. Se clasifican según el efecto del inhibidor sobre la Vmax (velocidad de reacción máxima catalizada por la enzima) y Km ( la concentración de sustrato que da como resultado la mitad de la actividad enzimática máxima) a medida que varía la concentración del sustrato de la enzima.
Competitivo
En la inhibición competitiva, el sustrato y el inhibidor no pueden unirse a la enzima al mismo tiempo, como se muestra en la figura de la derecha. Esto generalmente resulta de que el inhibidor tiene afinidad por el sitio activo de una enzima donde también se une el sustrato; el sustrato y el inhibidor compiten por el acceso al sitio activo de la enzima. Este tipo de inhibición se puede superar con concentraciones suficientemente altas de sustrato (Vmax permanece constante), es decir, superando al inhibidor. Sin embargo, la K m aparente aumentará ya que se necesita una mayor concentración del sustrato para alcanzar el punto K m, o la mitad de la V máx.. Los inhibidores competitivos suelen tener una estructura similar al sustrato real (consulte, por ejemplo, la comparación del metotrexato con ácido fólico a continuación).
Poco competitivo
En la inhibición no competitiva, el inhibidor se une solo al complejo enzima-sustrato. Este tipo de inhibición hace que Vmax disminuya (la velocidad máxima disminuye como resultado de la eliminación del complejo activado) y Km (debido a una mejor eficiencia de unión como resultado del principio de Le Chatelier y la eliminación efectiva del complejo ES, lo que disminuye la K m que indica una mayor afinidad de unión).
No competitivo
En la inhibición no competitiva, la unión del inhibidor a la enzima reduce su actividad pero no afecta la unión del sustrato. Como resultado, el grado de inhibición depende únicamente de la concentración del inhibidor. V max disminuirá debido a la incapacidad de que la reacción se desarrolle con la misma eficacia, pero Km permanecerá igual ya que la unión real del sustrato, por definición, seguirá funcionando correctamente.
Mezclado
En la inhibición mixta, el inhibidor puede unirse a la enzima al mismo tiempo que el sustrato de la enzima. Sin embargo, la unión del inhibidor afecta la unión del sustrato y viceversa. Este tipo de inhibición se puede reducir, pero no superar, aumentando las concentraciones de sustrato. Aunque es posible que los inhibidores de tipo mixto se unan al sitio activo, este tipo de inhibición generalmente resulta de un efecto alostérico donde el inhibidor se une a un sitio diferente en una enzima. La unión del inhibidor a este sitio alostérico cambia la conformación (es decir, la estructura terciaria o la forma tridimensional) de la enzima de modo que se reduce la afinidad del sustrato por el sitio activo.
Estos tipos también se pueden distinguir por el efecto del aumento de la concentración de sustrato [S] sobre el grado de inhibición causado por una determinada cantidad de inhibidor. Para la inhibición competitiva, el grado de inhibición se reduce al aumentar [S], para la inhibición no competitiva, el grado de inhibición no cambia y para la inhibición no competitiva (también llamada anticompetitiva), el grado de inhibición aumenta con [S].
Descripción cuantitativa
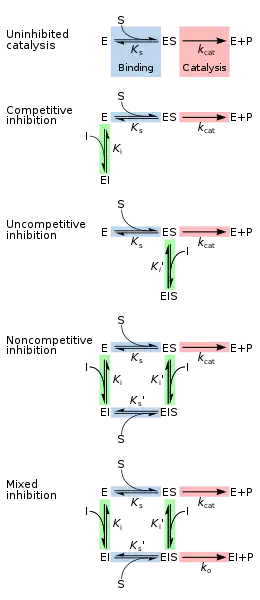
La inhibición reversible se puede describir cuantitativamente en términos de la unión del inhibidor a la enzima y al complejo enzima-sustrato, y sus efectos sobre las constantes cinéticas de la enzima. En el esquema clásico de Michaelis-Menten a continuación, una enzima (E) se une a su sustrato (S) para formar el complejo enzima-sustrato ES. Tras la catálisis, este complejo se descompone para liberar el producto P y la enzima libre. El inhibidor (I) puede unirse a E o ES con las constantes de disociación K i o K i ', respectivamente.
| Los inhibidores competitivos pueden unirse a E, pero no a ES. La inhibición competitiva aumenta la Km ( es decir, el inhibidor interfiere con la unión al sustrato), pero no afecta la Vmax (el inhibidor no obstaculiza la catálisis en ES porque no puede unirse a ES).Los inhibidores no competitivos se unen a ES. La inhibición no competitiva disminuye tanto la Km como la Vmax. El inhibidor afecta la unión del sustrato al aumentar la afinidad de la enzima por el sustrato (disminuyendo la Km) y dificultando la catálisis (disminuyendo la Vmax). Los inhibidores no competitivos tienen afinidades idénticas por E y ES (K i = K i '). La inhibición no competitiva no cambia la Km (es decir, no afecta la unión al sustrato) pero disminuye la Vmax (es decir, la unión del inhibidor dificulta la catálisis).Los inhibidores de tipo mixto se unen tanto a E como a ES, pero sus afinidades por estas dos formas de la enzima son diferentes (K i ≠ K i '). Por lo tanto, los inhibidores de tipo mixto afectan la unión al sustrato (aumentan o disminuyen la K m) y dificultan la catálisis en el complejo ES (disminuyen la V máx). |
Cuando una enzima tiene múltiples sustratos, los inhibidores pueden mostrar diferentes tipos de inhibición según el sustrato que se considere. Esto se debe a que el sitio activo contiene dos sitios de unión diferentes dentro del sitio activo, uno para cada sustrato. Por ejemplo, un inhibidor podría competir con el sustrato A por el primer sitio de unión, pero ser un inhibidor no competitivo con respecto al sustrato B en el segundo sitio de unión.
Tradicionalmente, los inhibidores enzimáticos reversibles se han clasificado como competitivos, no competitivos o no competitivos, según sus efectos sobre la Km y la Vmax. Estos diferentes efectos resultan de la unión del inhibidor a la enzima E, al complejo enzima-sustrato ES, oa ambos, respectivamente. La división de estas clases surge de un problema en su derivación y da como resultado la necesidad de usar dos constantes de enlace diferentes para un evento de enlace.La unión de un inhibidor y su efecto sobre la actividad enzimática son dos cosas claramente diferentes, otro problema que las ecuaciones tradicionales no reconocen. En la inhibición no competitiva, la unión del inhibidor da como resultado una inhibición del 100 % de la enzima solamente, y no considera la posibilidad de que haya algo intermedio. La forma común del término inhibidor también oscurece la relación entre la unión del inhibidor a la enzima y su relación con cualquier otro término de unión, ya sea la ecuación de Michaelis-Menten o una curva de respuesta a la dosis asociada con la unión del receptor del ligando. Para demostrar la relación se puede hacer el siguiente reordenamiento:
Este reordenamiento demuestra que, de manera similar a la ecuación de Michaelis-Menten, la velocidad máxima de reacción depende de la proporción de la población de enzimas que interactúa con su sustrato.
fracción de la población de enzimas unida por sustrato
fracción de la población de enzimas unida por el inhibidor
el efecto del inhibidor es el resultado del porcentaje de la población de enzimas que interactúa con el inhibidor. El único problema con esta ecuación en su forma actual es que supone una inhibición absoluta de la enzima con la unión del inhibidor, cuando de hecho puede haber una amplia gama de efectos desde el 100 % de inhibición de la rotación del sustrato hasta >0 %. Para dar cuenta de esto, la ecuación se puede modificar fácilmente para permitir diferentes grados de inhibición al incluir un término delta Vmax.
o
Este término puede definir la actividad enzimática residual presente cuando el inhibidor interactúa con enzimas individuales en la población. Sin embargo, la inclusión de este término tiene el valor agregado de permitir la posibilidad de activación si el término V max secundario resulta ser mayor que el término inicial. Para tener en cuenta también la posibilidad de activación, la notación se puede reescribir reemplazando el inhibidor "I" con un término modificador indicado aquí como "X".
Si bien esta terminología da como resultado una forma simplificada de tratar los efectos cinéticos relacionados con la velocidad máxima de la ecuación de Michaelis-Menten, destaca problemas potenciales con el término utilizado para describir los efectos relacionados con la K m. La Km relacionada con la afinidad de la enzima por el sustrato debería relacionarse en la mayoría de los casos con cambios potenciales en el sitio de unión de la enzima que resultarían directamente de las interacciones del inhibidor de la enzima. Como tal, un término similar al propuesto anteriormente para modular V max debería ser apropiado en la mayoría de las situaciones:
Constantes de disociación
Un inhibidor enzimático se caracteriza por sus dos constantes de disociación, Ki y Ki' a la enzima y al complejo enzima-sustrato, respectivamente. La constante inhibidora de la enzima Ki puede medirse directamente por varios métodos; un método especialmente preciso es la calorimetría de titulación isotérmica, en la que el inhibidor se titula en una solución de enzima y se mide el calor liberado o absorbido. Sin embargo, la otra constante de disociación Ki ' es difícil de medir directamente, ya que el complejo enzima-sustrato tiene una vida corta y experimenta una reacción química para formar el producto. Por lo tanto, Ki' generalmente se mide indirectamente, observando la actividad de la enzima bajo varias concentraciones de sustrato e inhibidor, y ajustando los datos a una ecuación de Michaelis-Menten modificada
donde los factores modificadores α y α' están definidos por la concentración de inhibidor y sus dos constantes de disociación
Así, en presencia del inhibidor, la Km y la Vmax efectivas de la enzima se convierten en (α / α') Km y (1/α') Vmax, respectivamente. Sin embargo, la ecuación de Michaelis-Menten modificada supone que la unión del inhibidor a la enzima ha alcanzado el equilibrio, lo que puede ser un proceso muy lento para los inhibidores con constantes de disociación subnanomolares. En estos casos, suele ser más práctico tratar el inhibidor de unión fuerte como un inhibidor irreversible (ver más adelante); sin embargo, todavía puede ser posible estimar K i ' cinéticamente si K i se mide de forma independiente.
Los efectos de diferentes tipos de inhibidores de enzimas reversibles sobre la actividad enzimática se pueden visualizar mediante representaciones gráficas de la ecuación de Michaelis-Menten, como gráficos de Lineweaver-Burk, gráficos de Eadie-Hofstee o gráficos de Hanes-Woolf. Los tres diagramas de Lineweaver-Burk representados en la figura adyacente a la derecha proporcionan una ilustración. En el diagrama superior, las líneas de inhibición competitiva se cruzan en el eje y, lo que ilustra que tales inhibidores no afectan la Vmax. En el diagrama inferior, las líneas de inhibición no competitiva se cruzan en el eje x, lo que muestra que estos inhibidores no afectan a K m. Sin embargo, dado que puede ser difícil estimar K i yK i ' con precisión a partir de dichos gráficos, es recomendable estimar estas constantes utilizando métodos de regresión no lineal más fiables.
Casos especiales
Parcialmente competitivo
El mecanismo de la inhibición parcialmente competitiva es similar al de la no competitiva, excepto que el complejo EIS tiene actividad catalítica, que puede ser menor o incluso mayor (activación parcialmente competitiva) que la del complejo enzima-sustrato (ES). Esta inhibición normalmente muestra una Vmax más baja, pero un valor de Km no afectado.
Sustrato y producto
La inhibición de sustrato y producto es donde el sustrato o el producto de una reacción enzimática inhibe la actividad de la enzima. Esta inhibición puede seguir patrones competitivos, no competitivos o mixtos. En la inhibición del sustrato hay una disminución progresiva de la actividad a altas concentraciones de sustrato. Esto puede indicar la existencia de dos sitios de unión al sustrato en la enzima. Con sustrato bajo, el sitio de alta afinidad está ocupado y se sigue una cinética normal. Sin embargo, a concentraciones más altas, el segundo sitio inhibidor se ocupa, inhibiendo la enzima. La inhibición del producto suele ser una característica reguladora del metabolismo y puede ser una forma de retroalimentación negativa.
Apretado lento
La inhibición hermética lenta ocurre cuando el complejo enzima-inhibidor inicial EI se isomeriza a un segundo complejo más fuertemente sostenido, EI*, pero el proceso de inhibición general es reversible. Esto se manifiesta como una inhibición enzimática que aumenta lentamente. En estas condiciones, la cinética tradicional de Michaelis-Menten da un valor falso para Ki, que depende del tiempo. El verdadero valor de Ki puede obtenerse a través de un análisis más complejo de las constantes de velocidad de encendido (kon) y apagado (koff) para la asociación de inhibidores. Consulte la inhibición irreversible a continuación para obtener más información.
Análogos de bisustrato
Los inhibidores análogos bi-sustrato son inhibidores de alta afinidad y selectividad que se pueden preparar para enzimas que catalizan reacciones bimoleculares al capturar la energía de unión de cada sustrato en una molécula. Por ejemplo, en las reacciones de transferencia de formilo de la biosíntesis de purinas, se preparó sintéticamente un potente inhibidor de aductos de múltiples sustratos (MAI) para GAR TFasa al unir análogos del sustrato de ribonucleótido de glicinamida (GAR) y el cofactor N-10-formil tetrahidrofolato para producir dideazafolato de ribonucleótido de tioglicinamida (TGDDF), o enzimáticamente a partir del sustrato GAR natural para producir GDDF.Aquí, la constante de disociación subnanomolar (KD) de TGDDF fue mayor de lo previsto, presumiblemente debido a las ventajas entrópicas obtenidas y/o interacciones positivas adquiridas a través de los átomos que unen los componentes. También se ha observado que los MAI se producen en las células mediante reacciones de profármacos como isoniazida o ligandos inhibidores de enzimas (p. ej., PTC124) con cofactores celulares como NADH y ATP, respectivamente.
Ejemplos
Como las enzimas han evolucionado para unirse fuertemente a sus sustratos, y la mayoría de los inhibidores reversibles se unen en el sitio activo de las enzimas, no sorprende que algunos de estos inhibidores tengan una estructura sorprendentemente similar a los sustratos de sus objetivos. Los inhibidores de DHFR son ejemplos destacados. Otro ejemplo de estos imitadores de sustratos son los inhibidores de la proteasa, una clase muy exitosa de medicamentos antirretrovirales utilizados para tratar el VIH. A la derecha se muestra la estructura de ritonavir, un inhibidor de la proteasa basado en un péptido y que contiene tres enlaces peptídicos. Como este fármaco se parece a la proteína que es el sustrato de la proteasa del VIH, compite con este sustrato en el sitio activo de la enzima.
Los inhibidores de enzimas a menudo se diseñan para imitar el estado de transición o el intermedio de una reacción catalizada por enzimas. Esto asegura que el inhibidor aproveche el efecto estabilizador del estado de transición de la enzima, lo que da como resultado una mejor afinidad de unión (menor Ki) que los diseños basados en sustrato. Un ejemplo de tal inhibidor del estado de transición es el fármaco antiviral oseltamivir; este fármaco imita la naturaleza plana del ion oxonio anular en la reacción de la enzima viral neuraminidasa.
Sin embargo, no todos los inhibidores se basan en las estructuras de los sustratos. Por ejemplo, a la izquierda se muestra la estructura de otro inhibidor de la proteasa del VIH tipranavir. Esta molécula no se basa en un péptido y no tiene una similitud estructural obvia con un sustrato proteico. Estos inhibidores no peptídicos pueden ser más estables que los inhibidores que contienen enlaces peptídicos, porque no serán sustratos para las peptidasas y es menos probable que se degraden.
En el diseño de fármacos es importante tener en cuenta las concentraciones de sustratos a las que están expuestas las enzimas diana. Por ejemplo, algunos inhibidores de la proteína cinasa tienen estructuras químicas similares al trifosfato de adenosina, uno de los sustratos de estas enzimas. Sin embargo, los fármacos que son simples inhibidores competitivos tendrán que competir con las altas concentraciones de ATP en la célula. Las proteínas quinasas también se pueden inhibir mediante la competencia en los sitios de unión donde las quinasas interactúan con sus proteínas de sustrato, y la mayoría de las proteínas están presentes dentro de las células en concentraciones mucho más bajas que la concentración de ATP. Como consecuencia, si dos inhibidores de la proteína quinasa se unen al sitio activo con una afinidad similar, pero solo uno tiene que competir con el ATP,
Inhibidores irreversibles
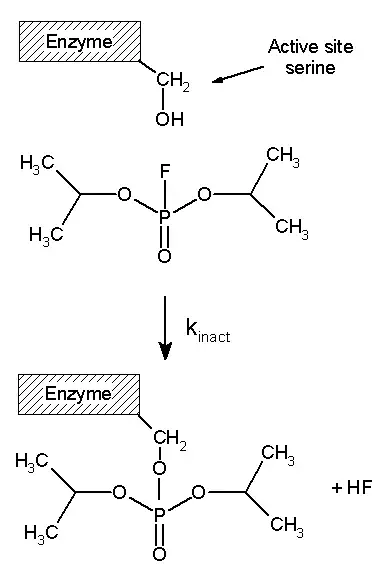
Tipos
Los inhibidores irreversibles se unen covalentemente a una enzima y, por lo tanto, este tipo de inhibición no se puede revertir fácilmente. Los inhibidores irreversibles a menudo contienen grupos funcionales reactivos como mostazas nitrogenadas, aldehídos, haloalcanos, alquenos, aceptores de Michael, sulfonatos de fenilo o fluorofosfonatos. Estos grupos electrofílicos reaccionan con las cadenas laterales de aminoácidos para formar aductos covalentes. Los residuos modificados son aquellos con cadenas laterales que contienen nucleófilos como grupos hidroxilo o sulfhidrilo; estos incluyen los aminoácidos serina (como en DFP, a la derecha), cisteína, treonina o tirosina.
La inhibición irreversible es diferente de la inactivación enzimática irreversible. Los inhibidores irreversibles generalmente son específicos para una clase de enzima y no inactivan todas las proteínas; no funcionan destruyendo la estructura de la proteína sino alterando específicamente el sitio activo de su objetivo. Por ejemplo, los extremos de pH o temperatura suelen causar la desnaturalización de toda la estructura de la proteína, pero este es un efecto no específico. De manera similar, algunos tratamientos químicos no específicos destruyen la estructura de la proteína: por ejemplo, el calentamiento en ácido clorhídrico concentrado hidrolizará los enlaces peptídicos que mantienen unidas a las proteínas, liberando aminoácidos libres.
Los inhibidores irreversibles muestran una inhibición dependiente del tiempo y, por lo tanto, su potencia no puede caracterizarse mediante un valor IC50. Esto se debe a que la cantidad de enzima activa a una concentración dada de inhibidor irreversible será diferente dependiendo de cuánto tiempo se preincuba el inhibidor con la enzima. En su lugar, se utilizan los valores de kobs /[ I ], donde kobs es la tasa de inactivación de pseudoprimer orden observada (obtenida trazando el logaritmo del % de actividad frente al tiempo) y [ I ] es la concentración de inhibidor. Los k obs /[ I] el parámetro es válido siempre que el inhibidor no sature la unión con la enzima (en cuyo caso k obs = k inact).
Medición
Los inhibidores irreversibles primero forman un complejo no covalente reversible con la enzima (EI o ESI). Posteriormente se produce una reacción química entre la enzima y el inhibidor para producir el "complejo sin salida" EI* modificado covalentemente (un complejo covalente irreversible). La tasa a la que se forma EI* se denomina tasa de inactivación o k inact. Dado que la formación de EI puede competir con ES, la unión de inhibidores irreversibles puede evitarse compitiendo con el sustrato o con un segundo inhibidor reversible. Este efecto de protección es una buena evidencia de una reacción específica del inhibidor irreversible con el sitio activo.
Los pasos de unión e inactivación de esta reacción se investigan incubando la enzima con el inhibidor y analizando la cantidad de actividad que permanece con el tiempo. La actividad disminuirá de manera dependiente del tiempo, generalmente después de una caída exponencial. El ajuste de estos datos a una ecuación de velocidad da la velocidad de inactivación a esta concentración de inhibidor. Esto se hace a varias concentraciones diferentes de inhibidor. Si está involucrado un complejo EI reversible, la tasa de inactivación será saturable y el ajuste de esta curva dará k inact y Ki.
Otro método muy utilizado en estos análisis es la espectrometría de masas. Aquí, la medición precisa de la masa de la enzima nativa no modificada y la enzima inactivada da el aumento de masa causado por la reacción con el inhibidor y muestra la estequiometría de la reacción. Esto generalmente se hace usando un espectrómetro de masas MALDI-TOF. En una técnica complementaria, la toma de huellas dactilares de la masa peptídica implica la digestión de la proteína nativa y modificada con una proteasa como la tripsina. Esto producirá un conjunto de péptidos que se pueden analizar con un espectrómetro de masas. El péptido que cambie de masa tras la reacción con el inhibidor será el que contenga el sitio de modificación.
Casos especiales
No todos los inhibidores irreversibles forman aductos covalentes con sus dianas enzimáticas. Algunos inhibidores reversibles se unen con tanta fuerza a su enzima objetivo que son esencialmente irreversibles. Estos inhibidores de unión estrecha pueden mostrar una cinética similar a la de los inhibidores irreversibles covalentes. En estos casos, algunos de estos inhibidores se unen rápidamente a la enzima en un complejo EI de baja afinidad y luego experimenta un reordenamiento más lento a un complejo EI* muy unido (ver la figura anterior). Este comportamiento cinético se denomina unión lenta. Este reordenamiento lento después de la unión a menudo implica un cambio conformacional a medida que la enzima "aprieta" alrededor de la molécula inhibidora. Los ejemplos de inhibidores de unión lenta incluyen algunos medicamentos importantes, como el metotrexato, el alopurinol y la forma activada de aciclovir.
Ejemplos
El diisopropilfluorofosfato (DFP) se muestra como un ejemplo de un inhibidor de proteasa irreversible en la figura de arriba a la derecha. La enzima hidroliza el enlace fósforo-flúor, pero el residuo de fosfato permanece unido a la serina en el sitio activo, desactivándolo. De manera similar, la DFP también reacciona con el sitio activo de la acetilcolina esterasa en las sinapsis de las neuronas y, en consecuencia, es una neurotoxina potente, con una dosis letal de menos de 100 mg.
La inhibición suicida es un tipo inusual de inhibición irreversible en la que la enzima convierte el inhibidor en una forma reactiva en su sitio activo. Un ejemplo es el inhibidor de la biosíntesis de poliaminas, α-difluorometilornitina o DFMO, que es un análogo del aminoácido ornitina y se usa para tratar la tripanosomiasis africana (enfermedad del sueño). La ornitina descarboxilasa puede catalizar la descarboxilación de DFMO en lugar de ornitina, como se muestra arriba. Sin embargo, esta reacción de descarboxilación es seguida por la eliminación de un átomo de flúor, que convierte este intermedio catalítico en una imina conjugada, una especie altamente electrófila. Esta forma reactiva de DFMO luego reacciona con un residuo de cisteína o lisina en el sitio activo para inactivar irreversiblemente la enzima.
Dado que la inhibición irreversible a menudo implica la formación inicial de un complejo EI no covalente, a veces es posible que un inhibidor se una a una enzima en más de una forma. Por ejemplo, en la figura que muestra la tripanotiona reductasa del parásito protozoario humano Trypanosoma cruzi, dos moléculas de un inhibidor llamado mostaza de quinacrina están unidas en su sitio activo. La molécula superior está unida de forma reversible, pero la inferior está unida covalentemente, ya que ha reaccionado con un residuo de aminoácido a través de su grupo mostaza nitrogenada.
Aplicaciones
Los inhibidores de enzimas se encuentran en la naturaleza y también se producen artificialmente en el laboratorio. Los inhibidores de enzimas naturales regulan muchos procesos metabólicos y son esenciales para la vida. Además, los venenos producidos naturalmente son a menudo inhibidores de enzimas que han evolucionado para usarse como agentes tóxicos contra depredadores, presas y organismos competidores. Estas toxinas naturales incluyen algunas de las sustancias más venenosas conocidas. Los inhibidores artificiales a menudo se usan como medicamentos, pero también pueden ser insecticidas como el malatión, herbicidas como el glifosato o desinfectantes como el triclosán. Otros inhibidores de enzimas artificiales bloquean la acetilcolinesterasa, una enzima que descompone la acetilcolina, y se utilizan como agentes nerviosos en la guerra química.
Control metabólico
Los inhibidores de enzimas también son importantes en el control metabólico.Muchas vías metabólicas en la célula son inhibidas por metabolitos que controlan la actividad enzimática a través de la regulación alostérica o la inhibición de sustratos. Un buen ejemplo es la regulación alostérica de la vía glucolítica. Esta vía catabólica consume glucosa y produce ATP, NADH y piruvato. Un paso clave para la regulación de la glucólisis es una reacción temprana en la vía catalizada por la fosfofructoquinasa-1 (PFK1). Cuando los niveles de ATP aumentan, el ATP se une a un sitio alostérico en PFK1 para disminuir la velocidad de la reacción enzimática; Se inhibe la glucólisis y cae la producción de ATP. Este control de retroalimentación negativa ayuda a mantener una concentración constante de ATP en la célula. Sin embargo, las vías metabólicas no solo se regulan mediante la inhibición, ya que la activación enzimática es igualmente importante. Con respecto a PFK1, fructosa 2,
La inhibición fisiológica de enzimas también puede ser producida por inhibidores de proteínas específicas. Este mecanismo ocurre en el páncreas, que sintetiza muchas enzimas digestivas precursoras conocidas como zimógenos. Muchos de estos son activados por la proteasa de tripsina, por lo que es importante inhibir la actividad de la tripsina en el páncreas para evitar que el órgano se digiera a sí mismo. Una forma en la que se controla la actividad de la tripsina es la producción de una proteína inhibidora de la tripsina específica y potente en el páncreas. Este inhibidor se une fuertemente a la tripsina, impidiendo la actividad de la tripsina que, de otro modo, sería perjudicial para el órgano. Aunque el inhibidor de tripsina es una proteína, evita que la proteasa lo hidrolice como sustrato al excluir el agua del sitio activo de la tripsina y desestabilizar el estado de transición.Otros ejemplos de proteínas inhibidoras de enzimas fisiológicas incluyen el inhibidor barstar de la ribonucleasa barnasa bacteriana.
Venenos naturales
Los animales y las plantas han evolucionado para sintetizar una amplia gama de productos venenosos, incluidos metabolitos secundarios, péptidos y proteínas que pueden actuar como inhibidores. Las toxinas naturales suelen ser moléculas orgánicas pequeñas y son tan diversas que probablemente existan inhibidores naturales para la mayoría de los procesos metabólicos. Los procesos metabólicos a los que se dirigen los venenos naturales abarcan más que las enzimas en las vías metabólicas y también pueden incluir la inhibición de las funciones de los receptores, los canales y las proteínas estructurales en una célula. Por ejemplo, el paclitaxel (taxol), una molécula orgánica que se encuentra en el tejo del Pacífico, se une fuertemente a los dímeros de tubulina e inhibe su ensamblaje en microtúbulos en el citoesqueleto.
Muchos venenos naturales actúan como neurotoxinas que pueden causar parálisis que conducen a la muerte y tienen funciones de defensa contra depredadores o en la caza y captura de presas. Algunos de estos inhibidores naturales, a pesar de sus atributos tóxicos, son valiosos para usos terapéuticos en dosis más bajas. Un ejemplo de neurotoxina son los glicoalcaloides, de las especies de plantas de la familia Solanaceae (incluye papa, tomate y berenjena), que son inhibidores de la acetilcolinesterasa. La inhibición de esta enzima provoca un aumento descontrolado del neurotransmisor acetilcolina, parálisis muscular y luego la muerte. La neurotoxicidad también puede resultar de la inhibición de los receptores; por ejemplo, la atropina de la belladona (Atropa belladonna) que funciona como un antagonista competitivo de los receptores muscarínicos de acetilcolina.
Aunque muchas toxinas naturales son metabolitos secundarios, estos venenos también incluyen péptidos y proteínas. Un ejemplo de un péptido tóxico es la alfa-amanitina, que se encuentra en los parientes del hongo del sombrero de la muerte. Este es un potente inhibidor enzimático, en este caso evitando que la enzima ARN polimerasa II transcriba el ADN. La toxina de algas microcistina también es un péptido y es un inhibidor de las proteínas fosfatasas. Esta toxina puede contaminar los suministros de agua después de la proliferación de algas y es un carcinógeno conocido que también puede causar hemorragia hepática aguda y muerte en dosis más altas.
Las proteínas también pueden ser venenos naturales o antinutrientes, como los inhibidores de tripsina (discutidos anteriormente) que se encuentran en algunas legumbres, como se muestra en la figura anterior. Una clase menos común de toxinas son las enzimas tóxicas: actúan como inhibidores irreversibles de sus enzimas objetivo y funcionan modificando químicamente sus enzimas de sustrato. Un ejemplo es la ricina, una toxina proteica extremadamente potente que se encuentra en las semillas de ricino. Esta enzima es una glucosidasa que inactiva los ribosomas. Dado que la ricina es un inhibidor irreversible catalítico, esto permite que una sola molécula de ricina mate una célula.
Drogas
Los usos más comunes de los inhibidores de enzimas son como medicamentos para tratar enfermedades. Muchos de estos inhibidores se dirigen a una enzima humana y tienen como objetivo corregir una condición patológica. Por ejemplo, la aspirina es un fármaco ampliamente utilizado que actúa como un inhibidor suicida de la enzima ciclooxigenasa. Esta inhibición, a su vez, suprime la producción de prostaglandinas proinflamatorias y, por lo tanto, la aspirina puede usarse para reducir el dolor, la fiebre y la inflamación.
Se estima que el 29% de los medicamentos actualmente aprobados son inhibidores de enzimas, de los cuales aproximadamente 1/3 son inhibidores de cinasas. Una clase notable de objetivos de fármacos de quinasa son los receptores tirosina quinasas, que son enzimas esenciales que regulan el crecimiento celular y su sobreactivación puede provocar cáncer. Por lo tanto, los inhibidores de la quinasa, como el imatinib, se usan con frecuencia para tratar las neoplasias malignas. Janus quinasas son otro ejemplo notable de dianas enzimáticas de fármacos. Los inhibidores de Janus quinasas bloquean la producción de citoquinas inflamatorias y, por lo tanto, estos inhibidores se usan para tratar una variedad de enfermedades inflamatorias que incluyen artritis, asma y enfermedad de Crohn.
Un ejemplo de la similitud estructural de algunos inhibidores con los sustratos de las enzimas a las que se dirigen se ve en la figura que compara el fármaco metotrexato con el ácido fólico. El ácido fólico es la forma oxidada del sustrato de la dihidrofolato reductasa, una enzima que es fuertemente inhibida por el metotrexato. El metotrexato bloquea la acción de la dihidrofolato reductasa y, por lo tanto, detiene la biosíntesis de timidina. Este bloqueo de la biosíntesis de nucleótidos es selectivamente tóxico para las células de crecimiento rápido, por lo que el metotrexato se usa a menudo en la quimioterapia contra el cáncer.
Un tratamiento común para la disfunción eréctil masculina es el sildenafil (Viagra), (figura, derecha). Este compuesto es un potente inhibidor de la fosfodiesterasa tipo 5 específica de cGMP, la enzima que degrada la molécula de señalización monofosfato de guanosina cíclica. Esta molécula de señalización desencadena la relajación del músculo liso y permite que la sangre fluya hacia el cuerpo cavernoso, lo que provoca una erección. Dado que el fármaco disminuye la actividad de la enzima que detiene la señal, hace que esta señal dure más tiempo.
Antibióticos
Los fármacos también se utilizan para inhibir las enzimas necesarias para la supervivencia de los patógenos. Por ejemplo, las bacterias están rodeadas por una pared celular gruesa hecha de un polímero similar a una red llamado peptidoglicano. Muchos antibióticos, como la penicilina y la vancomicina, inhiben las enzimas que producen y luego entrecruzan las hebras de este polímero. Esto hace que la pared celular pierda fuerza y las bacterias estallen. En la figura, una molécula de penicilina (que se muestra en forma de bola y barra) se muestra unida a su objetivo, la transpeptidasa de la bacteria Streptomyces R61 (la proteína se muestra como un diagrama de cinta).
El diseño de fármacos antibióticos se facilita cuando una enzima que es esencial para la supervivencia del patógeno está ausente o es muy diferente en los seres humanos. En el ejemplo anterior, los humanos no fabrican peptidoglicano, por lo tanto, los inhibidores de este proceso son selectivamente tóxicos para las bacterias. La toxicidad selectiva también se produce en los antibióticos al explotar las diferencias en la estructura de los ribosomas en las bacterias, o cómo producen ácidos grasos.
Pesticidas
Muchos pesticidas son inhibidores de enzimas. La acetilcolinesterasa (AChE) es una enzima que se encuentra en animales, desde insectos hasta humanos. Es esencial para el funcionamiento de las células nerviosas a través de su mecanismo de descomposición del neurotransmisor acetilcolina en sus constituyentes, acetato y colina. Esto es algo inusual entre los neurotransmisores, ya que la mayoría, incluidas la serotonina, la dopamina y la norepinefrina, se absorben desde la hendidura sináptica en lugar de dividirse. Una gran cantidad de inhibidores de AChE se utilizan tanto en medicina como en agricultura. Los inhibidores competitivos reversibles, como el edrofonio, la fisostigmina y la neostigmina, se utilizan en el tratamiento de la miastenia grave y en la anestesia para revertir el bloqueo muscular. Los pesticidas de carbamato también son ejemplos de inhibidores de AChE reversibles. Los plaguicidas organofosforados como el malatión, el paratión y el clorpirifos inhiben de forma irreversible la acetilcolinesterasa.
Herbicidas
El herbicida glifosato es un inhibidor de la 3-fosfoshikimato 1-carboxiviniltransferasa, otros herbicidas, como las sulfonilureas, inhiben la enzima acetolactato sintasa. Ambas enzimas son necesarias para que las plantas produzcan aminoácidos de cadena ramificada. Los herbicidas inhiben muchas otras enzimas, incluidas las enzimas necesarias para la biosíntesis de lípidos y carotenoides y los procesos de fotosíntesis y fosforilación oxidativa.
Descubrimiento y diseño de inhibidores
Los nuevos fármacos son el producto de un largo proceso de desarrollo de fármacos, cuyo primer paso suele ser el descubrimiento de un nuevo inhibidor de enzimas. En el pasado, la única forma de descubrir estos nuevos inhibidores era mediante prueba y error: examinando enormes bibliotecas de compuestos contra una enzima objetivo y esperando que surgieran algunas pistas útiles. Este enfoque de fuerza bruta todavía tiene éxito e incluso se ha ampliado con enfoques de química combinatoria que producen rápidamente una gran cantidad de compuestos nuevos y tecnología de detección de alto rendimiento para detectar rápidamente estas enormes bibliotecas químicas en busca de inhibidores útiles.
Más recientemente, se ha aplicado un enfoque alternativo: el diseño racional de fármacos utiliza la estructura tridimensional del sitio activo de una enzima para predecir qué moléculas podrían ser inhibidores. Estas predicciones luego se prueban y uno de estos compuestos probados puede ser un nuevo inhibidor. Este nuevo inhibidor se usa luego para tratar de obtener una estructura de la enzima en un complejo inhibidor/enzima para mostrar cómo la molécula se une al sitio activo, lo que permite realizar cambios en el inhibidor para intentar optimizar la unión. Este ciclo de prueba y mejora se repite luego hasta que se produce un inhibidor suficientemente potente. También se están desarrollando métodos informáticos para predecir la afinidad de un inhibidor por una enzima, como el acoplamiento molecular y la mecánica molecular.
Contenido relacionado
Historia de la biología marina
Empalme de ARN
Alosaurio
![{displaystyle {begin{alineado}{cfrac {V_{max}}{1+{cfrac {ce {[I]}}{K_{i}}}}}&={V_{max }}left({cfrac {K_{i}}{K_{i}+[{ce {I}}]}}right)&&{text{multiplicar por }}{cfrac {K_{i }}{K_{i}}}=1\&={V_{max }}left({cfrac {K_{i}+[{ce {I}}]-[{ce {I }}]}{K_{i}+[{ce {I}}]}}right)&&{text{añadir}}[{ce {I}}]-[{ce {I}} ]=0{text{ al numerador}}\&={V_{max }}left(1-{cfrac {[{ce {I}}]}{K_{i}+[{ ce {I}}]}}right)&&{text{simplificar}}{cfrac {K_{i}+[{ce {I}}]}{K_{i}+[{ce {I }}]}}=1\&=V_{max }-V_{max }{cfrac {ce {[I]}}{K_{i}+[{ce {I}}]} }&&{text{multiplicar por }}V_{max }end{alineado}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37eda4dec307f8acfca89b2d8f4811474ea764ec)
![{displaystyle {cfrac {ce {[S]}}{[{ce {S}}]+K_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb08dd139085a394e6e7370f47ebfa255f1ad685)
![{displaystyle {cfrac {ce {[I]}}{[{ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ed50a1f7a5f2c52f406b52263916ab48b268e07)
![{displaystyle V_{max }-Delta V_{max }{cfrac {ce {[I]}}{[{ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dff424ec79284c3a1cea14f0f82b0eaace53c69)
![{displaystyle V_{max 1}-(V_{max 1}-V_{max 2}){cfrac {ce {[I]}}{[{ce {I}}]+K_{ i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3874623edd9524ba2741fe448927bf5cf0ab257)
![{displaystyle V_{max 1}-(V_{max 1}-V_{max 2}){cfrac {ce {[X]}}{[{ce {X}}]+K_{ X}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/306d44733a89308883053e3b8372a8cf9ce0239b)
![{displaystyle K_{m1}-(K_{m1}-K_{m2}){cfrac {ce {[X]}}{[{ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4e0de216e1e625bb803ee725bf85c9989a15f5)
![V={frac {V_{max}[S]}{alpha K_{m}+alpha ^{prime }[S]}}={frac {(1/alpha ^{prime }) V_{máx}[S]}{(alpha /alpha ^{prime })K_{m}+[S]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![alpha =1+{frac {[I]}{K_{i}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![alpha ^{prime }=1+{frac {[I]}{K_{i}^{prime }}}.](https://wikimedia.org/api/rest_v1/media/math/render/svg/65bf16742482cae7b0743781f47c327ddcf537e3)