Hoja beta
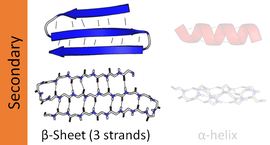
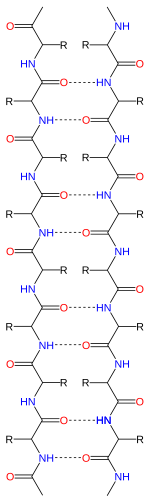
La hoja beta, (hoja β) (también hoja plisada β) es un motivo común de la estructura secundaria de la proteína regular. Las láminas beta consisten en hebras beta (hebras β) conectadas lateralmente por al menos dos o tres enlaces de hidrógeno de la columna vertebral, formando una lámina plegada generalmente retorcida. Una hebra β es un tramo de cadena polipeptídica típicamente de 3 a 10 aminoácidos de largo con un esqueleto en una conformación extendida. La asociación supramolecular de hojas β se ha implicado en la formación de fibrillas y agregados proteicos observados en la amiloidosis, en particular en la enfermedad de Alzheimer.
Historia

La primera estructura de hoja β fue propuesta por William Astbury en la década de 1930. Propuso la idea del enlace de hidrógeno entre los enlaces peptídicos de cadenas β extendidas paralelas o antiparalelas. Sin embargo, Astbury no tenía los datos necesarios sobre la geometría del enlace de los aminoácidos para construir modelos precisos, especialmente porque entonces no sabía que el enlace peptídico era plano. Linus Pauling y Robert Corey propusieron una versión refinada en 1951. Su modelo incorporó la planaridad del enlace peptídico que explicaron anteriormente como resultado de la tautomerización ceto-enol.
Estructura y orientación
Geometría
La mayoría de las hebras β están dispuestas adyacentes a otras hebras y forman una amplia red de enlaces de hidrógeno con sus vecinas en la que los grupos N−H en la columna vertebral de una hebra establecen enlaces de hidrógeno con los grupos C=O en la columna vertebral de las hebras adyacentes. En la cadena β completamente extendida, las cadenas laterales sucesivas apuntan hacia arriba y hacia abajo en un patrón alterno. Las hebras β adyacentes en una lámina β están alineadas de modo que sus átomos Cα sean adyacentes y sus cadenas laterales apunten en la misma dirección. El "plisado" la apariencia de las hebras β surge del enlace químico tetraédrico en el átomo Cα; por ejemplo, si una cadena lateral apunta hacia arriba, entonces los enlaces al C′ deben apuntar ligeramente hacia abajo, ya que su ángulo de enlace es de aproximadamente 109,5°. El plisado hace que la distancia entre Cα
i y Cα
i + 2< /span> sea de aproximadamente 6 Å (0,60 nm), en lugar de los 7,6 Å (0,76 nm) esperados de dos péptidos trans completamente extendidos. El "lado" La distancia entre átomos de Cα adyacentes en hebras β unidas por hidrógeno es de aproximadamente 5 Å (0,50 nm).
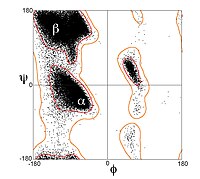
Sin embargo, las cadenas β rara vez están perfectamente extendidas; más bien, exhiben un giro. Los ángulos diedros energéticamente preferidos cerca de (φ, ψ) = (–135°, 135°) (en términos generales, la región superior izquierda del diagrama de Ramachandran) divergen significativamente del conformación completamente extendida (φ, ψ) = (–180°, 180°). El giro a menudo se asocia con fluctuaciones alternas en los ángulos diédricos para evitar que las hebras β individuales en una hoja más grande se separen. Un buen ejemplo de una horquilla β fuertemente retorcida se puede ver en la proteína BPTI.
Las cadenas laterales apuntan hacia afuera desde los pliegues de los pliegues, más o menos perpendiculares al plano de la hoja; residuos de aminoácidos sucesivos apuntan hacia afuera en caras alternas de la hoja.
Patrones de enlaces de hidrógeno
Debido a que las cadenas peptídicas tienen una direccionalidad conferida por su extremo N y extremo C, también se puede decir que las cadenas β son direccionales. Por lo general, se representan en los diagramas de topología de proteínas mediante una flecha que apunta hacia el extremo C. Las hebras β adyacentes pueden formar enlaces de hidrógeno en disposiciones antiparalelas, paralelas o mixtas.
En una disposición antiparalela, las sucesivas hebras β alternan direcciones de modo que el extremo N de una hebra es adyacente al extremo C de la siguiente. Esta es la disposición que produce la mayor estabilidad entre hebras porque permite que los enlaces de hidrógeno entre hebras entre carbonilos y aminas sean planos, que es su orientación preferida. Los ángulos diedros de la columna vertebral del péptido (φ, ψ) son aproximadamente (–140°, 135°) en láminas antiparalelas. En este caso, si dos átomos Cα
i y Cα
j son adyacentes en dos hebras β unidas por enlaces de hidrógeno, luego forman dos enlaces de hidrógeno de la columna vertebral mutuos entre sí con los grupos peptídicos flanqueantes; esto se conoce como un par cercano de enlaces de hidrógeno.
En una disposición paralela, todos los extremos N de los hilos sucesivos están orientados en la misma dirección; esta orientación puede ser ligeramente menos estable porque introduce falta de planitud en el patrón de enlaces de hidrógeno entre hebras. Los ángulos diedros (φ, ψ) son aproximadamente (–120°, 115°) en láminas paralelas. Es raro encontrar menos de cinco hebras paralelas interactuando en un motivo, lo que sugiere que un número menor de hebras puede ser inestable; sin embargo, también es fundamentalmente más difícil que se formen hojas β paralelas porque las hebras con extremos N y C alineados necesariamente deben estar alineados. ser muy distante en la secuencia. También hay evidencia de que la hoja β paralela puede ser más estable, ya que las secuencias amiloidogénicas pequeñas parecen agregarse generalmente en fibrillas de hoja β compuestas principalmente de hebras de hoja β paralelas, donde uno esperaría fibrillas antiparalelas si las antiparalelas fueran más estables..
En una estructura de hoja β paralela, si dos átomos Cα
i y Cα
j son adyacentes en dos hebras β unidas por enlaces de hidrógeno, entonces no forman enlaces de hidrógeno entre sí; más bien, un residuo forma enlaces de hidrógeno con los residuos que flanquean al otro (pero no al revés). Por ejemplo, el residuo i puede formar enlaces de hidrógeno con los residuos j − 1 y j + 1; esto se conoce como un par ancho de enlaces de hidrógeno. Por el contrario, el residuo j puede formar enlaces de hidrógeno con diferentes residuos por completo o con ninguno.
La disposición de los enlaces de hidrógeno en la lámina beta paralela se parece a la de un motivo de anillo de amida con 11 átomos.
Finalmente, una hebra individual puede exhibir un patrón de enlace mixto, con una hebra paralela en un lado y una hebra antiparalela en el otro. Dichos arreglos son menos comunes de lo que sugeriría una distribución aleatoria de orientaciones, lo que sugiere que este patrón es menos estable que el arreglo antiparalelo; sin embargo, el análisis bioinformático siempre tiene dificultades para extraer la termodinámica estructural, ya que siempre hay muchas otras características estructurales presentes en proteínas enteras. Además, las proteínas están inherentemente limitadas por la cinética de plegamiento y la termodinámica de plegamiento, por lo que siempre se debe tener cuidado al concluir la estabilidad del análisis bioinformático.
El enlace de hidrógeno de las hebras β no tiene por qué ser perfecto, pero puede presentar alteraciones localizadas conocidas como protuberancias β.
Los enlaces de hidrógeno se encuentran aproximadamente en el plano de la lámina, con los grupos carbonilo peptídicos apuntando en direcciones alternas con residuos sucesivos; a modo de comparación, los carbonilos sucesivos apuntan en la misma dirección en la hélice alfa.
Tendencias a los aminoácidos
Los residuos aromáticos grandes (tirosina, fenilalanina, triptófano) y los aminoácidos ramificados β (treonina, valina, isoleucina) se encuentran en las hebras β en el medio de las hojas β. Es probable que se encuentren diferentes tipos de residuos (como la prolina) en las hebras de borde en las hojas β, presumiblemente para evitar el "borde con borde" asociación entre proteínas que podría conducir a la agregación y formación de amiloide.
Motivos estructurales comunes
Β-motivo de horquilla
Un motivo estructural muy simple que involucra hojas β es la horquilla β, en la que dos hebras antiparalelas están unidas por un bucle corto de dos a cinco residuos, uno de los cuales es con frecuencia una glicina o una prolina, los cuales pueden suponga las conformaciones de ángulo diedro requeridas para un giro cerrado o un bucle de protuberancia β. Las hebras individuales también se pueden vincular de formas más elaboradas con bucles más largos que pueden contener hélices α.
Motivo de llave griega
El motivo de la llave griega consta de cuatro hebras antiparalelas adyacentes y sus bucles de unión. Consta de tres hebras antiparalelas conectadas por horquillas, mientras que la cuarta es adyacente a la primera y unida a la tercera por un lazo más largo. Este tipo de estructura se forma fácilmente durante el proceso de plegamiento de proteínas. Recibió su nombre de un patrón común en las obras de arte ornamentales griegas (ver meandro).
Motivo Β-α-β
Debido a la quiralidad de los aminoácidos que los componen, todas las hebras exhiben un giro hacia la derecha evidente en la mayoría de las estructuras de hoja β de orden superior. En particular, el lazo de unión entre dos hilos paralelos casi siempre tiene una quiralidad cruzada dextrógira, que se ve muy favorecida por la torsión inherente de la lámina. Este lazo de unión frecuentemente contiene una región helicoidal, en cuyo caso se denomina motivo β-α-β. Un motivo estrechamente relacionado llamado motivo β-α-β-α forma el componente básico de la estructura terciaria de la proteína más comúnmente observada, el barril TIM.

Motivo Β-meandro
Una topología de proteína supersecundaria simple compuesta por dos o más cadenas β antiparalelas consecutivas unidas entre sí por bucles de horquilla. Este motivo es común en las hojas β y se puede encontrar en varias arquitecturas estructurales, incluidos los barriles β y las hélices β.
La gran mayoría de las regiones de meandro β en las proteínas se encuentran empaquetadas contra otros motivos o secciones de la cadena polipeptídica, formando porciones del núcleo hidrofóbico que impulsa canónicamente la formación de la estructura plegada. Sin embargo, varias excepciones notables incluyen las variantes de la proteína A de la superficie externa (OspA) y las proteínas de hoja β de una sola capa (SLBP) que contienen hojas β de una sola capa en ausencia de un núcleo hidrofóbico tradicional. Estas proteínas ricas en β cuentan con láminas β de meandro β extendidas de una sola capa que se estabilizan principalmente a través de interacciones entre cadenas β e interacciones hidrofóbicas presentes en las regiones de giro que conectan hebras individuales.
Motivo Psi-loop
El motivo psi-loop (Ψ-loop) consiste en dos hebras antiparalelas con una hebra en el medio que está conectada a ambas por enlaces de hidrógeno. Hay cuatro posibles topologías de hebra para bucles Ψ simples. Este motivo es raro ya que el proceso que da como resultado su formación parece poco probable que ocurra durante el plegamiento de proteínas. El bucle Ψ se identificó por primera vez en la familia de las proteasas aspárticas.
Arquitecturas estructurales de proteínas con hojas β
Las láminas β están presentes en todos los dominios β, α+β y α/β, y en muchos péptidos o proteínas pequeñas con una arquitectura general mal definida. Todos los dominios β pueden formar barriles β, sándwiches β, prismas β, hélices β y hélices β.
Topología estructural
La topología de una hoja β describe el orden de las cadenas β unidas por hidrógeno a lo largo de la columna vertebral. Por ejemplo, el pliegue de flavodoxina tiene una hoja β paralela de cinco hebras con topología 21345; por lo tanto, las cadenas de borde son la cadena β 2 y la cadena β 5 a lo largo de la columna vertebral. Explicado explícitamente, la cadena β 2 está unida por H a la cadena β 1, que está unida por H a la cadena β 3, que está unida por H a la cadena β 4, que está unida por H a la cadena β 5, la otra hebra del borde. En el mismo sistema, el motivo clave griego descrito anteriormente tiene una topología 4123. La estructura secundaria de una hoja β se puede describir aproximadamente dando el número de hebras, su topología y si sus enlaces de hidrógeno son paralelos o antiparalelos.
Las hojas β pueden ser abiertas, lo que significa que tienen dos hebras de borde (como en el pliegue de flavodoxina o el pliegue de inmunoglobulina) o pueden ser barriles β cerrados (como el barril TIM). Los barriles β a menudo se describen por su escalonamiento o corte. Algunas láminas β abiertas son muy curvas y se doblan sobre sí mismas (como en el dominio SH3) o tienen forma de herradura (como en el inhibidor de la ribonucleasa). Las hojas β abiertas pueden ensamblarse cara a cara (como el dominio de la hélice β o el pliegue de inmunoglobulina) o de borde a borde, formando una gran hoja β.
Características dinámicas
Las estructuras de lámina plegada β están hechas de cadenas polipeptídicas de cadena β extendidas, con cadenas unidas a sus vecinas por enlaces de hidrógeno. Debido a esta conformación de la columna vertebral extendida, las hojas β resisten el estiramiento. Las hojas β en las proteínas pueden llevar a cabo un movimiento similar al de un acordeón de baja frecuencia, como se observa mediante la espectroscopia Raman y se analiza con el modelo cuasi continuo.
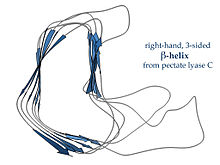
Hélices β paralelas
Una hélice β se forma a partir de unidades estructurales repetidas que consisten en dos o tres hebras β cortas unidas por bucles cortos. Estas unidades se "apilan" uno encima del otro en forma helicoidal para que las repeticiones sucesivas de la misma hebra se enlacen entre sí en una orientación paralela. Consulte el artículo sobre hélice β para obtener más información.
En las hélices β levógiras, las hebras en sí mismas son bastante rectas y sin torcer; las superficies helicoidales resultantes son casi planas, formando un prisma triangular regular, como se muestra para la anhidrasa carbónica arcaica 1QRE a la derecha. Otros ejemplos son la enzima de síntesis de lípido A LpxA y las proteínas anticongelantes de insectos con una matriz regular de cadenas laterales Thr en una cara que imitan la estructura del hielo.
Las hélices β dextrógiras, tipificadas por la enzima pectato liasa que se muestra a la izquierda o la proteína de espiga de cola del fago P22, tienen una sección transversal menos regular, más larga y dentada en uno de los lados; de los tres bucles enlazadores, uno tiene consistentemente solo dos residuos de largo y los otros son variables, a menudo elaborados para formar un sitio de unión o activo.
Una hélice β de dos lados (hacia la derecha) se encuentra en algunas metaloproteasas bacterianas; sus dos bucles tienen cada uno seis residuos de largo y se unen a iones de calcio estabilizadores para mantener la integridad de la estructura, utilizando la columna vertebral y los oxígenos de la cadena lateral de Asp de un motivo de secuencia GGXGXD. Este pliegue se denomina rollo β en la clasificación SCOP.
En patología
Algunas proteínas que son desordenadas o helicoidales como monómeros, como el amiloide β (ver placa amiloide) pueden formar estructuras oligoméricas ricas en láminas β asociadas con estados patológicos. La forma oligomérica de la proteína β amiloide está implicada como una causa de la enfermedad de Alzheimer. Su estructura aún no se ha determinado por completo, pero los datos recientes sugieren que puede parecerse a una hélice β inusual de dos cadenas.
Las cadenas laterales de los residuos de aminoácidos que se encuentran en una estructura de hoja β también se pueden organizar de manera que muchas de las cadenas laterales adyacentes en un lado de la hoja sean hidrofóbicas, mientras que muchas de las adyacentes entre sí en el lado alternativo de la hoja son polares o cargados (hidrofílicos), lo que puede ser útil si la hoja va a formar un límite entre ambientes polares/acuosos y no polares/grasos.
Contenido relacionado
Clorofita
Dhole
Nene (pájaro)