Hielo
El hielo es agua congelada en un estado sólido, que normalmente se forma a temperaturas inferiores a 0 grados centígrados o 32 °F (0 °C; 273 K) Según la presencia de impurezas, como partículas de tierra o burbujas de aire, puede aparecer transparente o de un color blanco azulado más o menos opaco.
En el Sistema Solar, el hielo es abundante y se produce naturalmente desde lugares tan cercanos al Sol como Mercurio hasta lugares tan lejanos como los objetos de la nube de Oort. Más allá del Sistema Solar, se presenta como hielo interestelar. Es abundante en la superficie de la Tierra, particularmente en las regiones polares y por encima de la línea de nieve, y, como una forma común de precipitación y deposición, juega un papel clave en el ciclo del agua y el clima de la Tierra. Cae como copos de nieve y granizo u ocurre como escarcha, carámbanos o picos de hielo y agregados de nieve como glaciares y capas de hielo.
El hielo exhibe al menos dieciocho fases (geometrías de empaque), dependiendo de la temperatura y la presión. Cuando el agua se enfría rápidamente (enfriamiento), se pueden formar hasta tres tipos de hielo amorfo dependiendo de su historial de presión y temperatura. Cuando se enfría lentamente, se produce un túnel de protones correlacionado por debajo de −253,15 °C (20 K, −423.67 °F) dando lugar a fenómenos cuánticos macroscópicos. Prácticamente todo el hielo en la superficie de la Tierra y en su atmósfera es de una estructura cristalina hexagonal denotada como hielo Ih (hablado como "hielo uno h") con rastros diminutos de hielo cúbico, denotados como hielo Ic y, encontrado más recientemente, inclusiones de hielo VII en diamantes. La transición de fase más común a hielo Ih ocurre cuando el agua líquida se enfría por debajo de 0 ° C (273.15 K, 32 °F) a presión atmosférica estándar. También puede ser depositado directamente por el vapor de agua, como sucede en la formación de escarcha. La transición del hielo al agua es el derretimiento y del hielo directamente al vapor de agua es la sublimación.
El hielo se utiliza de diversas formas, incluso para refrescarse, para deportes de invierno y para esculpir hielo.
Propiedades físicas
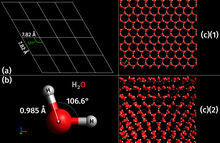
Como sólido inorgánico cristalino de origen natural con una estructura ordenada, el hielo se considera un mineral. Posee una estructura cristalina regular basada en la molécula de agua, que consta de un solo átomo de oxígeno unido covalentemente a dos átomos de hidrógeno, o H-O-H. Sin embargo, muchas de las propiedades físicas del agua y el hielo están controladas por la formación de enlaces de hidrógeno entre átomos de oxígeno e hidrógeno adyacentes; Si bien es un enlace débil, es fundamental para controlar la estructura tanto del agua como del hielo.
Una propiedad inusual del agua es que su forma sólida (hielo congelado a presión atmosférica) es aproximadamente un 8,3 % menos densa que su forma líquida; esto equivale a una expansión volumétrica del 9%. La densidad del hielo es de 0,9167–0,9168 g/cm3 a 0 °C y presión atmosférica estándar (101 325 Pa), mientras que el agua tiene una densidad de 0,9998–0,999863 g/cm3. sup> a la misma temperatura y presión. El agua líquida es más densa, esencialmente 1,00 g/cm3, a 4 °C y comienza a perder su densidad a medida que las moléculas de agua comienzan a formar cristales hexagonales de hielo cuando se alcanza el punto de congelación. Esto se debe a que los enlaces de hidrógeno dominan las fuerzas intermoleculares, lo que da como resultado un empaquetamiento de moléculas menos compactas en el sólido. La densidad del hielo aumenta ligeramente al disminuir la temperatura y tiene un valor de 0,9340 g/cm3 a −180 °C (93 K).
Cuando el agua se congela, aumenta de volumen (alrededor del 9 % para el agua dulce). El efecto de la expansión durante la congelación puede ser dramático, y la expansión del hielo es una causa básica de la erosión por congelación y descongelación de las rocas en la naturaleza y el daño a los cimientos de los edificios y las carreteras por el levantamiento de las heladas. También es una causa común de inundación de casas cuando las tuberías de agua revientan debido a la presión del agua que se expande cuando se congela.
El resultado de este proceso es que el hielo (en su forma más común) flota sobre agua líquida, que es una característica importante de la biosfera de la Tierra. Se ha argumentado que sin esta propiedad, las masas naturales de agua se congelarían, en algunos casos de forma permanente, de abajo hacia arriba, lo que provocaría la pérdida de la vida animal y vegetal que depende del fondo en el agua dulce y salada. Las capas de hielo lo suficientemente delgadas permiten el paso de la luz mientras protegen la parte inferior de las condiciones climáticas extremas a corto plazo, como la sensación térmica. Esto crea un entorno protegido para las colonias de bacterias y algas. Cuando el agua de mar se congela, el hielo se llena de canales llenos de salmuera que sostienen organismos simpágicos como bacterias, algas, copépodos y anélidos, que a su vez proporcionan alimento para animales como el krill y peces especializados como el notothen calvo, de los que se alimentan a su vez. por animales más grandes como pingüinos emperador y ballenas minke.
Cuando el hielo se derrite, absorbe tanta energía como la que se necesitaría para calentar una masa equivalente de agua a 80 °C. Durante el proceso de fusión, la temperatura permanece constante a 0 °C. Mientras se derrite, cualquier energía añadida rompe los enlaces de hidrógeno entre las moléculas de hielo (agua). La energía está disponible para aumentar la energía térmica (temperatura) solo después de que se rompen suficientes enlaces de hidrógeno para que el hielo pueda considerarse agua líquida. La cantidad de energía consumida al romper los enlaces de hidrógeno en la transición de hielo a agua se conoce como calor de fusión.
Al igual que con el agua, el hielo absorbe la luz en el extremo rojo del espectro preferentemente como resultado de un sobretono de un estiramiento del enlace oxígeno-hidrógeno (O-H). En comparación con el agua, esta absorción se desplaza hacia energías ligeramente más bajas. Por lo tanto, el hielo aparece azul, con un tinte ligeramente más verde que el agua líquida. Dado que la absorción es acumulativa, el efecto de color se intensifica con el aumento del espesor o si los reflejos internos hacen que la luz tome un camino más largo a través del hielo.
Pueden aparecer otros colores en presencia de impurezas que absorben la luz, donde la impureza dicta el color en lugar del hielo en sí. Por ejemplo, los icebergs que contienen impurezas (p. ej., sedimentos, algas, burbujas de aire) pueden aparecer de color marrón, gris o verde.
Debido a que el hielo en entornos naturales suele estar cerca de su temperatura de fusión, su dureza muestra variaciones de temperatura pronunciadas. En su punto de fusión, el hielo tiene una dureza de Mohs de 2 o menos, pero la dureza aumenta a alrededor de 4 a una temperatura de -44 °C (-47 °F) y a 6 a una temperatura de -78,5 °C (-109,3 °F), el punto de vaporización del dióxido de carbono sólido (hielo seco).
Fases
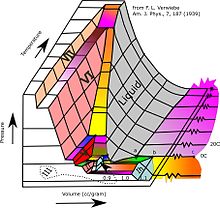
El hielo puede ser cualquiera de las 19 fases cristalinas sólidas conocidas del agua, o en un estado sólido amorfo en varias densidades.
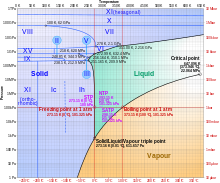
La mayoría de los líquidos bajo mayor presión se congelan a temperaturas más altas porque la presión ayuda a mantener unidas las moléculas. Sin embargo, los fuertes enlaces de hidrógeno en el agua lo hacen diferente: para algunas presiones superiores a 1 atm (0,10 MPa), el agua se congela a una temperatura por debajo de 0 °C, como se muestra en el siguiente diagrama de fases. Se cree que el derretimiento del hielo bajo altas presiones contribuye al movimiento de los glaciares.
El hielo, el agua y el vapor de agua pueden coexistir en el punto triple, que es exactamente 273,16 K (0,01 °C) a una presión de 611,657 Pa. De hecho, el kelvin se definió como 1/273,16 de la diferencia entre este punto triple y el cero absoluto, aunque esta definición cambió en mayo de 2019. A diferencia de la mayoría de los otros sólidos, el hielo es difícil de sobrecalentar. En un experimento, el hielo a -3 °C se sobrecalentó a unos 17 °C durante unos 250 picosegundos.
Sujeto a presiones más altas y temperaturas variables, el hielo se puede formar en 19 fases cristalinas separadas conocidas. Con cuidado, al menos 15 de estas fases (una de las excepciones conocidas es el hielo X) se pueden recuperar a presión ambiental y baja temperatura en forma metaestable. Los tipos se diferencian por su estructura cristalina, orden de protones y densidad. También hay dos fases metaestables de hielo bajo presión, ambas completamente desordenadas por hidrógeno; estos son IV y XII. Ice XII fue descubierto en 1996. En 2006, XIII y XIV fueron descubiertos. Los hielos XI, XIII y XIV son formas ordenadas por hidrógeno de los hielos Ih, V y XII respectivamente. En 2009, se encontró hielo XV a presiones extremadamente altas y a -143 °C. A presiones aún más altas, se prevé que el hielo se convierta en metal; se ha estimado de diversas formas que esto ocurre en 1,55 TPa o 5,62 TPa.
Además de las formas cristalinas, el agua sólida puede existir en estados amorfos como hielo amorfo (ASW) de densidades variables. El agua en el medio interestelar está dominada por hielo amorfo, por lo que probablemente sea la forma de agua más común en el universo. ASW de baja densidad (LDA), también conocida como agua vítrea hiperapagada, puede ser responsable de las nubes noctilucentes en la Tierra y generalmente se forma por la deposición de vapor de agua en condiciones de frío o vacío. El ASW de alta densidad (HDA) se forma por compresión de hielo ordinario Ih o LDA a presiones de GPa. El ASW de muy alta densidad (VHDA) es HDA ligeramente calentado a 160 K bajo presiones de 1 a 2 GPa.
En el espacio exterior, el hielo cristalino hexagonal (la forma predominante que se encuentra en la Tierra) es extremadamente raro. El hielo amorfo es más común; sin embargo, el hielo cristalino hexagonal puede formarse por acción volcánica.
El hielo de un agua superiónica teórica puede poseer dos estructuras cristalinas. A presiones superiores a 500 000 bares (7 300 000 psi), este hielo superiónico adoptaría una estructura cúbica centrada en el cuerpo. Sin embargo, a presiones superiores a 1 000 000 bares (15 000 000 psi), la estructura puede cambiar a una red cúbica centrada en la cara más estable. Se especula que el hielo superiónico podría componer el interior de gigantes de hielo como Urano y Neptuno.
| Fase | Características |
|---|---|
| Hielo amorfo | El hielo amorfo es hielo carente de estructura de cristal. El hielo amorfo existe en tres formas: baja densidad (LDA) formada a presión atmosférica, o debajo, alta densidad (HDA) y hielo amorfo de alta densidad (VHDA), formando a presión superior. Las formas de LDA mediante el enfriamiento extremadamente rápido del agua líquida ("agua cristalina hipercunada", HGW), mediante el depósito de vapor de agua en sustratos muy fríos ("agua sólida amorfo", ASW) o mediante formas de calor de alta densidad de hielo a presión ambiente ("LDA"). |
| Ice Ih | hielo hexagonal normal. Virtualmente todo hielo en la biosfera es hielo Ih, con la excepción sólo de una pequeña cantidad de hielo Ic. |
| Ice Ic | Una variante cristalina cúbica metaestable del hielo. Los átomos de oxígeno están dispuestos en una estructura de diamante. Se produce a temperaturas entre 130 y 220 K, y puede existir hasta 240 K, cuando se transforma en hielo Ih. Puede estar presente ocasionalmente en la atmósfera superior. Más recientemente, se ha demostrado que muchas muestras que fueron descritas como hielo cúbico fueron realmente apilando hielo desordenado con simetría trigonal. Las primeras muestras de hielo I con simetría cúbica (es decir, hielo cúbico) sólo fueron reportadas en 2020. |
| Ice II | Forma cristalina rhombohedral con estructura altamente ordenada. Formado de hielo Ih comprime a temperatura de 190–210 K. Cuando se calienta, se transforma en hielo III. |
| Ice III | Un hielo cristalino tetragonal, formado por agua fría hasta 250 K a 300 MPa. Menos densa de las fases de alta presión. Más que agua. |
| Hielo IV | Una fase romboedral metastable. Se puede formar mediante el calentamiento de hielo amorfo de alta densidad lentamente a una presión de 810 MPa. No se forma fácilmente sin un agente nucleante. |
| Hielo V | Una fase cristalina monoclínica. Formado por agua fría a 253 K a 500 MPa. Estructura más complicada de todas las fases. |
| Ice VI | Una fase cristalina tetragonal. Formado por agua fría a 270 K a 1.1 GPa. Exhibe la relajación de despedida. |
| Ice VII | Una fase cúbica. Las posiciones de los átomos de hidrógeno están desordenadas. Exhibe la relajación de despedida. Los bonos de hidrógeno forman dos lattices interpenetrating. |
| Ice VIIt | Forma alrededor de 5 GPa, cuando Ice VII se convierte en tetragonal. |
| Ice VIII | Una versión más ordenada del hielo VII, donde los átomos de hidrógeno asumen posiciones fijas. Se forma a partir del hielo VII, enfriándolo por debajo de 5 °C (278 K) a 2.1 GPa. |
| Ice IX | Una fase tetragonal. Formado gradualmente del hielo III enfriándolo de 208 K a 165 K, estable por debajo de 140 K y presiones entre 200 MPa y 400 MPa. Tiene densidad de 1.16 g/cm3Un poco más alto que el hielo ordinario. |
| Hielo X | Hielo simétrico protón. Formas a presión alrededor de 70 GPa, o tal vez tan baja como 30 GPa. |
| Ice XI | Una forma de equilibrio de baja temperatura y ortoorhombic de hielo hexagonal. Es ferroeléctrico. Ice XI es considerada la configuración más estable del hielo Ih. |
| Ice XII | Una fase tetragonal, metástil, densa cristalina. Se observa en el espacio de fase de hielo V y hielo VI. Se puede preparar calentando hielo amorfo de alta densidad de 77 K a aproximadamente 183 K a 810 MPa. Tiene una densidad de 1,3 g·cm−3 a 127 K (es decir, aproximadamente 1,3 veces más densa que el agua). |
| Ice XIII | Una fase cristalina monoclínica. Formado por agua fría a menos de 130 K a 500 MPa. La forma ordenada por protones del hielo V. |
| Ice XIV | Una fase cristalina ortorhombia. Formado a continuación 118 K a 1.2 GPa. La forma ordenada por protones del hielo XII. |
| Ice XV | Una forma de hielo VI ordenada por protones formada por agua enfriadora a alrededor de 80–108 K a 1.1 GPa. |
| Ice XVI | La forma cristalina menos densa de agua, topológicamente equivalente a la estructura vacía de hidratantes sII clathrate. |
| Hielo cuadrado | Los cristales de hielo cuadrado se forman a temperatura ambiente cuando se exprime entre dos capas de grafeno. El material fue una nueva fase cristalina de hielo cuando se informó por primera vez en 2014. La investigación derivada del descubrimiento anterior de que vapor de agua y agua líquida podría pasar a través de hojas laminadas de óxido de grafito, a diferencia de moléculas más pequeñas como el helio. Se cree que el efecto es impulsado por la fuerza van der Waals, que puede implicar más de 10.000 atmósferas de presión. |
| Ice XVII | Una fase hexagonal porosa con canales helicoidales, con densidad cerca del hielo XVI. Formado colocando hielo lleno de hidrógeno en un vacío y aumentando la temperatura hasta que escapen las moléculas de hidrógeno. |
| Ice XVIII | Una forma de agua también conocida como agua superionica o hielo superionico en la que los iones de oxígeno desarrollan una estructura cristalina mientras los iones de hidrógeno se mueven libremente. |
| Ice XIX | Otra fase relacionada con el hielo VI formado por agua de refrigeración a alrededor de 100 K aproximadamente 2 GPa. |
Propiedades de fricción
El bajo coeficiente de fricción ("deslizamiento") del hielo se ha atribuido a la presión de un objeto que entra en contacto con el hielo, derritiendo una fina capa de hielo y permitiendo que el objeto se deslice a través la superficie. Por ejemplo, la hoja de un patín de hielo, al ejercer presión sobre el hielo, derretiría una capa delgada, proporcionando lubricación entre el hielo y la hoja. Esta explicación, llamada "fusión a presión", se originó en el siglo XIX. Sin embargo, no tiene en cuenta el patinaje sobre hielo con temperaturas inferiores a -4 °C (25 °F; 269 K), sobre el que se suele patinar. Además, el efecto de la fusión a presión es demasiado pequeño para tener en cuenta la fricción reducida que se experimenta comúnmente.
Una segunda teoría que describe el coeficiente de fricción del hielo sugirió que las moléculas de hielo en la interfaz no pueden unirse correctamente con las moléculas de la masa de hielo debajo (y, por lo tanto, pueden moverse libremente como las moléculas de agua líquida). Estas moléculas permanecen en estado semilíquido, proporcionando lubricación independientemente de la presión ejercida contra el hielo por cualquier objeto. Sin embargo, la importancia de esta hipótesis es discutida por experimentos que muestran un alto coeficiente de fricción para el hielo usando microscopía de fuerza atómica.
Una tercera teoría es el "calentamiento por fricción", que sugiere que la fricción del material es la causa del derretimiento de la capa de hielo. Sin embargo, esta teoría no explica suficientemente por qué el hielo es resbaladizo cuando está parado, incluso a temperaturas bajo cero.
Una teoría integral de la fricción del hielo tiene en cuenta todos los mecanismos de fricción mencionados anteriormente. Este modelo permite la estimación cuantitativa del coeficiente de fricción del hielo contra diversos materiales en función de la temperatura y la velocidad de deslizamiento. En condiciones típicas relacionadas con los deportes de invierno y los neumáticos de un vehículo sobre hielo, el derretimiento de una fina capa de hielo debido al calentamiento por fricción es la razón principal del resbalamiento. El mecanismo que controla las propiedades de fricción del hielo sigue siendo un área activa de estudio científico.
Formación natural
El término que describe colectivamente todas las partes de la superficie de la Tierra donde el agua está congelada es la criosfera. El hielo es un componente importante del clima global, particularmente en lo que respecta a al ciclo del agua. Los glaciares y las capas de nieve son un importante mecanismo de almacenamiento de agua dulce; con el tiempo, pueden sublimar o derretirse. El deshielo es una fuente importante de agua dulce estacional. La Organización Meteorológica Mundial define varios tipos de hielo según su origen, tamaño, forma, influencia, etc. Los hidratos de clatrato son formas de hielo que contienen moléculas de gas atrapadas dentro de su red cristalina.
Sobre los océanos
El hielo que se encuentra en el mar puede estar en forma de hielo a la deriva flotando en el agua, hielo fijo fijado a la costa o hielo anclado si está adherido al fondo del mar. El hielo que se desprende (se desprende) de una plataforma de hielo o de un glaciar puede convertirse en un iceberg. Las corrientes y los vientos pueden unir el hielo marino para formar crestas de presión de hasta 12 metros (39 pies) de altura. La navegación a través de áreas de hielo marino se produce en aberturas denominadas "polinias" o "clientes potenciales" o requiere el uso de un barco especial llamado "rompehielos".
Sobre terrenos y estructuras
El hielo en tierra varía desde el tipo más grande llamado "capa de hielo" a casquetes de hielo y campos de hielo más pequeños a glaciares y corrientes de hielo a la línea de nieve y campos de nieve.
Aufeis es hielo en capas que se forma en los valles de los arroyos árticos y subárticos. El hielo, congelado en el lecho del arroyo, bloquea la descarga normal de agua subterránea y hace que aumente el nivel freático local, lo que provoca la descarga de agua sobre la capa congelada. Luego, esta agua se congela, lo que hace que el nivel freático aumente aún más y se repita el ciclo. El resultado es un depósito de hielo estratificado, a menudo de varios metros de espesor.
La lluvia helada es un tipo de tormenta de invierno llamada tormenta de hielo donde la lluvia cae y luego se congela produciendo una capa de hielo. El hielo también puede formar carámbanos, de apariencia similar a las estalactitas, o formas similares a las estalagmitas cuando el agua gotea y se vuelve a congelar.
El término "dique de hielo" tiene tres significados (otros discutidos más adelante). En las estructuras, una acumulación de hielo es la acumulación de hielo en un techo inclinado que impide que el agua derretida se drene adecuadamente y puede causar daños por fugas de agua en los edificios.
Sobre ríos y arroyos
El hielo que se forma sobre el agua en movimiento tiende a ser menos uniforme y estable que el hielo que se forma sobre el agua en calma. Los atascos de hielo (a veces llamados "represas de hielo"), cuando se acumulan trozos de hielo rotos, son el mayor peligro de hielo en los ríos. Los atascos de hielo pueden causar inundaciones, dañar estructuras en el río o cerca de él y dañar las embarcaciones en el río. Los atascos de hielo pueden hacer que algunas instalaciones industriales hidroeléctricas se apaguen por completo. Una presa de hielo es un bloqueo del movimiento de un glaciar que puede producir un lago proglacial. Los fuertes flujos de hielo en los ríos también pueden dañar las embarcaciones y requieren el uso de un rompehielos para mantener la navegación posible.
Los discos de hielo son formaciones circulares de hielo rodeadas de agua en un río.
El hielo panqueque es una formación de hielo que generalmente se crea en áreas con condiciones menos tranquilas.
En lagos
El hielo se forma en las aguas tranquilas de las costas, una fina capa se extiende por la superficie y luego hacia abajo. El hielo en los lagos es generalmente de cuatro tipos: primario, secundario, superpuesto y aglomerado. El hielo primario se forma primero. El hielo secundario se forma debajo del hielo primario en una dirección paralela a la dirección del flujo de calor. El hielo superpuesto se forma sobre la superficie del hielo a partir de la lluvia o el agua que se filtra a través de las grietas en el hielo y que a menudo se asienta cuando se carga con nieve.
La plataforma de hielo se produce cuando el viento arrastra pedazos de hielo flotantes que se acumulan en la costa de barlovento.
El hielo de vela es una forma de hielo podrido que se desarrolla en columnas perpendiculares a la superficie de un lago.
Un empujón de hielo ocurre cuando el movimiento del hielo, causado por la expansión del hielo y/o la acción del viento, se produce en la medida en que el hielo empuja hacia las orillas de los lagos, a menudo desplazando los sedimentos que forman la costa.
En el aire
Escarcha
La escarcha es un tipo de hielo que se forma sobre objetos fríos cuando se cristalizan gotas de agua sobre ellos. Esto se puede observar en tiempo de niebla, cuando la temperatura desciende durante la noche. La escarcha blanda contiene una alta proporción de aire atrapado, lo que hace que parezca blanca en lugar de transparente y le otorga una densidad de aproximadamente una cuarta parte de la del hielo puro. La escarcha dura es comparativamente densa.
Perdigones
Los gránulos de hielo son una forma de precipitación que consiste en pequeñas bolas de hielo translúcidas. Esta forma de precipitación también se conoce como "aguanieve" por el Servicio Meteorológico Nacional de los Estados Unidos. (En inglés británico, 'aguanieve' se refiere a una mezcla de lluvia y nieve). Los gránulos de hielo suelen ser más pequeños que las piedras de granizo. A menudo rebotan cuando golpean el suelo y, por lo general, no se congelan en una masa sólida a menos que se mezclen con lluvia helada. El código METAR para gránulos de hielo es PL.
Los gránulos de hielo se forman cuando una capa de aire por encima del punto de congelación se ubica entre 1500 y 3000 metros (4900 y 9800 pies) sobre el suelo, con aire por debajo del nivel de congelación tanto por encima como por debajo. Esto provoca el derretimiento parcial o total de los copos de nieve que caen a través de la capa cálida. A medida que vuelven a caer en la capa inferior a la congelación más cerca de la superficie, se vuelven a congelar en gránulos de hielo. Sin embargo, si la capa bajo cero debajo de la capa cálida es demasiado pequeña, la precipitación no tendrá tiempo de volver a congelarse y el resultado será una lluvia helada en la superficie. Es más probable que se encuentre un perfil de temperatura que muestre una capa cálida sobre el suelo antes de un frente cálido durante la estación fría, pero ocasionalmente se puede encontrar detrás de un frente frío que pasa.
Salve
Al igual que otras precipitaciones, el granizo se forma en las nubes de tormenta cuando las gotas de agua sobreenfriada se congelan al entrar en contacto con los núcleos de condensación, como el polvo o la suciedad. La corriente ascendente de la tormenta empuja los granizos hacia la parte superior de la nube. La corriente ascendente se disipa y los granizos caen, regresan a la corriente ascendente y se elevan nuevamente. El granizo tiene un diámetro de 5 milímetros (0,20 pulgadas) o más. Dentro del código METAR, GR se usa para indicar granizo más grande, de un diámetro de al menos 6,4 milímetros (0,25 pulgadas) y GS para más pequeño. Las piedras apenas más grandes que una pelota de golf son uno de los tamaños de granizo más frecuentes. Los granizos pueden crecer hasta 15 centímetros (6 pulgadas) y pesar más de 0,5 kilogramos (1,1 lb). En piedras de granizo grandes, el calor latente liberado por congelación adicional puede derretir la capa exterior de la piedra de granizo. Luego, el granizo puede sufrir un "crecimiento húmedo", donde la capa exterior líquida recoge otros granizos más pequeños. El granizo gana una capa de hielo y crece cada vez más con cada ascenso. Una vez que una piedra de granizo se vuelve demasiado pesada para ser sostenida por la corriente ascendente de la tormenta, cae de la nube.
El granizo se forma en nubes de tormenta fuerte, particularmente aquellas con corrientes ascendentes intensas, alto contenido de agua líquida, gran extensión vertical, gotas de agua grandes y donde una buena parte de la capa de nubes está por debajo de los 0 °C (32 °F) bajo cero. Las nubes productoras de granizo a menudo se identifican por su coloración verde. La tasa de crecimiento se maximiza a aproximadamente -13 °C (9 °F) y se vuelve extremadamente pequeña mucho por debajo de -30 °C (-22 °F) a medida que las gotas de agua sobreenfriada se vuelven escasas. Por esta razón, el granizo es más común en el interior continental de las latitudes medias, ya que la formación de granizo es considerablemente más probable cuando el nivel de congelación está por debajo de los 11 000 pies (3400 m) de altitud. El arrastre de aire seco en fuertes tormentas sobre los continentes puede aumentar la frecuencia del granizo al promover el enfriamiento por evaporación, lo que reduce el nivel de congelación de las nubes de tormenta, lo que hace que el granizo crezca en un volumen mayor. frecuencia de tormentas eléctricas que en las latitudes medias porque la atmósfera sobre los trópicos tiende a ser más cálida en una profundidad mucho mayor. El granizo en los trópicos ocurre principalmente en elevaciones más altas.
Nieve
Los cristales de nieve se forman cuando se congelan pequeñas gotas de nubes superenfriadas (de unos 10 μm de diámetro). Estas gotas pueden permanecer líquidas a temperaturas inferiores a -18 °C (255 K; 0 °F), porque para congelarse, algunas moléculas en la gota deben juntarse por casualidad para formar una disposición similar a la de un hielo. enrejado; luego la gota se congela alrededor de este "núcleo". Los experimentos muestran que este "homogéneo" la nucleación de las gotas de las nubes solo ocurre a temperaturas inferiores a -35 °C (238 K; -31 °F). En nubes más cálidas, una partícula de aerosol o "núcleo de hielo" debe estar presente en (o en contacto con) la gota para actuar como un núcleo. Nuestra comprensión de qué partículas hacen que los núcleos de hielo sean eficientes es pobre; lo que sí sabemos es que son muy raras en comparación con los núcleos de condensación de nubes en los que se forman las gotas de líquido. Las arcillas, el polvo del desierto y las partículas biológicas pueden ser eficaces, aunque no está claro en qué medida. Los núcleos artificiales se utilizan en la siembra de nubes. Luego, la gota crece por condensación de vapor de agua sobre las superficies de hielo.
Polvo de diamante
El llamado "polvo de diamante", también conocido como agujas de hielo o cristales de hielo, se forma a temperaturas cercanas a los −40 °C (−40 °F) debido al aire con una humedad ligeramente superior que se mezcla con aire más frío basado en la superficie. El identificador METAR para polvo de diamante dentro de los informes meteorológicos horarios internacionales es IC.
Ablación
La ablación del hielo se refiere tanto a su fusión como a su disolución.
El derretimiento del hielo implica la ruptura de los enlaces de hidrógeno entre las moléculas de agua. El orden de las moléculas en el sólido se rompe a un estado menos ordenado y el sólido se derrite para convertirse en líquido. Esto se logra aumentando la energía interna del hielo más allá del punto de fusión. Cuando el hielo se derrite, absorbe tanta energía como la que se necesitaría para calentar una cantidad equivalente de agua a 80 °C. Mientras se derrite, la temperatura de la superficie del hielo permanece constante a 0 °C. La velocidad del proceso de fusión depende de la eficiencia del proceso de intercambio de energía. Una superficie de hielo en agua dulce se derrite únicamente por convección libre con una velocidad que depende linealmente de la temperatura del agua, T∞, cuando T∞ es inferior a 3,98 °C, y superlinealmente cuando T∞ es igual o superior a 3,98 °C, siendo la tasa proporcional a (T ∞ − 3,98 °C)α, con α = 5/3 para < i>T∞ mucho mayor que 8 °C, y α = 4/3 para temperaturas intermedias T∞ .
En condiciones ambientales saladas, la disolución en lugar de la fusión a menudo provoca la ablación del hielo. Por ejemplo, la temperatura del Océano Ártico generalmente está por debajo del punto de fusión del hielo marino en proceso de ablación. La transición de fase de sólido a líquido se logra mezclando sal y moléculas de agua, similar a la disolución de azúcar en agua, aunque la temperatura del agua está muy por debajo del punto de fusión del azúcar. Por lo tanto, la velocidad de disolución está limitada por el transporte de sal, mientras que la fusión puede ocurrir a velocidades mucho más altas que son características del transporte de calor.
Papel en las actividades humanas
Los seres humanos han usado hielo para enfriar y conservar alimentos durante siglos, basándose en la recolección de hielo natural en varias formas y luego en la transición a la producción mecánica del material. El hielo también presenta un desafío para el transporte en varias formas y un escenario para los deportes de invierno.
Refrigeración
El hielo ha sido valorado durante mucho tiempo como un medio de enfriamiento. En el año 400 aC en Irán, los ingenieros persas ya dominaban la técnica de almacenar hielo en pleno verano en el desierto. El hielo se traía durante los inviernos desde las montañas cercanas en grandes cantidades y se almacenaba en refrigeradores enfriados de forma natural y especialmente diseñados, llamados yakhchal (que significa almacenamiento de hielo). Se trataba de un gran espacio subterráneo (hasta 5000 m3) que tenía gruesos muros (al menos dos metros en la base) hechos de un mortero especial llamado sarooj, compuesto por arena, arcilla, clara de huevo, cal, pelo de cabra y ceniza en proporciones específicas, y que se sabía que era resistente a la transferencia de calor. Se pensaba que esta mezcla era completamente impenetrable al agua. El espacio a menudo tenía acceso a un qanat y, a menudo, contenía un sistema de atrapavientos que fácilmente podía bajar las temperaturas dentro del espacio a niveles gélidos en los días de verano. El hielo se usaba para enfriar golosinas para la realeza.
Cosecha
Había industrias prósperas en la Inglaterra de los siglos XVI y XVII en las que las áreas bajas a lo largo del estuario del Támesis se inundaban durante el invierno y el hielo se recolectaba en carros y se almacenaba entre estaciones en casas de madera aisladas como provisión para una cámara de hielo que a menudo se ubicaba en grandes casas de campo, y muy utilizado para mantener fresco el pescado cuando se captura en aguas lejanas. Esto supuestamente fue copiado por un inglés que había visto la misma actividad en China. El hielo se importó a Inglaterra desde Noruega en una escala considerable ya en 1823.
En los Estados Unidos, el primer cargamento de hielo se envió desde la ciudad de Nueva York a Charleston, Carolina del Sur, en 1799 y, en la primera mitad del siglo XIX, la recolección de hielo se había convertido en un gran negocio. Frederic Tudor, conocido como el 'Rey del Hielo', trabajó en el desarrollo de mejores productos de aislamiento para envíos de hielo de larga distancia, especialmente a los trópicos; esto se conoció como el comercio de hielo.
Trieste envió hielo a Egipto, Corfú y Zante; Suiza, a Francia; y Alemania a veces se abastecía de los lagos bávaros. El edificio del parlamento húngaro usó hielo recolectado en el invierno del lago Balaton para el aire acondicionado.
Las casas de hielo se usaban para almacenar el hielo formado en el invierno, para que el hielo estuviera disponible durante todo el año, y un tipo de refrigerador antiguo conocido como nevera se enfriaba usando un bloque de hielo colocado en su interior. En muchas ciudades, no era raro tener un servicio regular de entrega de hielo durante el verano. Desde entonces, el advenimiento de la tecnología de refrigeración artificial ha dejado obsoleta la entrega de hielo.
Todavía se recolecta hielo para eventos de esculturas de hielo y nieve. Por ejemplo, se usa una sierra oscilante para obtener hielo para el Festival Internacional de Esculturas de Hielo y Nieve de Harbin cada año de la superficie congelada del río Songhua.
Producción mecánica
El hielo ahora se produce a escala industrial, para usos que incluyen almacenamiento y procesamiento de alimentos, fabricación de productos químicos, mezcla y curado de concreto y hielo de consumo o envasado. La mayoría de las máquinas de hielo comerciales producen tres tipos básicos de hielo fragmentado: en escamas, tubular y en placas, utilizando una variedad de técnicas. Las grandes máquinas de hielo por lotes pueden producir hasta 75 toneladas de hielo por día. En 2002, había 426 empresas comerciales de fabricación de hielo en los Estados Unidos, con un valor combinado de envíos de $595,487,000. Los refrigeradores domésticos también pueden hacer hielo con una máquina de hielo incorporada, que normalmente hará cubitos de hielo o hielo picado. Las unidades independientes de fabricación de hielo que fabrican cubitos de hielo a menudo se denominan máquinas de hielo.
Transporte
El hielo puede presentar desafíos para el transporte seguro por tierra, mar y aire.
Viajes terrestres
La formación de hielo en las carreteras es un peligro invernal peligroso. El hielo negro es muy difícil de ver porque carece de la superficie helada esperada. Cuando hay lluvia helada o nieve que se produce a una temperatura cercana al punto de fusión, es común que se acumule hielo en las ventanas de los vehículos. Conducir con seguridad requiere la eliminación de la acumulación de hielo. Los raspadores de hielo son herramientas diseñadas para romper el hielo y limpiar las ventanas, aunque quitar el hielo puede ser un proceso largo y laborioso.
Lo suficientemente lejos por debajo del punto de congelación, se puede formar una fina capa de cristales de hielo en la superficie interior de las ventanas. Esto suele ocurrir cuando un vehículo se ha quedado solo después de conducirlo durante un tiempo, pero puede ocurrir mientras se conduce, si la temperatura exterior es lo suficientemente baja. La humedad del aliento del conductor es la fuente de agua para los cristales. Es problemático eliminar esta forma de hielo, por lo que las personas suelen abrir ligeramente las ventanas cuando el vehículo está estacionado para que se disipe la humedad, y ahora es común que los automóviles tengan desempañadores en las ventanas traseras para resolver el problema. Un problema similar puede ocurrir en los hogares, que es una de las razones por las que muchas regiones más frías requieren ventanas de doble panel para el aislamiento.
Cuando la temperatura exterior se mantiene por debajo del punto de congelación durante períodos prolongados, se pueden formar capas muy gruesas de hielo en los lagos y otras masas de agua, aunque los lugares con agua corriente requieren temperaturas mucho más frías. El hielo puede volverse lo suficientemente grueso como para conducir automóviles y camiones. Hacer esto de forma segura requiere un grosor de al menos 30 cm (11+3 ⁄4 in).
Viajes por agua
Para los barcos, el hielo presenta dos peligros distintos. En primer lugar, el rocío y la lluvia helada pueden producir una acumulación de hielo en la superestructura de una embarcación suficiente para volverla inestable y requerir que se corte o se derrita con mangueras de vapor. En segundo lugar, los icebergs (grandes masas de hielo que flotan en el agua (normalmente se crean cuando los glaciares llegan al mar)) pueden ser peligrosos si los golpea un barco cuando está navegando. Los icebergs han sido responsables del hundimiento de muchos barcos, siendo el más famoso el Titanic. Para los puertos cercanos a los polos, estar libre de hielo, idealmente durante todo el año, es una ventaja importante. Algunos ejemplos son Murmansk (Rusia), Petsamo (Rusia, antes Finlandia) y Vardø (Noruega). Los puertos que no están libres de hielo se abren con rompehielos.
Viajes en avión
Para los aviones, el hielo puede causar una serie de peligros. A medida que un avión asciende, pasa a través de capas de aire de diferente temperatura y humedad, algunas de las cuales pueden conducir a la formación de hielo. Si se forma hielo en las alas o en las superficies de control, esto puede afectar negativamente las cualidades de vuelo de la aeronave. Durante el primer vuelo sin escalas a través del Atlántico, los aviadores británicos, el capitán John Alcock y el teniente Arthur Whitten Brown, se encontraron con tales condiciones de formación de hielo: Brown abandonó la cabina y se subió al ala varias veces para quitar el hielo que cubría las tomas de aire del motor del Aviones Vickers Vimy que estaban volando.
Una vulnerabilidad provocada por la formación de hielo que está asociada con los motores alternativos de combustión interna es el carburador. A medida que el aire es succionado a través del carburador hacia el motor, la presión de aire local disminuye, lo que provoca un enfriamiento adiabático. Por lo tanto, en condiciones húmedas cercanas al punto de congelación, el carburador estará más frío y tenderá a congelarse. Esto bloqueará el suministro de aire al motor y hará que falle. Por esta razón, los motores alternativos de aeronaves con carburadores están provistos de calentadores de admisión de aire del carburador. El uso cada vez mayor de la inyección de combustible, que no requiere carburadores, ha hecho que el "hielo del carburador" un problema menor para los motores alternativos.
Los motores a reacción no experimentan la formación de hielo en el carburador, pero la evidencia reciente indica que la formación de hielo interna puede reducir su velocidad, detenerlos o dañarlos en ciertos tipos de condiciones atmosféricas mucho más fácilmente de lo que se creía anteriormente. En la mayoría de los casos, los motores se pueden reiniciar rápidamente y los vuelos no corren peligro, pero la investigación continúa para determinar las condiciones exactas que producen este tipo de formación de hielo y encontrar los mejores métodos para prevenirlo o revertirlo en vuelo.
Recreación y deporte
El hielo también juega un papel central en la recreación invernal y en muchos deportes como el patinaje sobre hielo, el patinaje sobre hielo, el hockey sobre hielo, el bandy, la pesca en hielo, la escalada en hielo, el curling, el broomball y las carreras de trineos en bobsleigh, luge y skeleton. Muchos de los diferentes deportes que se juegan sobre hielo atraen la atención internacional cada cuatro años durante los Juegos Olímpicos de Invierno.
Una especie de velero sobre palas da lugar a la vela sobre hielo. Otro deporte es la carrera sobre hielo, en la que los conductores deben acelerar sobre el hielo del lago, al mismo tiempo que controlan el derrape de su vehículo (similar en algunos aspectos a las carreras de pista de tierra). El deporte incluso ha sido modificado para pistas de hielo.
Otros usos
Como balasto térmico
- El hielo se utiliza para enfriar y preservar la comida en cajas de hielo.
- Cubos de hielo o hielo triturado se pueden utilizar para refrescar bebidas. A medida que el hielo se derrite, absorbe el calor y mantiene la bebida cerca de 0 °C (32 °F).
- El hielo se puede utilizar como parte de un sistema de aire acondicionado, utilizando ventiladores de batería o energía solar para soplar aire caliente sobre el hielo. Esto es especialmente útil durante las ondas de calor cuando el poder está fuera y los acondicionadores de aire estándar (electrónicamente alimentados) no funcionan.
- El hielo se puede utilizar (como otros paquetes fríos) para reducir la hinchazón (disminuir el flujo sanguíneo) y el dolor presionando contra un área del cuerpo.
Como material estructural
- Los ingenieros utilizaron la fuerza sustancial del hielo del paquete cuando construyeron el primer muelle de hielo flotante de la Antártida en 1973. Estos muelles de hielo se utilizan durante operaciones de carga para cargar y descargar barcos. El personal de operaciones de flotación hace el muelle flotante durante el invierno. Ellos construyen sobre el agua de mar congelada naturalmente en McMurdo Sound hasta que el muelle alcanza una profundidad de unos 22 pies (6.7 m). Los muelles de hielo tienen una vida útil de tres a cinco años.
- Estructuras y esculturas de hielo se construyen a partir de grandes trozos de hielo o rociando agua Las estructuras son principalmente ornamentales (como en el caso de los castillos de hielo), y no prácticos para la habitación a largo plazo. Los hoteles de hielo existen de forma estacional en algunas zonas frías. Los Igloos son otro ejemplo de una estructura temporal, hecha principalmente de nieve.
- En climas fríos, las carreteras se preparan regularmente en los lagos heladas y las zonas de archipiélago. Temporalmente, incluso un ferrocarril se ha construido sobre hielo.
- Durante la Segunda Guerra Mundial, el Proyecto Habbakuk fue un programa aliado que investigó el uso de pikrete (fibras de madera mezcladas con hielo) como posible material para buques de guerra, especialmente portaaviones, debido a la facilidad con que un buque inmune a torpedos, y una cubierta grande, podría construirse por hielo. Se construyó un prototipo a pequeña escala, pero se removió la necesidad de un buque de esa índole en la guerra antes de construirlo a gran escala.
- El hielo ha sido utilizado incluso como material para una variedad de instrumentos musicales, por ejemplo por el percusionista Terje Isungset.
Sin agua
Las fases sólidas de varias otras sustancias volátiles también se denominan hielo; generalmente, un volátil se clasifica como hielo si su punto de fusión se encuentra por encima o alrededor de 100 K. El ejemplo más conocido es el hielo seco, la forma sólida de dióxido de carbono.
Un "análogo magnético" de hielo también se realiza en algunos materiales magnéticos aislantes en los que los momentos magnéticos imitan la posición de los protones en el hielo de agua y obedecen a restricciones energéticas similares a las reglas del hielo de Bernal-Fowler que surgen de la frustración geométrica de la configuración de protones en el hielo de agua. Estos materiales se llaman spin ice.
Contenido relacionado
Luis Galvani
Colombia, Maryland
David böhm