Hidroboración

En química orgánica, la hidroboración se refiere a la adición de un enlace hidrógeno-boro a ciertos enlaces dobles y triples que involucran carbono (C=C , C=N, C=O y C≡C). Esta reacción química es útil en la síntesis orgánica de compuestos orgánicos.
La hidroboración produce compuestos organoboranos que reaccionan con una variedad de reactivos para producir compuestos útiles, como alcoholes, aminas o haluros de alquilo. La reacción más conocida de los organoboranos es la oxidación para producir alcoholes, normalmente mediante peróxido de hidrógeno. Este tipo de reacción ha promovido la investigación sobre la hidroboración debido a su condición leve y a una amplia gama de alquenos tolerados. Otro subtema de investigación es la hidroboración catalizada por metales.
El desarrollo de esta tecnología y los conceptos subyacentes fueron reconocidos con el Premio Nobel de Química a Herbert C. Brown. Compartió el premio con Georg Wittig en 1979 por su investigación pionera sobre los organoboranos como importantes intermediarios sintéticos. Un complemento a la hidroboración es la carboboración, donde se incorpora un resto de carbono en lugar de hidrógeno.
Adición de un enlace H-B a dobles enlaces C-C
La hidroboración suele ser anti-Markovnikov, es decir, el hidrógeno se añade al carbono más sustituido del doble enlace. El hecho de que la regioquímica sea inversa a la de una adición típica de HX refleja la polaridad de los enlaces Bδ+-Hδ-. La hidroboración se produce a través de un estado de transición de cuatro miembros: los átomos de hidrógeno y de boro se añaden en la misma cara del doble enlace. Suponiendo que el mecanismo sea concertado, la formación del enlace C-B avanza ligeramente más rápido que la formación del enlace C-H. Como resultado, en el estado de transición, el boro desarrolla una carga parcialmente negativa, mientras que el carbono más sustituido tiene una carga parcialmente positiva. Esta carga positiva parcial está mejor soportada por el carbono más sustituido. Formalmente, la reacción es un ejemplo de reacción de transferencia de grupo. Sin embargo, un análisis de los orbitales involucrados revela que la reacción es 'pseudopericíclica' y no sujeto a las reglas de Woodward-Hoffmann para la reactividad pericíclica.
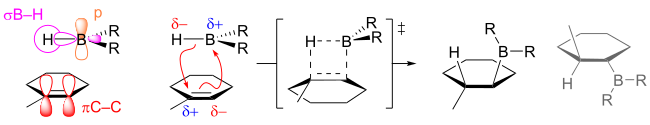
Si se utiliza BH3 como reactivo de hidroboración, las reacciones generalmente avanzan más allá de los compuestos de monoalquil borano, especialmente para olefinas pequeñas con impedimento estérico. Las olefinas trisustituidas pueden producir rápidamente dialquilboranos, pero la alquilación adicional de los organoboranos se ralentiza debido al impedimento estérico. Esta importante diferencia de velocidad en la producción de di- y tri-alquil boranos es útil en la síntesis de boranos voluminosos que pueden mejorar la regioselectividad.

Reacciones que involucran alquenos sustituidos
Para los alquenos trisustituidos como 1, el boro se coloca predominantemente en el carbono menos sustituido. El producto menor, en el que el átomo de boro se coloca sobre el carbono más sustituido, suele producirse en menos del 10%. Un caso notable con menor regioselectividad es el estireno, y la selectividad está fuertemente influenciada por el sustituyente en la posición para.

La hidroboración de alquenos 1,2-disustituidos, como una olefina cis o trans, produce generalmente una mezcla de los dos organoboranos en cantidades comparables, incluso si los sustituyentes son muy diferentes en términos de volumen estérico. Para tales olefinas 1,2-disustituidas, la regioselectividad sólo se puede observar cuando uno de los dos sustituyentes es un anillo de fenilo. En tales casos, como el trans-1-fenilpropeno, el átomo de boro se coloca en el carbono adyacente al anillo de fenilo. Las observaciones anteriores indican que la adición del enlace H-B a las olefinas está bajo control electrónico más que bajo control estérico.


Reacciones de organoboranos
Los enlaces C-B generados por la hidroboración reaccionan con varios reactivos, siendo el más común el peróxido de hidrógeno. Debido a que la adición de H-B a las olefinas es estereoespecífica, esta reacción de oxidación será diastereoselectiva cuando el alqueno esté trisustituido. La hidroboración-oxidación es, por tanto, una excelente manera de producir alcoholes de forma estereoespecífica y anti-Markovnikov.
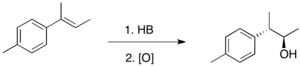
La hidroboración también puede producir aminas al tratar los organoboranos intermedios con monocloramina o ácido O-hidroxilaminosulfónico (HSA).
Las olefinas terminales se convierten en los correspondientes bromuros de alquilo y yoduros de alquilo tratando los intermedios de organoborano con bromo o yodo. Sin embargo, estas reacciones no han demostrado ser muy populares, porque los reactivos basados en succinimida, como NIS y NBS, son más versátiles y no requieren condiciones rigurosas como los organoboranos. etc.
Aductos de borano

El diborano se puede producir in situ mediante la reducción de BF3 con NaBH4 (ver Flavopiridol). Sin embargo, normalmente se utiliza el complejo de borano dimetilsulfuro BH3S(CH3)2 (BMS) como fuente de BH3. Se puede obtener en formas muy concentradas.
El aducto BH3(THF) también está disponible comercialmente como soluciones de THF en las que existe como aducto 1:1. Se degrada con el tiempo.
También se encuentran disponibles aductos de borano con fosfinas y aminas, pero no se usan ampliamente. El borano forma un fuerte aducto con trietilamina; El uso de este aducto requiere condiciones más duras de hidroboración. Esto puede resultar ventajoso en casos como la hidroboración de trienos para evitar la polimerización. Las aminas terciarias y sililicas con impedimento estérico pueden liberar borano a los alquenos a temperatura ambiente.

Boranos monosustituidos
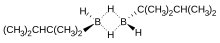
Los monoalquil boranos son relativamente raros. Cuando el grupo alquilo es pequeño, como metilo, los monoalquilboranos tienden a redistribuirse para dar mezclas de diborano y di- y trialquilboranos. Los monoalquilboranos suelen existir como dímeros de la forma [RBH2]2. Un ejemplo es el thexilborano (ThxBH2), producido por la hidroboración de tetrametiletileno:
- B2H6 + 2 Me2C=CMe2 [Me]2CHCMe2BH2]2
Un ejemplo quiral es el monoisopinocanfeilborano. Aunque a menudo se escribe como IpcBH2, es un dímero [IpcBH2]2. Se obtiene por hidroboración de (-)‐α‐pineno con sulfuro de borano dimetilo.
Hay especies de la forma RBH2 disponibles para R = alquilo y haluro. El monobromo y monocloroborano se pueden preparar a partir de BMS y los correspondientes trihaluros de boro. El complejo estable de monocloroborano y 1,4-dioxano produce la hidroboración de alquenos terminales.
Boranos disustituidos
Dimesitilborano
dimesitilborano es un dímero (C6H2Me3)2B2H2). Reacciona sólo lentamente con alquenos terminales simples. Por otro lado, los alquinos sufren monohidroboración con Mes2BH fácilmente para producir alquenilboranos.
Disiamilborano
Entre los dialquilboranos impedidos se encuentra el disiamilborano, abreviado Sia2BH. También es un dímero. Debido a su masa estérica, hidrobora selectivamente alquenos menos impedidos, generalmente terminales, en presencia de más alquenos sustituidos. El disiamilborano debe prepararse recién preparado, ya que sus soluciones sólo pueden almacenarse a 0 °C durante unas horas. El diciclohexilborano Chx2BH presenta una estabilidad térmica mejorada que el Sia2BH.
9-BBN
Un dialquilborano versátil es el 9-BBN. También llamado "borano de plátano", existe como dímero. Puede destilarse sin descomposición a 195 °C (12 mm Hg). Las reacciones con 9-BBN suelen ocurrir entre 60 y 80 °C, y la mayoría de los alquenos reaccionan en una hora. Los alquenos tetrasustituidos añaden 9-BBN a temperatura elevada. La hidroboración de alquenos con 9-BBN se produce con una regioselectividad excelente. Es más sensible a las diferencias estéricas que Sia2BH, quizás debido a su rígida columna vertebral C8. El 9-BBN es más reactivo con los alquenos que con los alquinos.
Otros boranos secundarios
Los dialquilboranos simples y sin obstáculos son reactivos a temperatura ambiente con la mayoría de los alquenos y alquinos terminales, pero son difíciles de preparar con alta pureza, ya que existen en equilibrio con mono y trialquilboranos. Una forma común de prepararlos es la reducción de dialquilhalogenoboranos con hidruros metálicos. Una aplicación sintética importante que utiliza tales dialquilboranos, como el dietilborano, es la transmetalación de los compuestos de organoboro para formar compuestos de organozinc.
Pinacolborano y catecolborano
Para la hidroboración catalítica, se utilizan ampliamente el pinacolborano y el catecolborano. También exhiben una mayor reactividad hacia los alquinos. El pinacolborano también se utiliza ampliamente en hidroboraciones sin catalizador.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar