Hexoquinasa
Una hexoquinasa es una enzima que fosforila las hexosas (azúcares de seis carbonos), formando hexosa fosfato. En la mayoría de los organismos, la glucosa es el sustrato más importante para las hexoquinasas y la glucosa-6-fosfato es el producto más importante. La hexocinasa posee la capacidad de transferir un grupo fosfato inorgánico del ATP a un sustrato.
Las hexoquinasas no deben confundirse con la glucoquinasa, que es una hexoquinasa específica que se encuentra en las bacterias. Todas las hexoquinasas son capaces de fosforilar varias hexosas, pero la hexoquinasa IV (D) a menudo se denomina erróneamente glucoquinasa, aunque no es más específica para la glucosa que las otras isoenzimas de mamíferos.
Variación
Los genes que codifican la hexoquinasa se han descubierto en todos los dominios de la vida y existen entre una variedad de especies que van desde bacterias, levaduras y plantas hasta humanos y otros vertebrados. Todas las enzimas de levaduras, plantas y vertebrados muestran una secuencia clara de homología, pero es posible que las de las bacterias no estén relacionadas.
Se clasifican como proteínas de pliegue de actina, que comparten un núcleo de sitio de unión de ATP común que está rodeado por secuencias más variables que determinan las afinidades del sustrato y otras propiedades.
Varias isoenzimas de hexoquinasa que brindan diferentes funciones pueden ocurrir en una sola especie.
Reacción
Las reacciones intracelulares mediadas por hexocinasas se pueden tipificar como:
- Hexose-CH2OH + MgATP2 - 2
→ Hexose-CH2O-PO2 - 2
3 + MgADP−
+ H+
donde hexose-CH2OH representa cualquiera de varios hexoses (como la glucosa) que contienen un acceso -CH2Oh, mestiza.
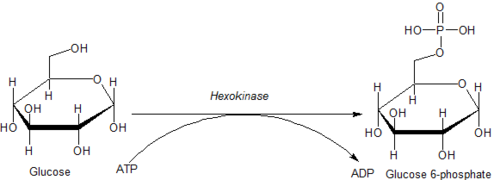
Consecuencias de la fosforilación de hexosas
La fosforilación de una hexosa como la glucosa a menudo la limita a una serie de procesos metabólicos intracelulares, como la glucólisis o la síntesis de glucógeno. Esto se debe a que las hexosas fosforiladas están cargadas y, por lo tanto, son más difíciles de transportar fuera de la célula.
En pacientes con fructosuria esencial, el metabolismo de la fructosa por la hexoquinasa a fructosa-6-fosfato es el principal método para metabolizar la fructosa de la dieta; esta vía no es significativa en individuos normales.
Tamaño de diferentes isoformas
La mayoría de las hexocinasas bacterianas tienen un tamaño aproximado de 50 kDa. Los organismos multicelulares que incluyen plantas y animales a menudo tienen más de una isoforma de hexoquinasa. La mayoría tienen un tamaño de aproximadamente 100 kDa y constan de dos mitades (terminal N y C), que comparten mucha homología de secuencia. Esto sugiere un origen evolutivo por duplicación y fusión de una hexoquinasa ancestral de 50kDa similar a las de las bacterias.
Tipos de hexoquinasa de mamífero
Hay cuatro importantes isoenzimas de hexoquinasa de mamíferos (EC 2.7.1.1) que varían en las ubicaciones subcelulares y la cinética con respecto a los diferentes sustratos y condiciones, y la función fisiológica. Se designaron hexoquinasas A, B, C y D en base a su movilidad electroforética. Los nombres alternativos de hexocinasas I, II, III y IV (respectivamente) propuestos más adelante son ampliamente utilizados.
Hexocinasas I, II y III
Las hexoquinasas I, II y III se conocen como isoenzimas de bajo Km debido a una alta afinidad por la glucosa (menos de 1 mM). Las hexocinasas I y II siguen la cinética de Michaelis-Menten a concentraciones fisiológicas de sustratos. Los tres son fuertemente inhibidos por su producto, glucosa-6-fosfato. Las masas moleculares rondan los 100 kDa. Cada uno consta de dos mitades similares de 50 kDa, pero solo en la hexoquinasa II ambas mitades tienen sitios activos funcionales.
- Hexokinasa I/A se encuentra en todos los tejidos mamíferos, y se considera una "enzima de mantenimiento", no afectada por la mayoría de los cambios fisiológicos, hormonales y metabólicos.
- Hexokinase II/B constituye la isoenzima regulada principal en muchos tipos de células y se aumenta en muchos cánceres. Es el hexokinasa encontrado en el músculo y el corazón. Hexokinase II también se encuentra en la membrana exterior mitocondria para que pueda tener acceso directo a ATP. La actividad relativa específica de hexokinasa II aumenta con pH al menos en un rango de pH de 6,9 a 8,5.
- Hexokinase III/C está inhibida por la glucosa en concentraciones fisiológicas. Poco se sabe sobre las características regulatorias de esta isoenzima.
Hexocinasa IV ("glucocinasa")
La hexoquinasa IV de mamíferos, también conocida como glucoquinasa, difiere de otras hexoquinasas en cinética y funciones.
La ubicación de la fosforilación a nivel subcelular ocurre cuando la glucoquinasa se transloca entre el citoplasma y el núcleo de las células hepáticas. La glucoquinasa solo puede fosforilar la glucosa si la concentración de este sustrato es lo suficientemente alta; no sigue la cinética de Henri-Michaelis-Menten y no tiene Km; Está medio saturado a concentraciones de glucosa 100 veces más altas que las de las hexocinasas I, II y III.
La hexoquinasa IV es monomérica, alrededor de 50 kDa, muestra una cooperatividad positiva con la glucosa y su producto, la glucosa-6-fosfato, no la inhibe alostéricamente.
La hexocinasa IV está presente en el hígado, el páncreas, el hipotálamo, el intestino delgado y quizás en otras células neuroendocrinas, y desempeña un papel regulador importante en el metabolismo de los carbohidratos. En las células β de los islotes pancreáticos, sirve como un sensor de glucosa para controlar la liberación de insulina y, de manera similar, controla la liberación de glucagón en las células α. En los hepatocitos del hígado, la glucocinasa responde a los cambios en los niveles de glucosa ambiental aumentando o reduciendo la síntesis de glucógeno.
En la glucólisis
La glucosa es única porque todas las células pueden utilizarla para producir ATP tanto en presencia como en ausencia de oxígeno molecular (O2). El primer paso de la glucólisis es la fosforilación de la glucosa por la hexoquinasa.
| D-Glucose | Hexokinasa | α-D-Glucose-6-fosfato | |
 |  | ||
| ATP | ADP | ||
 | |||
Compuesto C00031 en KEGG Pathway Database. Enzima 2.7.1.1 en KEGG Pathway Database. Compuesto C00668 en KEGG Pathway Database. Reacción R01786 en la base de datos KEGG Pathway.
Al catalizar la fosforilación de la glucosa para producir glucosa 6-fosfato, las hexocinasas mantienen el gradiente de concentración descendente que favorece el transporte facilitado de la glucosa al interior de las células. Esta reacción también inicia todas las vías fisiológicamente relevantes de utilización de la glucosa, incluidas la glucólisis y la vía de las pentosas fosfato. La adición de un grupo fosfato cargado en la posición 6 de las hexosas también asegura el 'atrapamiento' de glucosa y análogos de glucosa 2-desoxihexosa (por ejemplo, 2-desoxiglucosa y 2-fluoro-2-desoxiglucosa) dentro de las células, ya que los fosfatos de hexosa cargados no pueden atravesar fácilmente la membrana celular.
Asociación con las mitocondrias
Las hexoquinasas I y II pueden asociarse físicamente a la superficie externa de la membrana externa de las mitocondrias a través de la unión específica a una porina o canal de aniones dependiente de voltaje. Esta asociación confiere a la hexoquinasa acceso directo al ATP generado por las mitocondrias, que es uno de los dos sustratos de la hexoquinasa. La hexoquinasa mitocondrial está muy elevada en las células tumorales malignas de rápido crecimiento, con niveles hasta 200 veces más altos que los tejidos normales. Se ha demostrado que la hexocinasa unida a la mitocondria es la fuerza impulsora de las tasas glucolíticas extremadamente altas que tienen lugar aeróbicamente en las células tumorales (el llamado efecto Warburg descrito por Otto Heinrich Warburg en 1930).
Gráfico de hidropatía
Las posibles porciones transmembrana de una proteína pueden detectarse mediante análisis de hidropatía. Un análisis de hidropatía utiliza un algoritmo que cuantifica el carácter hidrofóbico en cada posición a lo largo de la cadena polipeptídica. Una de las escalas de hidropatía aceptadas es la de Kyte y Doolittle, que se basa en la generación de gráficos de hidropatía. En estas gráficas, los números negativos representan regiones hidrofílicas y los números positivos representan regiones hidrofóbicas en el eje y. Un dominio transmembrana potencial tiene una longitud de unos 20 aminoácidos en el eje x.
Se ha creado un análisis de hidropatía de hexoquinasa en levadura según estos estándares. Parece como si la hexoquinasa poseyera un único dominio transmembrana potencial ubicado alrededor del aminoácido 400. Por lo tanto, lo más probable es que la hexoquinasa no sea una proteína de membrana integral en la levadura.
Deficiencia
La deficiencia de hexoquinasa es una enfermedad genética autosómica recesiva que causa anemia hemolítica crónica. La anemia hemolítica crónica es causada por una mutación en el gen que codifica para la hexocinasa. La mutación provoca una reducción de la actividad de la hexoquinasa y, por lo tanto, una deficiencia de hexoquinasa.
Contenido relacionado
Hidracina
Ácido pícrico
Monofilia
