Hexafloruro de azufre
Hexafluoruro de azufre o hexafluoruro de azufre (ortografía británica) es un compuesto inorgánico con la fórmula SF6. Es un gas incoloro, inodoro, no inflamable y no tóxico. SF
6 tiene una geometría octaédrica, que consta de seis átomos de flúor unidos a un átomo de azufre central. Es una molécula hipervalente.
Típico de un gas no polar, SF
6 es poco soluble en agua pero bastante soluble en disolventes orgánicos no polares. Tiene una densidad de 6,12 g/L en condiciones del nivel del mar, considerablemente mayor que la densidad del aire (1,225 g/L). Generalmente se transporta como gas comprimido licuado.
SF
6 es 23.500 veces más potente que el CO2 como gas de efecto invernadero, pero existe en concentraciones relativamente menores en la atmósfera. Su concentración en la troposfera de la Tierra alcanzó las 10,63 partes por billón (ppt) en 2021, aumentando a 0,39 ppt/año. El aumento respecto de los 40 años anteriores fue impulsado en gran parte por la expansión del sector de la energía eléctrica, incluidas las emisiones fugitivas de los bancos de SF
6 gas contenido en sus cuadros de media y alta tensión. Los usos en la fabricación de magnesio, aluminio y productos electrónicos también aceleraron el crecimiento atmosférico.
Síntesis y reacciones
El hexafluoruro de azufre en la Tierra existe principalmente como un gas industrial creado por el hombre, pero también se ha descubierto que se produce de forma natural.
SF
6 se puede preparar a partir de los elementos mediante la exposición de S8 a F2. Este fue también el método utilizado por los descubridores Henri Moissan y Paul Lebeau en 1901. Algunos otros fluoruros de azufre se cogeneran, pero se eliminan calentando la mezcla para desproporcionar cualquier S2F10 (que es altamente tóxico) y luego lavando el producto con NaOH para destruir el SF4 restante.
Como alternativa, utilizando bromo, se puede sintetizar hexafluoruro de azufre a partir de SF4 y CoF3 a temperaturas más bajas (por ejemplo, 100 °C), de la siguiente manera:
Prácticamente no existe ninguna reacción química para SF
sub style="font-size:inherit;line-height:inherit;vertical-align:baseline">6. Una contribución principal a la inercia del SF6 es el impedimento estérico del átomo de azufre, mientras que sus homólogos más pesados del grupo 16, como el SeF6, son más reactivos que el SF6 como resultado de un menor impedimento estérico (ver ejemplo de hidrólisis). No reacciona con el sodio fundido por debajo de su punto de ebullición, pero reacciona exotérmicamente con el litio.
Aplicaciones
La industria de la energía eléctrica utilizó alrededor del 80% del hexafluoruro de azufre producido en 2000, principalmente como medio dieléctrico gaseoso. Otros usos principales a partir de 2015 incluyeron un grabador de silicio para la fabricación de semiconductores y un gas inerte para la fundición de magnesio.
Medio dieléctrico
SF
6 se utiliza en la industria eléctrica como medio dieléctrico gaseoso para disyuntores y aparamenta de hexafluoruro de azufre de alto voltaje y otros equipos eléctricos, que a menudo reemplazan los disyuntores llenos de aceite (OCB) que pueden contener bifenilos policlorados (PCB) dañinos. SF
6 el gas bajo presión se utiliza como aislante en aparamentas aisladas por gas (GIS) porque tiene una rigidez dieléctrica mucho mayor que aire o nitrógeno seco. La alta rigidez dieléctrica es el resultado de la alta electronegatividad y densidad del gas. Esta propiedad permite reducir significativamente el tamaño del equipo eléctrico. Esto hace que los GIS sean más adecuados para determinados fines, como la colocación en interiores, a diferencia de los equipos eléctricos aislados en aire, que ocupan considerablemente más espacio.
Los equipos eléctricos aislados en gas también son más resistentes a los efectos de la contaminación y el clima, además de ser más confiables en su funcionamiento a largo plazo debido a su entorno operativo controlado. La exposición a un arco descompone químicamente SF
6 aunque la mayoría de los productos de descomposición tienden a reformarse rápidamente SF
6, un proceso denominado "autocuración". La formación de arcos o coronas pueden producir decafluoruro de disulfuro (S2F10), un gas altamente tóxico, con una toxicidad similar a la del fosgeno. S
2F
10 fue considerado un potencial agente de guerra química en la Segunda Guerra Mundial porque no produce lagrimeo ni irritación de la piel, por lo que apenas advierte de la exposición.
SF
6 también se encuentra comúnmente como un dieléctrico de alto voltaje en los suministros de alto voltaje de los aceleradores de partículas, como Van generadores de Graaff y Pelletrons y microscopios electrónicos de transmisión de alto voltaje.
Alternativas a SF
6 como gas dieléctrico incluye varias fluorocetonas. Se ha introducido la tecnología GIS compacta que combina la conmutación en vacío con aislamiento de aire limpio para un subconjunto de aplicaciones de hasta 420 kV.
Uso médico
SF
6 se utiliza para proporcionar un taponamiento o tapón de un agujero de retina en operaciones de reparación de desprendimiento de retina en forma de una burbuja de gas. Es inerte en la cámara vítrea. Inicialmente, la burbuja duplica su volumen en 36 horas debido a la entrada de oxígeno y nitrógeno, antes de ser absorbida en la sangre en 10 a 14 días.
SF
6 se utiliza como agente de contraste para imágenes de ultrasonido. Las microburbujas de hexafluoruro de azufre se administran en solución mediante inyección en una vena periférica. Estas microburbujas mejoran la visibilidad de los vasos sanguíneos en la ecografía. Esta aplicación se ha utilizado para examinar la vascularidad de los tumores. Permanece visible en la sangre durante 3 a 8 minutos y los pulmones lo exhalan.
Compuesto trazador
El hexafluoruro de azufre fue el gas trazador utilizado en la primera calibración del modelo de dispersión de aire en carreteras; Este programa de investigación fue patrocinado por la Agencia de Protección Ambiental de EE. UU. y se llevó a cabo en Sunnyvale, California, en la autopista 101 de EE. UU. Gaseoso SF
6 es Se utiliza como gas trazador en experimentos a corto plazo sobre la eficiencia de la ventilación en edificios y recintos interiores, y para determinar las tasas de infiltración. Dos factores principales recomiendan su uso: su concentración se puede medir con precisión satisfactoria en concentraciones muy bajas, y la atmósfera de la Tierra tiene una concentración insignificante de SF
6</sub .
Se utilizó hexafluoruro de azufre como gas de prueba no tóxico en un experimento en la estación de metro St John's Wood en Londres, Reino Unido, el 25 de marzo de 2007. El gas se liberó por toda la estación y se controló a medida que se desplazaba. alrededor. El objetivo del experimento, que había sido anunciado a principios de marzo por el Secretario de Estado de Transporte, Douglas Alexander, era investigar cómo el gas tóxico podría propagarse por las estaciones y edificios del metro de Londres durante un ataque terrorista.
El hexafluoruro de azufre también se utiliza habitualmente como gas trazador en pruebas de contención de campanas extractoras de laboratorio. El gas se utiliza en la etapa final de calificación de la campana extractora ASHRAE 110. Se genera una columna de gas dentro de la campana extractora y se realiza una batería de pruebas mientras un analizador de gas dispuesto fuera de la campana toma muestras de SF6 para verificar las propiedades de contención de la campana extractora.
Se ha utilizado con éxito como trazador en oceanografía para estudiar la mezcla diapicnal y el intercambio de gases entre el aire y el mar.
Otros usos
- La industria del magnesio utiliza SF
6 como un inerte "gas tapa" para prevenir la oxidación durante el casting. Una vez que el mayor usuario, el consumo ha disminuido enormemente con captura y reciclaje. - Las ventanas de acristalamiento aisladas lo han utilizado como relleno para mejorar su rendimiento de aislamiento térmico y acústico.
- SF
6 El plasma se utiliza en la industria semiconductora como un etchant en procesos como el etching reactivo profundo. Una pequeña fracción de la SF
6 descompone en el plasma en azufre y flúor, con los iones fluorinos que realizan una reacción química con silicio. - Los neumáticos llenos de ella tardan más en desinflarse de la difusión a través del caucho debido al tamaño de molécula más grande.
- Nike también lo usó para obtener una patente y llenar las bolsas de cojín en todos sus zapatos de marca "Air" de 1992 a 2006. Durante el pico de 1997 se utilizaron 277 toneladas.
- El torpedo Mark 50 de la Armada de los Estados Unidos cerró el sistema de propulsión del ciclo Rankine está alimentado por hexafluoruro de azufre en una reacción exotérmica con litio sólido.
- Las ondas en sistemas de microondas de alta potencia se presurizan con él. El gas aísla eléctricamente la guía de onda, evitando el arcing interno.
- Los altavoces electrostáticos lo han utilizado debido a su alta resistencia dieléctrica y alto peso molecular.
- El decafluoruro de arma química se produce con él como materia prima.
- Para fines de entretenimiento, cuando respiraba, SF
6 hace que la voz se vuelva significativamente más profunda, debido a que su densidad es mucho mayor que el aire. Este fenómeno está relacionado con el efecto más conocido de respirar helio de baja densidad, lo que hace que la voz de alguien sea mucho más alta. Ambos efectos sólo deben intentarse con precaución, ya que estos gases desplazan el oxígeno que los pulmones intentan extraer del aire. El hexafluoruro de azufre también es ligeramente anestésico. - Para demostraciones científicas / magia como "agua invisible" ya que un barco de aluminio ligero se puede flotar en un tanque, como un globo lleno de aire.
- Se utiliza para mediciones de puntos de referencia y calibración en experimentos de Acoplamiento Electron Asociativo y Disociativo (DEA)
Gases de efecto invernadero
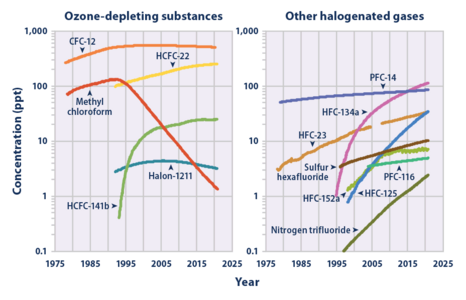
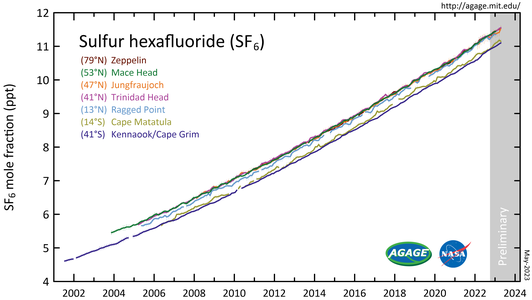
Hexafluoruro de azufre (SF)6) medido por el Experimento Avanzado de Gases Atmosféricos Globales (AGAGE) en la atmósfera inferior (troposfera) en estaciones alrededor del mundo. Las abundancias se dan como fracciones de lunares mensuales libres de contaminación en partes por millón.
Abundancia y tasa de crecimiento SF
6 en la troposfera de la Tierra (1978-2018).Concentración atmosférica de SF6 vs. gases hechos por el hombre similares (gráfico derecho). Tenga en cuenta la escala de registro.
Según el Panel Intergubernamental sobre Cambio Climático, SF
6 es el gas de efecto invernadero más potente. Su potencial de calentamiento global es 23.900 veces mayor que el del CO2 en comparación con un período de 100 años. El hexafluoruro de azufre es inerte en la troposfera y la estratosfera y tiene una vida extremadamente larga, con una vida atmosférica estimada de 800 a 3200 años.
Las mediciones de SF6 muestran que su proporción de mezcla promedio global ha aumentado desde una base estable de aproximadamente 54 partes por cuatrillón antes de la industrialización, a más de 11 partes por billón (ppt) en junio de 2022., y está aumentando aproximadamente 0,4 ppt (3,5 por ciento) por año. Las concentraciones globales promedio de SF6 aumentaron aproximadamente un siete por ciento por año durante las décadas de 1980 y 1990, principalmente como resultado de su uso en la producción de magnesio y por parte de las empresas de servicios eléctricos y fabricantes de productos electrónicos. Dadas las pequeñas cantidades de SF6 liberadas en comparación con el dióxido de carbono, se estima que su contribución individual general al calentamiento global es inferior al 0,2 por ciento; sin embargo, la contribución colectiva de éste y de gases halogenados similares producidos por el hombre ha disminuido. alcanzó alrededor del 10 por ciento en 2020. Se están probando alternativas.
En Europa, SF
6 cae bajo la directiva F-Gas que prohíbe o controla su uso para varias aplicaciones. Desde el 1 de enero de 2006, SF
6 está prohibido como gas trazador y en todas las aplicaciones excepto en aparamentas de alto voltaje. En 2013 se informó que un esfuerzo de tres años por parte del Departamento de Energía de los Estados Unidos para identificar y reparar fugas en sus laboratorios en los Estados Unidos, como el Laboratorio de Física del Plasma de Princeton, donde el gas se utiliza como aislante de alto voltaje, había tenido éxito. ha sido productivo, reduciendo las fugas anuales en 1.030 kilogramos (2.280 libras). Esto se hizo comparando las compras con el inventario, asumiendo que la diferencia se había filtrado y luego localizando y reparando las fugas.
Efectos fisiológicos y precauciones
El hexafluoruro de azufre es un gas no tóxico, pero al desplazar el oxígeno en los pulmones, también conlleva el riesgo de asfixia si se inhala demasiado. Dado que es más denso que el aire, una cantidad sustancial de gas, cuando se libera, se asentará en áreas bajas y presentará un riesgo significativo de asfixia si se ingresa en el área. Esto es particularmente relevante para su uso como aislante en equipos eléctricos, ya que los trabajadores pueden estar en zanjas o fosos debajo de equipos que contienen SF
6.
Como ocurre con todos los gases, la densidad de SF
6 afecta las frecuencias de resonancia del tracto vocal, cambiando así drásticamente la cualidades del sonido vocal, o timbre, de quienes lo inhalan. No afecta las vibraciones de las cuerdas vocales. La densidad del hexafluoruro de azufre es relativamente alta a temperatura y presión ambiente debido a la gran masa molar del gas. A diferencia del helio, que tiene una masa molar de aproximadamente 4 g/mol y eleva el tono de la voz, SF
6 tiene una masa molar de aproximadamente 146 g/mol, y la velocidad del sonido a través del gas es de aproximadamente 134 m/s a temperatura ambiente, lo que baja el tono de la voz. A modo de comparación, la masa molar del aire, que es aproximadamente un 80 % de nitrógeno y un 20 % de oxígeno, es de aproximadamente 30 g/mol, lo que conduce a una velocidad del sonido de 343 m/s.
El hexafluoruro de azufre tiene una potencia anestésica ligeramente menor que el óxido nitroso; Está clasificado como un anestésico suave.
Contenido relacionado
Nicolás Ager
Japanese destroyer Ikazuchi (1931)
Trisomía del cromosoma 15q
![Abundance and growth rate of SF 6 in Earth's troposphere (1978-2018).[9]](https://upload.wikimedia.org/wikipedia/commons/thumb/7/7b/AGAGE_sulfur_hexafluroride_growth.png/404px-AGAGE_sulfur_hexafluroride_growth.png)