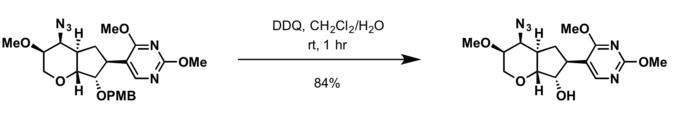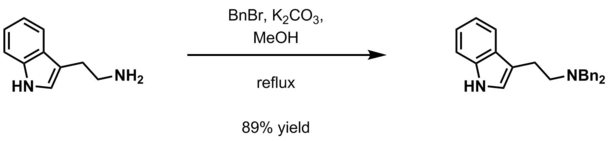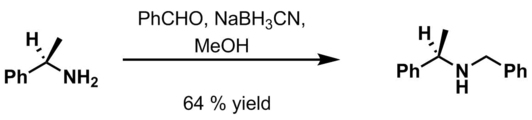Grupo bencilo
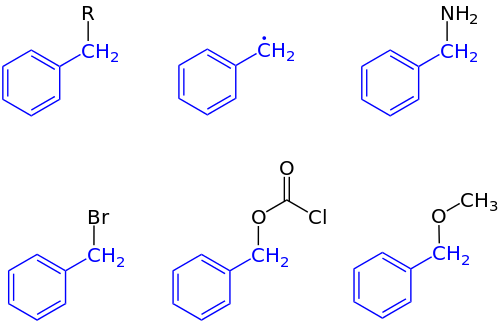
En química orgánica, bencilo es el sustituyente o fragmento molecular que posee la estructura R−CH2−C6H5. El bencilo presenta un anillo de benceno (C6H6) unido a un grupo metileno (−CH2-).
Nomenclatura
En la nomenclatura IUPAC, el prefijo bencilo se refiere a un C6H5CH2 sustituyente, por ejemplo cloruro de bencilo o benzoato de bencilo. El bencilo no debe confundirse con el fenilo con la fórmula C6H5. El término bencílico se utiliza para describir la posición del primer carbono unido a un benceno u otro anillo aromático. Por ejemplo, (C6H5) (CH3)2C + se conoce como un compuesto "bencílico" carbocatión. El radical libre bencilo tiene la fórmula C6H5CH2•. El catión bencilo o ion fenilcarbenio es el carbocatión con fórmula C6H5CH+2; el anión bencilo o ion fenilmetanuro es el carbanión con la fórmula C6H5CH−2. Ninguna de estas especies puede formarse en cantidades significativas en la fase de solución en condiciones normales, pero son referentes útiles para la discusión de los mecanismos de reacción y pueden existir como intermedios reactivos.
Abreviaturas
El bencilo se abrevia más comúnmente como Bn. Por ejemplo, el alcohol bencílico se puede representar como BnOH. Las abreviaturas menos comunes son Bzl y Bz, la última de las cuales es ambigua ya que también es la abreviatura estándar para el grupo benzoilo C6H5C(O)−. Asimismo, el bencilo no debe confundirse con el grupo fenilo C6H5−, abreviado Ph.
Reactividad de los centros bencilicos
La reactividad mejorada de las posiciones bencilicas se atribuye a la baja energía de disociación de bonos bencilicos C−H. Específicamente, el vínculo C6H5CH2− H es aproximadamente 10–15% más débil que otros tipos de bonos C—H. El anillo aromático vecino estabiliza radicales benzyl. Los datos tabulados a continuación comparan la unión bencilica C−H con las fortalezas de unión C−H relacionadas.
| Bond | Bond | Bond-disociation energy | Comentario | |
|---|---|---|---|---|
| (kcal/mol) | (kJ/mol) | |||
| C6H5CH2− H | vínculo bencilico C−H | 90 | 377 | akin to allylic C−H bonds tales bonos muestran mayor reactividad |
| H3C-H | Metil C−H bond | 105 | 439 | uno de los más fuertes bonos aliphatic C−H |
| C2H5− H | bono de etilo C−H | 101 | 423 | ligeramente más débil que H3C-H |
| C6H5− H | vínculo fenil C−H | 113 | 473 | comparable a vinilo radical, raro |
| CH2= CHCH2− H | unión allílica C-H | 89 | 372 | similar to benzylic C-H |
| (C)6H4)2CHH | enlace fluorenilo C-H | 80 | más activado vs diphenylmethyle (pKa = 22.6) | |
| (C)6H5)2CHH | diphenylmethyl C–H bond | 82 | "doblemente bencilico" (pKa = 32.2) | |
| (C)6H5)3C-H | bonos C-H | 81 | 339 | "triply benzylic" |
La debilidad del vínculo C—H refleja la estabilidad del radical bencilico. Por razones conexas, los sustitutos benciicos exhiben una reactividad mejorada, como en la oxidación, la halogenación radical libre o la hidrogenolisis. Como ejemplo práctico, en presencia de catalizadores adecuados, p-xilene oxida exclusivamente en las posiciones bencilicas para dar ácido tereftaico:
- HO2CC6H4CO2H + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">CH3C6H4CH3+3O2restablecimiento restablecimiento HOMBRE2CC6H4CO2H+2H2O{displaystyle {ce {CH3C6H4CH3 + 3 O2 - titulada HO2CC6H4CO2H + 2 H2O}}
HO2CC6H4CO2H + 2 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/686d432cc861a6b50cf0fefec8577d00c925bfda" style="vertical-align: -1.005ex; width:53.921ex; height:2.843ex;"/>
Este método produce anualmente millones de toneladas de ácido tereftálico.
Funcionalización en la posición bencílica
En algunos casos, estas transformaciones bencilicas ocurren en condiciones adecuadas para la síntesis del laboratorio. La reacción Wohl-Ziegler brominará un vínculo bencilico C-H: (ArCHR2 → ArCBrR2). Cualquier grupo de alquilo bencilico no-terario será oxidado a un grupo de carboxilo por permanganato de potasio acuoso (KMnO4) o ácido nítrico concentrado (HNO3):ArCHR2 → ArCOOH). Finalmente, el complejo de trióxido de cromo y 3,5-dimetilpirazol (CrO3−dmpyz) xidizará selectivamente un grupo de metileno bencilico a un carbonilo: (ArCH2R → ArC(O)R). El ácido 2-iodoxibenzoico en DMSO funciona de forma similar.
Como grupo de protección
Ocasionalmente se emplean grupos bencilo como grupos protectores en síntesis orgánica. Su instalación y especialmente su eliminación requieren condiciones relativamente duras, por lo que normalmente no se prefiere el bencilo como protección.
Protección contra el alcohol
El bencilo se usa comúnmente en síntesis orgánica como un grupo protector robusto para alcoholes y ácidos carboxílicos.
- Tratamiento del alcohol con una base fuerte como hidroxido de potasio en polvo o hidrato de sodio y halido de benzyl (BnCl o BnBr)
- La monobencilación de diodos se puede lograr utilizando Ag2O en dimetilformamida (DMF) a temperaturas elevadas en ambiente
- Los alcoholes primarios pueden ser vacilados selectivamente en presencia de grupos funcionales fenoles usando Cu(acac)2
Métodos de desprotección
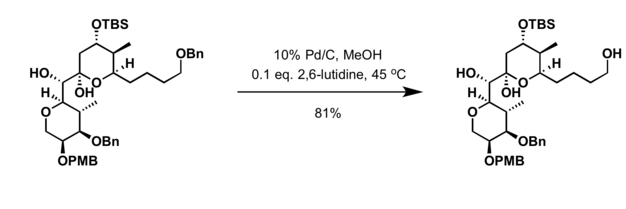
Los éteres bencílicos se pueden eliminar en condiciones reductoras, condiciones oxidativas y el uso de ácidos de Lewis.
- Los grupos de protección de Benzyl pueden eliminarse usando una amplia gama de agentes oxidantes, incluyendo:
- Ácido CrO3/acetico a temperatura ambiente
- Ozono
- N-Bromosuccinimida (NBS)
- N-Iodosuccinimida (NIS)
- Trimethylsilyl iodide (Me3SiI) en diclorometano a temperatura ambiente (la selectividad se puede lograr en condiciones específicas)
El grupo de protección de p-metoxibenzyl
Elp-metoxibencilo (
PMB) se utiliza como grupo protector de alcoholes en síntesis orgánica (el 4-metoxibencenotiol se utiliza para proteger los tioles).
- Base fuerte como hidroxido de potasio en polvo o hidrato de sodio y p-metoxibenzyl halide (cloruro o bromuro)
- 4-metoxibenzyl-2,2,2-trichloroacetimidate se puede utilizar para instalar el grupo PMB en presencia de:
Métodos de desprotección
- 2,3-Dicloro-5,6-dicyano-p-benzoquinona (DDQ)
- Condiciones para la desprotección del grupo benzyl son aplicables para el escote del grupo de protección PMB
Protección contra aminas
El grupo bencilo se utiliza ocasionalmente como grupo protector de aminas en síntesis orgánica. Existen otros métodos.
- Aqueous potassium carbonate and benzyl halide (BnCl, BnBr) in methanol
- Benzaldehyde, 6 M HCl y NaBH3CN en metanol
Métodos de desprotección
- Hidrogenación en presencia del catalizador del palladio

Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar