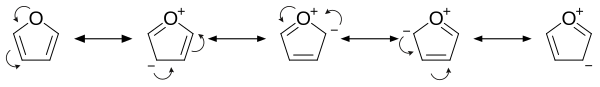Furano
furano es un compuesto orgánico heterocíclico, que consta de un anillo aromático de cinco miembros con cuatro átomos de carbono y un átomo de oxígeno. Los compuestos químicos que contienen dichos anillos también se denominan furanos.
El furano es un líquido incoloro, inflamable y altamente volátil con un punto de ebullición cercano a la temperatura ambiente. Es soluble en disolventes orgánicos comunes, incluidos alcohol, éter y acetona, y ligeramente soluble en agua. Su olor es "fuerte, etéreo; similar al cloroformo". Es tóxico y puede ser cancerígeno en humanos. El furano se utiliza como punto de partida para otros productos químicos especiales.
Historia
El nombre "furano" Proviene del latín furfur, que significa salvado (el furfural se produce a partir del salvado). El primer derivado de furano descrito fue el ácido 2-furoico, por Carl Wilhelm Scheele en 1780. Otro derivado importante, el furfural, fue descrito por Johann Wolfgang Döbereiner en 1831 y caracterizado nueve años más tarde por John Stenhouse. El propio furano fue preparado por primera vez por Heinrich Limpricht en 1870, aunque lo llamó "tetrafenol" (como si fuera un análogo de cuatro carbonos del fenol, C6H5OH).
Producción
Industrialmente, el furano se fabrica mediante la descarbonilación de furfural catalizada por paladio o mediante la oxidación de 1,3-butadieno catalizada por cobre:
En el laboratorio, el furano se puede obtener a partir del furfural mediante oxidación a ácido 2-furoico, seguida de descarboxilación. También puede prepararse directamente por descomposición térmica de materiales que contienen pentosas y sólidos celulósicos, especialmente madera de pino.
Síntesis de furanos
La síntesis Feist-Benary es una forma clásica de sintetizar furanos. La reacción implica la alquilación de 1,3-dicetonas con α-bromocetonas seguida de la deshidratación de un hidroxidihidrofurano intermedio. La otra ruta tradicional implica la reacción de 1,4-dicetonas con pentóxido de fósforo (P2O5) en la síntesis de Paal-Knorr.
Existen muchas rutas para la síntesis de furanos sustituidos.
- Furan en naturaleza y comercio
El fármaco Zantac, también conocido como ranitidine.
Rosefuran, un compuesto de aroma encontrado en aceite de rosa.
Furfural, derivado de los azúcares, es la principal fuente de furanos
methanofuran es un cofactor en la metanogénesis.
Estructura y unión
El furano tiene carácter aromático porque uno de los pares solitarios de electrones del átomo de oxígeno se deslocaliza en el anillo, creando un sistema aromático 4n + 2 (consulte la regla de Hückel). La aromaticidad es modesta en relación con la del benceno y los heterociclos relacionados tiofeno y pirrol. Las energías de resonancia del benceno, pirrol, tiofeno y furano son, respectivamente, 152, 88, 121 y 67 kJ/mol (36, 21, 29 y 16 kcal/mol). Por tanto, estos heterociclos, especialmente el furano, son mucho menos aromáticos que el benceno, como se manifiesta en la labilidad de estos anillos. La molécula es plana, pero los grupos C=C unidos al oxígeno conservan un carácter de doble enlace significativo. El otro par solitario de electrones del átomo de oxígeno se extiende en el plano del sistema de anillos planos.
El examen de los contribuyentes de resonancia muestra el aumento de la densidad electrónica del anillo, lo que conduce a mayores tasas de sustitución electrófila.
Reactividad
Debido a su carácter parcialmente aromático, el comportamiento del furano es intermedio entre el de un enol éter y el de un anillo aromático. Es diferente a los éteres como el tetrahidrofurano.
Al igual que los éteres enólicos, los furanos 2,5-disustituidos son susceptibles a la hidrólisis para dar reversiblemente 1,4-dicetonas.
El furano sirve como dieno en las reacciones de Diels-Alder con dienófilos deficientes en electrones como el (E)-3-nitroacrilato de etilo. El producto de la reacción es una mezcla de isómeros con preferencia del endoisómero:
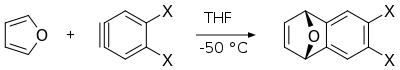
La reacción de Diels-Alder de furano con arinos proporciona los correspondientes derivados de dihidronaftalenos, que son intermediarios útiles en la síntesis de otros compuestos aromáticos policíclicos.
- Es considerablemente más reactiva que la benceno en las reacciones de sustitución electrofílica, debido a los efectos electrondonantes del heteroatomo de oxígeno. Reacciona con bromo a 0 °C para dar 2-bromofuran.
- La hidrogenación de los furanos proporciona secuencialmente dihidrofuranos y tetrahidrofuranos.
- En la reacción de Achmatowicz, los furanos se convierten en compuestos dihidropyran.
- Pyrrole se puede preparar industrialmente tratando furano con amoníaco en presencia de catalizadores de ácido sólido, como SiO2 y Al2O3.
Seguridad
El furano se encuentra en alimentos comerciales tratados térmicamente y se produce mediante la degradación térmica de los componentes naturales de los alimentos. Se puede encontrar en el café tostado, el café instantáneo y los alimentos procesados para bebés. Las investigaciones han indicado que el café elaborado en cafeteras exprés y el café elaborado con cápsulas contienen más furano que el elaborado en cafeteras de goteo tradicionales, aunque los niveles aún se encuentran dentro de límites seguros para la salud.
La exposición al furano en dosis aproximadamente 2000 veces superiores al nivel proyectado de exposición humana a través de los alimentos aumenta el riesgo de tumores hepatocelulares en ratas y ratones y de tumores de las vías biliares en ratas. Por lo tanto, el furano está catalogado como posible carcinógeno humano.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar

![Rosefuran, an aroma compound found in rose oil.[10]](https://upload.wikimedia.org/wikipedia/commons/thumb/b/b6/Rosefuran-2D-skeletal.png/180px-Rosefuran-2D-skeletal.png)