Fullereno
Un fullereno o fulereno es un alótropo de carbono cuya molécula consiste en átomos de carbono conectados por enlaces simples y dobles para formar una malla cerrada o parcialmente cerrada, con anillos fusionados de cinco a siete átomos. La molécula puede ser una esfera hueca, un elipsoide, un tubo o muchas otras formas y tamaños. El grafeno (capas atómicas aisladas de grafito), que es una malla plana de anillos hexagonales regulares, puede verse como un miembro extremo de la familia.
Los fullerenos con una topología de malla cerrada se denotan informalmente por su fórmula empírica C n, a menudo escrita como C n, donde n es el número de átomos de carbono. Sin embargo, para algunos valores de n puede haber más de un isómero.
La familia lleva el nombre de buckminsterfullereno (C 60), el miembro más famoso, que a su vez lleva el nombre de Buckminster Fuller. Los fullerenos cerrados, especialmente C 60, también se denominan informalmente buckyballs por su parecido con el balón estándar de fútbol de asociación ("fútbol"). Los fullerenos cerrados anidados se han denominado cebollas bucky. Los fullerenos cilíndricos también se denominan nanotubos de carbono o buckytubes. La forma sólida a granel de fullerenos puros o mixtos se llama fullerita.
Los fullerenos se habían predicho durante algún tiempo, pero solo después de su síntesis accidental en 1985 se detectaron en la naturaleza y el espacio exterior. El descubrimiento de los fullerenos amplió enormemente el número de alótropos conocidos del carbono, que anteriormente se limitaba al grafito, el diamante y el carbono amorfo, como el hollín y el carbón vegetal. Han sido objeto de una intensa investigación, tanto por su química como por sus aplicaciones tecnológicas, especialmente en ciencia de materiales, electrónica y nanotecnología.
Historia
Predicciones y observaciones limitadas
El icosaédrico C60H60La jaula fue mencionada en 1965 como una posible estructura topológica. Eiji Osawa predijo la existencia de C60en 1970. > Se dio cuenta de que la estructura de una molécula de corannulene era un subconjunto de la forma de una pelota de fútbol, y planteó la hipótesis de que también podría existir una forma de pelota completa. Las revistas científicas japonesas informaron sobre su idea, pero ni esta ni ninguna traducción llegó a Europa o América.
También en 1970, RW Henson (entonces del Establecimiento de Investigación de Energía Atómica del Reino Unido) propuso el C60estructura e hizo un modelo de ella. Desafortunadamente, la evidencia de esa nueva forma de carbono era muy débil en ese momento, por lo que la propuesta fue recibida con escepticismo y nunca se publicó. Fue reconocido recién en 1999.
En 1973, independientemente de Henson, un grupo de científicos de la URSS realizó un análisis químico-cuántico de la estabilidad de C60y calculó su estructura electrónica. El artículo se publicó en 1973, pero la comunidad científica no le dio mucha importancia a esta predicción teórica.
Alrededor de 1980, Sumio Iijima identificó la molécula de C60de una imagen de microscopio electrónico de negro de carbón, donde formó el núcleo de una partícula con la estructura de una "cebolla bucky".
Descubrimiento de C60
En 1985, Harold Kroto de la Universidad de Sussex, en colaboración con James R. Heath, Sean O'Brien, Robert Curl y Richard Smalley de la Universidad de Rice, descubrió fullerenos en los residuos de hollín creados al vaporizar carbono en una atmósfera de helio. En el espectro de masas del producto, aparecieron picos discretos correspondientes a moléculas con la masa exacta de sesenta o setenta o más átomos de carbono, a saber, C60y c70. El equipo identificó su estructura como las ahora familiares "bolas de bucky".
El nombre "buckminsterfullereno" finalmente se eligió para C60por los descubridores como homenaje al arquitecto estadounidense Buckminster Fuller por la vaga similitud de la estructura con las cúpulas geodésicas que popularizó; que, si se extendieran a una esfera completa, también tendrían el grupo de simetría icosaédrica. Se eligió la terminación "ene" para indicar que los carbonos no están saturados, estando conectados solo a otros tres átomos en lugar de los cuatro normales. El nombre abreviado "fullereno" finalmente se aplicó a toda la familia.
Kroto, Curl y Smalley recibieron el Premio Nobel de Química de 1996 por su papel en el descubrimiento de esta clase de moléculas.
Nuevos desarrollos
Kroto y el equipo de Rice ya descubrieron otros fullerenos además de C 60, y la lista se amplió mucho en los años siguientes. Los nanotubos de carbono se descubrieron y sintetizaron por primera vez en 1991.
Después de su descubrimiento, se descubrió que se producían cantidades diminutas de fullerenos en llamas de hollín y por descargas de rayos en la atmósfera. En 1992, se encontraron fullerenos en una familia de mineraloides conocidos como shungitas en Carelia, Rusia.
Muchos científicos mejoraron las técnicas de producción, incluidos Donald Huffman, Wolfgang Krätschmer, Lowell D. Lamb y Konstantinos Fostiropoulos. Gracias a sus esfuerzos, en 1990 era relativamente fácil producir muestras de polvo de fullereno del tamaño de un gramo. La purificación de fullereno sigue siendo un desafío para los químicos y, en gran medida, determina los precios de los fullereno.
En 2010, el telescopio infrarrojo Spitzer de la NASA observó las firmas espectrales de C 60 y C 70 en una nube de polvo cósmico que rodeaba una estrella a 6500 años luz de distancia. Kroto comentó: "Este avance tan emocionante proporciona evidencia convincente de que la buckyball, como sospeché durante mucho tiempo, ha existido desde tiempos inmemoriales en los oscuros rincones de nuestra galaxia". Según la astrónoma Letizia Stanghellini, "es posible que las bolas de Bucky del espacio exterior proporcionaran semillas para la vida en la Tierra". En 2019, se detectaron moléculas de C 60 ionizadas con el telescopio espacial Hubble en el espacio entre esas estrellas.
Tipos
Hay dos familias principales de fullerenos, con propiedades y aplicaciones bastante distintas: las bolas de Bucky cerradas y los nanotubos de carbono cilíndricos abiertos. Sin embargo, existen estructuras híbridas entre esas dos clases, como los nanobrotes de carbono, nanotubos cubiertos por mallas hemisféricas o "brotes de bucky" más grandes.
Buckybolas
Buckminsterfullereno
Buckminsterfullerene es la molécula de fullereno más pequeña que contiene anillos pentagonales y hexagonales en los que dos pentágonos no comparten un borde (lo que puede ser desestabilizador, como en el pentalene). También es más común en términos de ocurrencia natural, ya que a menudo se puede encontrar en el hollín.
La fórmula empírica del buckminsterfullereno es C60y su estructura es un icosaedro truncado, que se asemeja a una pelota de fútbol de asociación del tipo hecho de veinte hexágonos y doce pentágonos, con un átomo de carbono en los vértices de cada polígono y un enlace a lo largo de cada borde de polígono.
El diámetro de van der Waals de una molécula de buckminsterfullereno es de aproximadamente 1,1 nanómetros (nm). El diámetro de núcleo a núcleo de una molécula de buckminsterfullereno es de aproximadamente 0,71 nm.
La molécula de buckminsterfullereno tiene dos longitudes de enlace. Los enlaces de anillo 6:6 (entre dos hexágonos) pueden considerarse "enlaces dobles" y son más cortos que los enlaces 6:5 (entre un hexágono y un pentágono). Su longitud media de enlace es de 1,4 Å.
Otros fullerenos
Otro fullereno bastante común tiene la fórmula empírica C70, pero comúnmente se obtienen fullerenos con 72, 76, 84 e incluso hasta 100 átomos de carbono.
El fullereno más pequeño posible es el dodecaédrico C20. No hay fullerenos con 22 vértices. El número de fullerenos C 2n diferentes crece al aumentar n = 12, 13, 14,..., aproximadamente en proporción a n (secuencia A007894 en la OEIS). Por ejemplo, hay 1812 fullerenos C no isomorfos60. Tenga en cuenta que sólo una forma de C60, buckminsterfullereno, no tiene un par de pentágonos adyacentes (el fullereno más pequeño). Para ilustrar aún más el crecimiento, hay 214,127,713 fullerenos C no isomorfos200, 15.655.672 de los cuales no tienen pentágonos adyacentes. Las estructuras optimizadas de muchos isómeros de fullereno se publican y enumeran en la web.
Los heterofullerenos tienen heteroátomos que sustituyen a los carbonos en estructuras en forma de jaula o tubo. Fueron descubiertos en 1993 y amplían en gran medida la clase general de compuestos de fullereno y pueden tener enlaces colgantes en sus superficies. Los ejemplos notables incluyen derivados de boro, nitrógeno (azafullereno), oxígeno y fósforo.
Nanotubos de carbon
Los nanotubos de carbono son fullerenos cilíndricos. Estos tubos de carbono suelen tener solo unos pocos nanómetros de ancho, pero pueden variar desde menos de un micrómetro hasta varios milímetros de largo. A menudo tienen extremos cerrados, pero también pueden ser abiertos. También hay casos en los que el tubo reduce su diámetro antes de cerrarse. Su estructura molecular única da como resultado propiedades macroscópicas extraordinarias, que incluyen alta resistencia a la tracción, alta conductividad eléctrica, alta ductilidad, alta conductividad térmica e inactividad química relativa (ya que es cilíndrico y "plano", es decir, no tiene átomos "expuestos"). que se pueden desplazar fácilmente). Uno de los usos propuestos de los nanotubos de carbono es en baterías de papel, desarrollado en 2007 por investigadores del Instituto Politécnico Rensselaer.Otro uso propuesto altamente especulativo en el campo de las tecnologías espaciales es producir cables de carbono de alta resistencia requeridos por un ascensor espacial.
Derivados
Buckyballs y nanotubos de carbono se han utilizado como bloques de construcción para una gran variedad de derivados y estructuras más grandes, como
- Bolas de bucky anidadas ("nanocebollas de carbono" o "buckyonions") propuestas para lubricantes;
- Nanotubos de carbono anidados ("megatubos de carbono")
- Dímeros de "bola y cadena" enlazados (dos bolas de bucky unidas por una cadena de carbono)
- Anillos de buckyballs unidos entre sí.
Heterofullerenos y fullerenos no carbonados
Después del descubrimiento de C60, se sintetizaron muchos fullerenos (o se estudiaron teóricamente mediante métodos de modelado molecular) en los que algunos o todos los átomos de carbono se reemplazan por otros elementos. Los nanotubos inorgánicos, en particular, han atraído mucha atención.
Boro
En 2007 se predijo y describió un tipo de bola de Bucky que utiliza átomos de boro, en lugar del carbono habitual. El B80Se predijo que la estructura, con cada átomo formando 5 o 6 enlaces, sería más estable que la C60bola de bucky Sin embargo, el análisis posterior encontró que la estructura simétrica I h predicha era vibratoriamente inestable y la jaula resultante sufriría una ruptura de simetría espontánea, produciendo una jaula fruncida con una rara simetría T h (simetría de una pelota de voleibol). El número de anillos de seis miembros en esta molécula es 20 y el número de anillos de cinco miembros es 12. Hay un átomo adicional en el centro de cada anillo de seis miembros, unido a cada átomo que lo rodea. Mediante el empleo de un algoritmo de búsqueda global sistemático, más tarde se encontró que el propuesto anteriormente80el fullereno no es un máximo global para grupos de boro de 80 átomos y, por lo tanto, no se puede encontrar en la naturaleza; las configuraciones más estables tienen complejos. El mismo artículo concluyó que el panorama energético del boro, a diferencia de otros, tiene muchas estructuras desordenadas de baja energía, por lo que es poco probable que existan fullerenos de boro puro en la naturaleza.
Sin embargo, una B irregular40El complejo denominado borospherene se preparó en 2014. Este complejo tiene dos caras hexagonales y cuatro caras heptagonales con simetría en D 2d intercaladas con una red de 48 triángulos.
Otros elementos
Se han construido estructuras inorgánicas (sin carbono) de tipo fullereno con sulfuro de molibdeno (IV) (MoS 2), utilizado durante mucho tiempo como lubricante similar al grafito, tungsteno (WS 2), titanio (TiS 2) y niobio (NbS 2).). Se encontró que estos materiales eran estables hasta por lo menos 350 toneladas/cm (34,3 GPa).
También se han preparado complejos similares a fullereno icosaédricos o icosaédricos distorsionados para germanio, estaño y plomo; algunos de estos complejos son lo suficientemente espaciosos para contener la mayoría de los átomos de metales de transición.
Fullerenos principales
A continuación se muestra una tabla de los principales fullerenos de carbono cerrados sintetizados y caracterizados hasta el momento, con su número CAS cuando se conoce. Los fullerenos con menos de 60 átomos de carbono se han denominado "fulerenos inferiores" y los que tienen más de 70 átomos "fulerenos superiores".
| Fórmula | No.Isom.[1] | mol.Sim. | cristal.Sim. | grupo espacial | No | símbolo de Pearson | un (nm) | b (nm) | c (nm) | segundo | Z | ρ(g/cm) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| C20 | 1 | Yo h | ||||||||||
| C60 | 1 | Yo h | ||||||||||
| C70 | 1 | D 5h | ||||||||||
| C72 | 1 | D 6h | ||||||||||
| C74 | 1 | D 3h | ||||||||||
| C76 | 2 | D 2 * | monoclínico | P2 1 | 4 | mP2 | 1.102 | 1.108 | 1.768 | 108.10 | 2 | 1.48 |
| Cúbico | FM 3m _ | 225 | cF4 | 1.5475 | 1.5475 | 1.5475 | 90 | 4 | 1.64 | |||
| C78 | 5 | D 2v | ||||||||||
| C80 | 7 | |||||||||||
| C82 | 9 | C2, C 2v, C 3v | monoclínico | P2 1 | 4 | mP2 | 1.141 | 1.1355 | 1.8355 | 108.07 | 2 | |
| C84 | 24 | re 2 *, re 2d | Cúbico | FM 3m _ | 1.5817 | 1.5817 | 1.5817 | 90 | ||||
| C86 | 19 | |||||||||||
| C88 | 35 | |||||||||||
| C90 | 46 | |||||||||||
| C3996 |
En la tabla, "Num.Isom". es el número de posibles isómeros dentro de la "regla del pentágono aislado", que establece que dos pentágonos en un fullereno no deben compartir bordes. "Mol.Symm". es la simetría de la molécula, mientras que "Cryst.Symm." es la del armazón cristalino en estado sólido. Ambos se especifican para la(s) forma(s) experimentalmente más abundante(s). El asterisco * marca simetrías con más de una forma quiral.
cuando c76o c82los cristales crecen a partir de una solución de tolueno y tienen una simetría monoclínica. La estructura cristalina contiene moléculas de tolueno empaquetadas entre las esferas del fullereno. Sin embargo, la evaporación del solvente de C76lo transforma en una forma cúbica centrada en las caras. Tanto las fases monoclínicas como las cúbicas centradas en las caras (fcc) son conocidas por C mejor caracterizadas60y c70fullerenos.
Propiedades
Topología
Los diagramas de Schlegel se utilizan a menudo para aclarar la estructura 3D de los fullerenos de capa cerrada, ya que las proyecciones 2D a menudo no son ideales en este sentido.
En términos matemáticos, la topología combinatoria (es decir, los átomos de carbono y los enlaces entre ellos, ignorando sus posiciones y distancias) de un fullereno de capa cerrada con una superficie media similar a una esfera simple (orientable, género cero) se puede representar como un poliedro convexo; más precisamente, su esqueleto unidimensional, formado por sus vértices y aristas. El diagrama de Schlegel es una proyección de ese esqueleto sobre una de las caras del poliedro, a través de un punto justo fuera de esa cara; para que todos los demás vértices se proyecten dentro de esa cara.
- Diagramas de Schlegel de algunos fullerenos
 C20(dodecaedro)
C20(dodecaedro) C26
C26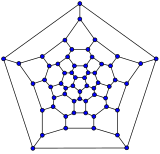 C60(icosaedro truncado)
C60(icosaedro truncado) C70
C70
El diagrama de Schlegel de un fullereno cerrado es un gráfico que es plano y 3-regular (o "cúbico", lo que significa que todos los vértices tienen grado 3).
Un fullereno cerrado con capa esférica debe tener al menos algunos ciclos que sean pentágonos o heptágonos. Más precisamente, si todas las caras tienen 5 o 6 lados, se sigue de la fórmula del poliedro de Euler, V − E + F =2 (donde V, E, F son los números de vértices, aristas y caras), que V debe ser incluso, y que debe haber exactamente 12 pentágonos y V /2−10 hexágonos. Existen limitaciones similares si el fullereno tiene ciclos heptagonales (de siete átomos).
Los fullerenos abiertos, como los nanotubos de carbono y el grafeno, pueden consistir enteramente en anillos hexagonales. En teoría, un nanotubo largo con extremos unidos para formar una hoja cerrada similar a un toro también podría consistir completamente en hexágonos.
Vinculación
Dado que cada átomo de carbono está conectado a solo tres vecinos, en lugar de los cuatro habituales, se acostumbra describir esos enlaces como una mezcla de enlaces covalentes simples y dobles. Se ha informado que la hibridación del carbono en C 60 es sp. El estado de unión se puede analizar mediante espectroscopia Raman, espectroscopia IR y espectroscopia de fotoelectrones de rayos X.
Encapsulación
Los átomos, iones, grupos o moléculas pequeñas adicionales pueden quedar atrapados dentro de los fullerenos para formar compuestos de inclusión conocidos como fullerenos endoédricos. Un ejemplo inusual es el fullereno en forma de huevo Tb 3 N@ C84, lo que viola la regla del pentágono aislado. La evidencia del impacto de un meteorito al final del período Pérmico se encontró analizando los gases nobles conservados al quedar atrapados en fullerenos.
Investigar
A principios de la década de 2000, las propiedades químicas y físicas de los fullerenos eran un tema candente en el campo de la investigación y el desarrollo. Popular Science discutió los posibles usos de los fullerenos (grafeno) en armaduras.
En el campo de la nanotecnología, la resistencia al calor y la superconductividad son algunas de las propiedades más estudiadas.
Son muchos los cálculos que se han realizado utilizando métodos cuánticos ab-initio aplicados a fullerenos. Mediante los métodos DFT y TD-DFT se pueden obtener espectros IR, Raman y UV. Los resultados de tales cálculos se pueden comparar con los resultados experimentales.
El fullereno es un reactivo inusual en muchas reacciones orgánicas, como la reacción de Bingel descubierta en 1993.
Aromaticidad
Los investigadores han podido aumentar la reactividad de los fullerenos uniendo grupos activos a sus superficies. Buckminsterfullerene no exhibe "superaromaticidad": es decir, los electrones en los anillos hexagonales no se deslocalizan en toda la molécula.
Un fullereno esférico de n átomos de carbono tiene n electrones de enlace pi, libres para deslocalizarse. Estos deberían tratar de deslocalizarse sobre toda la molécula. La mecánica cuántica de tal disposición debería ser como una sola capa de la conocida estructura mecánica cuántica de un solo átomo, con una capa llena estable para n = 2, 8, 18, 32, 50, 72, 98, 128, etc. (es decir, el doble de un número cuadrado perfecto), pero esta serie no incluye 60. Esta regla 2(N + 1) (con Nentero) para la aromaticidad esférica es el análogo tridimensional de la regla de Hückel. El catión 10+ cumpliría esta regla y debería ser aromático. Se ha demostrado que este es el caso utilizando modelos químicos cuánticos, que mostraron la existencia de fuertes corrientes de esfera diamagnética en el catión.
Como resultado, C.60en el agua tiende a recoger dos electrones más y convertirse en un anión. el nc _60descrito a continuación puede ser el resultado de C60tratando de formar un enlace metálico suelto.
Reacciones
Polimerización
Bajo alta presión y temperatura, las bolas de Bucky colapsan para formar varios marcos de carbono de una, dos o tres dimensiones. Los polímeros monocatenarios se forman utilizando la ruta de polimerización por adición de radicales de transferencia atómica (ATRAP).
"Fullerita ultradura" es un término acuñado que se usa con frecuencia para describir el material producido por el procesamiento de fullerita a alta presión y alta temperatura (HPHT). Dicho tratamiento convierte la fullerita en una forma nanocristalina de diamante que, según se ha informado, exhibe propiedades mecánicas notables.
Química
Los fullerenos son estables, pero no totalmente inactivos. Los átomos de carbono con hibridación sp, que se encuentran en su mínimo de energía en el grafito plano, deben doblarse para formar la esfera o tubo cerrado, lo que produce tensión angular. La reacción característica de los fullerenos es la adición electrofílica en los enlaces dobles 6,6, lo que reduce la tensión angular al cambiar los carbonos con hibridación sp en los con hibridación sp. El cambio en los orbitales hibridados hace que los ángulos de enlace disminuyan de unos 120° en los orbitales sp a unos 109,5° en los orbitales sp. Esta disminución en los ángulos de enlace permite que los enlaces se doblen menos al cerrar la esfera o el tubo y, por lo tanto, la molécula se vuelve más estable.
Solubilidad
Los fullerenos son solubles en muchos solventes orgánicos, como tolueno, clorobenceno y 1,2,3-tricloropropano. Las solubilidades son generalmente bastante bajas, como 8 g/L para C 60 en disulfuro de carbono. Aún así, los fullerenos son el único alótropo conocido de carbono que se puede disolver en solventes comunes a temperatura ambiente. Entre los mejores solventes está el 1-cloronaftaleno, que disolverá 51 g/L de C 60.
Las soluciones de buckminsterfullereno puro tienen un color púrpura intenso. Soluciones de C70son de color marrón rojizo. Los fullerenos superiores C76a C84tener una variedad de colores.
Cristales de tamaño milimétrico de C60y c70, tanto puro como solvatado, se puede cultivar a partir de una solución de benceno. Cristalización de C60de una solución de benceno por debajo de 30 °C (cuando la solubilidad es máxima) produce un solvato sólido triclínico C60· 4C6H6. Por encima de 30 °C se obtiene fcc C libre de solvatos60.
Mecánica cuántica
En 1999, investigadores de la Universidad de Viena demostraron que la dualidad onda-partícula se aplicaba a moléculas como el fullereno.
Superconductividad
Los fullerenos son normalmente aislantes eléctricos, pero cuando se cristalizan con metales alcalinos, el compuesto resultante puede ser conductor o incluso superconductor.
Quiralidad
Algunos fullerenos (por ejemplo, C76, c78, c80, y C84) son inherentemente quirales porque son D 2 -simétricos y se han resuelto con éxito. Se están realizando esfuerzos de investigación para desarrollar sensores específicos para sus enantiómeros.
Estabilidad
Se han propuesto dos teorías para describir los mecanismos moleculares que producen fullerenos. La antigua teoría de "abajo hacia arriba" propone que se construyen átomo por átomo. El enfoque alternativo "de arriba hacia abajo" afirma que los fullerenos se forman cuando estructuras mucho más grandes se rompen en partes constituyentes.
En 2013, los investigadores descubrieron que los fullerenos asimétricos formados a partir de estructuras más grandes se asientan en fullerenos estables. La sustancia sintetizada fue un metalofullereno particular que constaba de 84 átomos de carbono con dos átomos de carbono adicionales y dos átomos de itrio dentro de la jaula. El proceso produjo aproximadamente 100 microgramos.
Sin embargo, descubrieron que la molécula asimétrica teóricamente podría colapsar para formar casi todos los fullereno y metalofullereno conocidos. Las perturbaciones menores que involucran la ruptura de algunos enlaces moleculares hacen que la jaula se vuelva altamente simétrica y estable. Esta idea respalda la teoría de que los fullerenos se pueden formar a partir del grafeno cuando se cortan los enlaces moleculares apropiados.
Denominación sistemática
De acuerdo con la IUPAC, para nombrar un fullereno, se debe citar el número de átomos miembros de los anillos que componen el fullereno, su grupo puntual de simetría en la notación de Schoenflies y el número total de átomos. Por ejemplo, el buckminsterfullereno C 60 se nombra sistemáticamente (C60- I h)[5,6]fullereno. El nombre del grupo puntual debe conservarse en cualquier derivado de dicho fullereno, incluso si la derivación pierde esa simetría.
Para indicar la posición de los elementos sustituidos o unidos, los átomos de fullereno suelen numerarse en forma de espiral, generalmente comenzando con el anillo en uno de los ejes principales. Si la estructura del fullereno no permite tal numeración, se eligió otro átomo inicial para lograr aún una secuencia de trayectoria en espiral.
Este último es el caso de C 70, que es (C70- D 5h(6))[5,6]fullereno en notación IUPAC. La simetría D 5h(6) significa que este es el isómero donde el eje C 5 pasa por un pentágono rodeado por hexágonos en lugar de pentágonos.
![(C 60-Ih)[5,6]fullereno Numeración de carbonos.](https://upload.wikimedia.org/wikipedia/commons/thumb/c/c8/Buckminsterfullerene-2D-skeletal_numbered.svg/200px-Buckminsterfullerene-2D-skeletal_numbered.svg.png) (C60- I h)[5,6]fullerenoNumeración de carbonos.
(C60- I h)[5,6]fullerenoNumeración de carbonos.![(C 70-D5h(6))[5,6]fullereno Numeración de carbonos.](https://upload.wikimedia.org/wikipedia/commons/thumb/2/2c/C70fullerene-2D-skeletal_numbered.svg/187px-C70fullerene-2D-skeletal_numbered.svg.png) (C70- D 5h(6))[5,6]fullerenoNumeración de carbonos.
(C70- D 5h(6))[5,6]fullerenoNumeración de carbonos.![(C 70-D5h(6))[5,6]fullereno Enlaces no equivalentes mostrados por diferentes colores.](https://upload.wikimedia.org/wikipedia/commons/thumb/9/99/C70fullerene-2D-skeletal_numbered_isobonds.svg/187px-C70fullerene-2D-skeletal_numbered_isobonds.svg.png) (C70- D 5h(6))[5,6]fullereno Enlacesno equivalentes mostrados por diferentes colores.
(C70- D 5h(6))[5,6]fullereno Enlacesno equivalentes mostrados por diferentes colores.)[5,6]fullereno.](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d7/Cyclopropa12_C70fullerene-2D-skeletal_renumbered.svg/198px-Cyclopropa12_C70fullerene-2D-skeletal_renumbered.svg.png) 3' H -ciclopropa[1,2](C70- D 5h(6))[5,6]fullerenos.
3' H -ciclopropa[1,2](C70- D 5h(6))[5,6]fullerenos.)[5,6]fullereno.](https://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/Cyclopropa212_C70fullerene-2D-skeletal_renumbered.svg/198px-Cyclopropa212_C70fullerene-2D-skeletal_renumbered.svg.png) 3' H -ciclopropa[2,12](C70- D 5h(6))[5,6]fullerenos.
3' H -ciclopropa[2,12](C70- D 5h(6))[5,6]fullerenos.![C71-PCBM, [1,2]-isómero. El nombre IUPAC es 4-(3'-fenil-3'H-ciclopropa[1,2](C 70-D5h(6))[5,6]fullereno-3'-il)butirato de metilo.](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/PC71BM.svg/200px-PC71BM.svg.png) C71-PCBM, [1,2]-isómero.El nombre IUPAC es metil 4-(3'-fenil-3'H-ciclopropa[1,2](C70- D 5h(6))[5,6]fullereno-3'-il)butirato.
C71-PCBM, [1,2]-isómero.El nombre IUPAC es metil 4-(3'-fenil-3'H-ciclopropa[1,2](C70- D 5h(6))[5,6]fullereno-3'-il)butirato.
En la nomenclatura de la IUPAC, los análogos completamente saturados de los fullerenos se denominan fulleranos. Si la malla tiene otro(s) elemento(s) sustituido(s) por uno o más carbonos, el compuesto se denomina heterofullereno. Si se reemplaza un doble enlace por un puente de metileno −CH 2 −, la estructura resultante es un homofullereno. Si un átomo está completamente eliminado y las valencias faltantes están saturadas con átomos de hidrógeno, es un norfullereno. Cuando se eliminan los enlaces (tanto sigma como pi), el compuesto se convierte en secofullereno; si se agregan algunos enlaces nuevos en un orden no convencional, es un ciclofullereno.
Producción
La producción de fullereno generalmente comienza con la producción de hollín rico en fullereno. El método original (y aún vigente) consistía en enviar una gran corriente eléctrica entre dos electrodos de grafito cercanos en una atmósfera inerte. El arco eléctrico resultante vaporiza el carbono en un plasma que luego se enfría en un residuo de hollín. Alternativamente, el hollín se produce por ablación con láser de grafito o pirólisis de hidrocarburos aromáticos. La combustión del benceno es el proceso más eficiente, desarrollado en el MIT.
Estos procesos producen una mezcla de varios fullerenos y otras formas de carbono. Luego, los fullerenos se extraen del hollín usando solventes orgánicos apropiados y se separan por cromatografía. Se pueden obtener cantidades de miligramos de fullerenos con 80 átomos o más. C 76, C 78 y C 84 están disponibles comercialmente.
Aplicaciones
Los fullerenos se han utilizado ampliamente para varias aplicaciones biomédicas, incluido el diseño de agentes de contraste de resonancia magnética de alto rendimiento, agentes de contraste de imágenes de rayos X, terapia fotodinámica y administración de fármacos y genes, resumidos en varias revisiones exhaustivas.
Investigación de tumores
Si bien las investigaciones anteriores sobre el cáncer involucraron la radioterapia, es importante estudiar la terapia fotodinámica porque los avances en los tratamientos para las células tumorales brindarán más opciones a los pacientes con diferentes afecciones. Los experimentos recientes que utilizan células HeLa en la investigación del cáncer involucran el desarrollo de nuevos fotosensibilizadores con mayor capacidad para ser absorbidos por las células cancerosas y aún desencadenar la muerte celular. También es importante que un nuevo fotosensibilizador no permanezca en el cuerpo durante mucho tiempo para evitar daños celulares no deseados.
Los fullerenos pueden fabricarse para ser absorbidos por las células HeLa. la c60los derivados pueden administrarse a las células utilizando los grupos funcionales L-fenilalanina, ácido fólico y L-arginina, entre otros.
La funcionalización de los fullerenos tiene como objetivo aumentar la solubilidad de la molécula por parte de las células cancerosas. Las células cancerosas absorben estas moléculas a un ritmo mayor debido a una regulación positiva de los transportadores en la célula cancerosa; en este caso, los transportadores de aminoácidos traerán los grupos funcionales L-arginina y L-fenilalanina de los fullerenos.
Una vez absorbido por las células, el C60los derivados reaccionarían a la radiación de luz convirtiendo el oxígeno molecular en oxígeno reactivo que desencadena la apoptosis en las células HeLa y otras células cancerosas que pueden absorber la molécula de fullereno. Esta investigación muestra que una sustancia reactiva puede atacar las células cancerosas y luego ser activada por la radiación de la luz, lo que minimiza el daño a los tejidos circundantes mientras se somete al tratamiento.
Cuando es absorbida por las células cancerosas y expuesta a la radiación de luz, la reacción que crea oxígeno reactivo daña el ADN, las proteínas y los lípidos que componen la célula cancerosa. Este daño celular obliga a la célula cancerosa a pasar por apoptosis, lo que puede conducir a la reducción del tamaño de un tumor. Una vez que finaliza el tratamiento con radiación de luz, el fullereno reabsorberá los radicales libres para evitar daños en otros tejidos. Dado que este tratamiento se enfoca en las células cancerosas, es una buena opción para los pacientes cuyas células cancerosas están al alcance de la radiación de luz. A medida que continúa esta investigación, el tratamiento puede penetrar más profundamente en el cuerpo y ser absorbido por las células cancerosas con mayor eficacia.
Seguridad y toxicidad
En 2013, se publicó una revisión exhaustiva sobre la toxicidad del fullereno que revisó el trabajo que comenzó a principios de la década de 1990 hasta el presente y concluyó que muy poca evidencia reunida desde el descubrimiento de los fullerenos indica que C60es tóxico La toxicidad de estas nanopartículas de carbono no solo depende de la dosis y el tiempo, sino que también depende de una serie de otros factores, como:
- tipo (por ejemplo: C60, c70, M@ C60, M@ C82)
- grupos funcionales utilizados para solubilizar en agua estas nanopartículas (p. ej.: OH, COOH)
- método de administración (p. ej.: intravenoso, intraperitoneal)
Se recomendó evaluar la farmacología de cada nuevo complejo basado en fullereno o metalofullereno individualmente como un compuesto diferente.
Cultura popular
Los ejemplos de fullerenos aparecen con frecuencia en la cultura popular. Los fullerenos aparecieron en la ficción mucho antes de que los científicos se interesaran seriamente por ellos. En una columna humorísticamente especulativa de 1966 para New Scientist, David Jones sugirió la posibilidad de hacer moléculas gigantes de carbono huecas distorsionando una red hexagonal plana con la adición de átomos de impurezas.
Contenido relacionado
Historia de la criptografía
Molino de agua
Historia del tiro con arco