Fisisorción
Fisisorción, también llamada adsorción física, es un proceso en el que la estructura electrónica del átomo o molécula apenas se perturba tras la adsorción.
Resumen
La fuerza de interacción fundamental de la fisisorción es la fuerza de Van der Waals. Aunque la energía de interacción es muy débil (~10–100 meV), la fisisorción juega un papel importante en la naturaleza. Por ejemplo, la atracción de van der Waals entre las superficies y los pelos de las patas de los geckos (ver Setas sintéticas) proporciona la notable capacidad de escalar paredes verticales. Las fuerzas de Van der Waals se originan de las interacciones entre dipolos eléctricos inducidos, permanentes o transitorios.
En comparación con la quimisorción, en la que se cambia la estructura electrónica de los átomos o moléculas que se unen y se forman enlaces covalentes o iónicos, la fisisorción no produce cambios en la estructura de enlace químico. En la práctica, la categorización de una adsorción particular como fisisorción o quimisorción depende principalmente de la energía de unión del adsorbato al sustrato, siendo la fisisorción mucho más débil por átomo que cualquier tipo de conexión que implique un enlace químico.
Modelado por carga de imagen
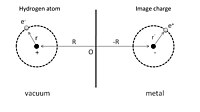
Para dar una ilustración simple de la fisisorción, primero podemos considerar un átomo de hidrógeno adsorbido frente a un conductor perfecto, como se muestra en la Fig. 1. Un núcleo con carga positiva se encuentra en R = (0, 0, Z), y la coordenada de posición de su electrón, r = (x, y, z) se da con respecto al núcleo. El proceso de adsorción puede verse como la interacción entre este átomo de hidrógeno y sus cargas de imagen tanto del núcleo como del electrón en el conductor. Como resultado, la energía electrostática total es la suma de los términos de atracción y repulsión:
- V=e24π π ε ε 0()− − 1Silencio2RSilencio+− − 1Silencio2R+r− − r.Silencio+1Silencio2R− − r.Silencio+1Silencio2R+rSilencio).{displaystyle V={e^{2} over 4pi varepsilon _{0}left({frac {-1}{Privo2mathbf {R} Silencio}}+{frac {-1}{2mathbf {R} +mathbf {r} - Mathbf {r} "Antes" - Mathbf. "Principalmente"
El primer término es la interacción atractiva del núcleo y su imagen de carga, y el segundo término se debe a la interacción del electrón y su imagen de carga. La interacción repulsiva se muestra en los términos tercero y cuarto que surgen de la interacción entre el núcleo y el electrón imagen, y la interacción entre el electrón y el núcleo imagen, respectivamente.
Por expansión de Taylor en potencias de |r| / |R|, esta energía de interacción se puede expresar como:
- V=− − e216π π ε ε 0Z3()x2+Sí.22+z2)+3e232π π ε ε 0Z4()x2+Sí.22z+z3)+O()1Z5).{displaystyle V={-e^{2} over 16pi varepsilon ¿Qué? {x^{2}+y^{2}{2}}+z^{2}right)+{3e^{2} over 32pi varepsilon ¿Qué? {x^{2}+y^{2} {2}{z}+z^{3}right)+Oleft({frac}{2}{2}}{z}+z^{3}right)+Oleft({frac}{2}}{2}}{2}}}{2}}}}{2}}}}}{2}}}}}}}}}{2}}}}}}}}}s}}}}}}}}}}}}}}s}}}}}}}}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s}s} {1}{Z^{5}}} {}}}}} {1} {0}} {0}}}}}}}}}}}}}}}} {0}}} {0}}}} {0} {0} {0}}} {0}} {0}}}}}}}}}}}}}}}}}}} {}}}}}}}} {} {}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}} {} {}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}} {}}}}} {}}}}}}}} {}}}}}}}}}}}} {}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}
Se puede encontrar a partir del primer término que no desaparece que el potencial de fisisorción depende de la distancia Z entre el átomo adsorbido y la superficie como Z−3, en contraste con la dependencia r−6 del potencial molecular de van der Waals, donde r es la distancia entre dos dipolos.
Modelado por oscilador mecánico-cuántico
La energía de enlace de van der Waals se puede analizar mediante otra imagen física simple: modelar el movimiento de un electrón alrededor de su núcleo mediante un oscilador armónico simple tridimensional con una energía potencial Va:
- Va=me2⋅ ⋅ 2()x2+Sí.2+z2),{displaystyle V_{a}={frac {m_{e}{2}{2} {2}}(x^{2}+y^{2}+z^{2}),}
donde me y ω son la masa y la frecuencia vibratoria del electrón, respectivamente.
A medida que este átomo se acerca a la superficie de un metal y forma adsorción, esta energía potencial Va se modificará debido a las cargas de la imagen por términos potenciales adicionales que son cuadráticos en los desplazamientos:
- Va=me2⋅ ⋅ 2()x2+Sí.2+z2)− − e216π π ε ε 0Z3()x2+Sí.22+z2)+...... {displaystyle V_{a}={frac {m_{e}{2}{2} {2}(x^{2}+y^{2}+z^{2})-{e^{2} over 16pi varepsilon ¿Qué? {x^{2}+y^{2}}}+z^{2}right)+ldots } (desde la expansión de Taylor arriba.)
Suponiendo
- me⋅ ⋅ 2≫ ≫ e216π π ε ε 0Z3,{displaystyle m_{e}omega ^{2}gg {e^{2}over 16pi varepsilon _{0}Z^{3}}}}
el potencial está bien aproximado como
- Va♪ ♪ me2⋅ ⋅ 12()x2+Sí.2)+me2⋅ ⋅ 22z2{displaystyle V_{a}sim {frac} {m_{e}{2}{omega ¿Qué? frac {m_{e}{2}{omega ¿Qué?,
dónde
- ⋅ ⋅ 1=⋅ ⋅ − − e232π π ε ε 0me⋅ ⋅ Z3,⋅ ⋅ 2=⋅ ⋅ − − e216π π ε ε 0me⋅ ⋅ Z3.{displaystyle {begin{aligned}omega ################################################################################################################################################################################################################################################################ - {e^{2} over 32pi varepsilon ### {0}m_{e}omega Z^{3}},\omega ################################################################################################################################################################################################################################################################ - {e^{2} over 16pi varepsilon #### {0}m_{e}omega Z^{3}}end{aligned}}
Si se supone que el electrón está en el estado fundamental, entonces la energía de enlace de van der Waals es esencialmente el cambio de la energía de punto cero:
- Vv=▪ ▪ 2()2⋅ ⋅ 1+⋅ ⋅ 2− − 3⋅ ⋅ )=− − ▪ ▪ e216π π ε ε 0me⋅ ⋅ Z3.{displaystyle V_{v}={frac {hbar } {2} {2omega _{1}+omega _{2}-3omega)=-{hbar e^{2} over 16pivarepsilon ### {0}m_{e}omega Z^{3}}
Esta expresión también muestra la naturaleza de la dependencia Z−3 de la interacción de van der Waals.
Además, al introducir la polarizabilidad atómica,
- α α =e2me⋅ ⋅ 2,{displaystyle alpha ={frac {e^{2} {m_{e}omega ^{2}}}} {f} {fnK}} {f}} {f}}}} {f}}}}} {f}}}}}} {f}}}} {f}}} {f}}}}}}} {f}}}}}}}}}}} {m}}}}}}}}}}}}}}} {m}}}}}}}} {m}} {m}}}} {m}} {m}}}}}}}}}}}}}}}}}}}}} {m}}}}} {m}}}}} {m}}}}}}}}}}}}} {m}}}}}}}}} {m}}}}}}}}}}}}} {m}}}}}}}}}}}}}}}}}}}}}}}
El potencial de van der Waals se puede simplificar aún más:
- Vv=− − ▪ ▪ α α ⋅ ⋅ 16π π ε ε 0Z3=− − CvZ3,{displaystyle V_{v}=-{hbar alpha omega over 16pi varepsilon ¿Qué? {C_{v} {Z^{3}}}}
dónde
- Cv=▪ ▪ α α ⋅ ⋅ 16π π ε ε 0,{displaystyle C_{v}={hbar alpha omega over 16pi varepsilon _{0},}
es la constante de van der Waals que está relacionada con la polarizabilidad atómica.
Además, al expresar la corrección de cuarto orden en la expansión de Taylor anterior como (aCvZ0) / (Z4), donde a es una constante, podemos definir Z0 como la posición de la imagen dinámica avión y obtener
| Él | Ne | Ar | Kr | Xe | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cv | Z0 | Cv | Z0 | Cv | Z0 | Cv | Z0 | Cv | Z0 | |
| Cu | 0.225 | 0.22 | 0.452 | 0.21 | 1.501 | 0,266 | 2.11 | 0,277 | 3.085 | 0.29 |
| Ag | 0.249 | 0.2 | 0.502 | 0.19 | 1.623 | 0,244 | 2.263 | 0,25 | 3.277 | 0,277 |
| Au | 0.274 | 0.16 | 0,545 | 0.15 | 1.768 | 0.19 | 2.455 | 0.2 | 3.533 | 0.22 |
- Vv=− − Cv()Z− − Z0)3+O()1Z5).{displaystyle V_{v}=-{frac {fnK} {fnMicroc} {fnMicroc} {fnMicroc} {1}{Z^{5}}} {}}}}} {1} {0}} {0}}}}}}}}}}}}}}}} {0}}} {0}}}} {0} {0} {0}}} {0}} {0}}}}}}}}}}}}}}}}}}} {}}}}}}}} {} {}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}} {} {}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}} {}}}}} {}}}}}}}} {}}}}}}}}}}}} {}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}
El origen de Z0 proviene del derrame de la función de onda del electrón fuera de la superficie. Como resultado, la posición del plano de la imagen que representa la referencia de la coordenada espacial es diferente de la superficie del sustrato en sí y modificada por Z0.
La tabla 1 muestra el cálculo del modelo de gelatina para la constante de van der Waals Cv y el plano de imagen dinámica Z0 de átomos de gases raros en varias superficies metálicas. El aumento de Cv de He a Xe para todos los sustratos metálicos se debe a la mayor polarizabilidad atómica de los átomos de gases raros más pesados. Para la posición del plano de la imagen dinámica, disminuye con el aumento de la función dieléctrica y normalmente es del orden de 0,2 Å.
Potencial de fisisorción
Aunque la interacción de van der Waals es atractiva, a medida que el átomo adsorbido se acerca a la superficie, la función de onda del electrón comienza a superponerse con la de los átomos de la superficie. Además, la energía del sistema aumentará debido a la ortogonalidad de las funciones de onda del átomo que se aproxima y de los átomos de la superficie.
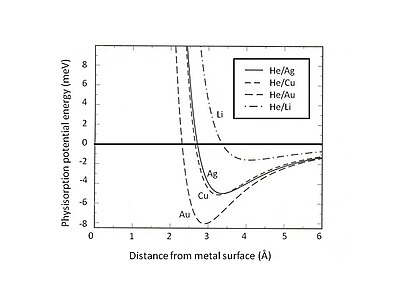
Esta exclusión y repulsión de Pauli son particularmente fuertes para los átomos con capas de valencia cerradas que dominan la interacción superficial. Como resultado, la energía mínima de fisisorción debe encontrarse mediante el equilibrio entre la atracción de van der Waals de largo alcance y la repulsión de Pauli de corto alcance. Por ejemplo, al separar la interacción total de la fisisorción en dos contribuciones, un término de corto alcance representado por la teoría de Hartree-Fock y una atracción de van der Waals de largo alcance, se puede determinar la posición de equilibrio de la fisisorción para los gases raros adsorbidos en el sustrato gelatinoso.. La Fig. 2 muestra la energía potencial de fisisorción del He adsorbido en sustratos de Ag, Cu y Au que se describen mediante el modelo de gelatina con diferentes densidades de cargas positivas de fondo difusas. Se puede encontrar que la interacción débil de van der Waals conduce a pozos de energía atractivos poco profundos (<10 meV). Uno de los métodos experimentales para explorar la energía potencial de fisisorción es el proceso de dispersión, por ejemplo, átomos de gas inerte dispersos en superficies metálicas. Ciertas características específicas del potencial de interacción entre los átomos dispersos y la superficie pueden extraerse analizando la distribución angular determinada experimentalmente y las secciones transversales de las partículas dispersas.
Mecánica Cuántica - Modelado termodinámico de área superficial y porosidad
Desde 1980 se trabajaron dos teorías para explicar la adsorción y obtener ecuaciones que funcionaran. Estos dos se conocen como la hipótesis chi, la derivación de la mecánica cuántica y el exceso de trabajo superficial, ESW. Ambas teorías producen la misma ecuación para superficies planas:
Silencio Silencio =()χ χ − − χ χ c)U()χ χ − − χ χ c){displaystyle theta =(chi -chi _{text{c})U(chi -chi _{c}) }
Donde U es la función escalón unitario. Las definiciones de los otros símbolos son las siguientes:
Silencio Silencio :=nanuncios/nm,χ χ :=− − In ()− − In ()P/Pvap)){displaystyle theta:=n_{ads}/n_{text{m}quadquad chi:=-ln {bigl {bigl {bigl (}P/P_{text{vap}{bigr)}{bigr)}}} {bigr)}
donde "anuncios" significa "adsorbido", "m" significa "equivalencia de monocapa" y "vapor" es una referencia a la presión de vapor ("ads" y "vap" son la última convención de la IUPAC, pero "m" no tiene una notación equivalente a la de la IUAPC) del adsorbente líquido en el misma temperatura que la muestra sólida. La función unitaria crea la definición de la energía molar de adsorción para la primera molécula adsorbida por:
χ χ c=− − In ()− − Ea/RT){displaystyle chi _{text{c}=:-ln {bigl (}-E_{text{a}/RT{bigr)}}
La trama de nads{displaystyle n_{ads} adsorbido versus χ χ {displaystyle chi } se conoce como la parcela chi. Para superficies planas, la pendiente de la parcela chi produce la superficie. Empíricamente, esta trama fue notada como un muy buen ajuste al isomo de Polanyi y también por deBoer y Zwikker pero no perseguido. Esto se debió a la crítica en el primer caso de Einstein y en el último caso de Brunauer. Esta ecuación de superficie plana se puede utilizar como una "curva estándar" en la tradición normal de las curvas de comparación, con la excepción de que la parte temprana de la muestra porosa de la parcela de nads{displaystyle n_{ads} versus χ χ {displaystyle chi } actúa como un auto-estándar. Se pueden analizar condiciones ultramicroporosas, microporosas y mesoporosas utilizando esta técnica. Las desviaciones típicas para el ajuste completo del isotérmago incluyendo muestras porosas son típicamente menos del 2%.
Un ajuste típico a los buenos datos sobre una superficie homogénea no porosa se muestra en la figura 3. Los datos son de Payne, Sing y Turk y se utilizaron para crear α α {displaystyle alpha }- Es curva estándar. A diferencia de la BET, que sólo puede estar en el mejor ajuste sobre el rango de 0.05 a 0.35 de P/Pvap, el rango del ajuste es el isomo completo.
Comparación con quimisorción
- La fitosorción es un fenómeno general y ocurre en cualquier sistema sólido/fluido o sólido/gas. La química se caracteriza por la especificidad química.
- En la fisiopción, la perturbación de los estados electrónicos de adsorbente y adsorbato es mínima. Las fuerzas de adsorción incluyen las Fuerzas de Londres, atracciones dipole-dipole, atracción inducida por dipole y "vinculación de hidrógeno". Para la química, los cambios en los estados electrónicos pueden ser detectables por medios físicos adecuados, es decir, la unión química.
- La energía de unión típica de la fisiopación es de aproximadamente 10–300 meV y no localizada. La química generalmente forma unión con la energía de 1–10 eV y localizada.
- El paso elemental en la fisiopación de una fase de gas no implica una energía de activación. La química a menudo implica una energía de activación.
- Para moléculas de fase de gas fisiopción, adsorbatos, forman adsorción multicapa a menos que las barreras físicas, como la porosidad, interfieran. En la química, las moléculas son adsorbidas en la superficie por bonos valence y sólo forman adsorción monocapa.
- Se ha observado una transición directa de la fisiopación a la química mediante la colocación de una molécula de CO en la punta de un microscopio de fuerza atómica y la medición de su interacción con un solo átomo de hierro. Este efecto se observó a finales de la década de 1960 a partir de las mediciones de emisiones de campo y ESR e informó Moyes y Wells.
Contenido relacionado
Interpretación de muchos mundos
Perclorato de amonio
Aproximación de Born-Oppenheimer