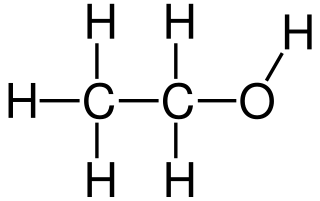
Etanol

El etanol (también llamado alcohol etílico, alcohol de grano, alcohol para beber o simplemente alcohol) es un compuesto químico orgánico. Es un alcohol simple con la fórmula química C 2 H 6 O. Su fórmula también se puede escribir como CH3− CH2− OH o C2H5OH (un grupo etilo unido a un grupo hidroxilo), y a menudo se abrevia como EtOH. El etanol es un líquido volátil, inflamable e incoloro con un olor característico a vino y un sabor acre. Es una droga psicoactiva, una droga recreativa y el ingrediente activo de las bebidas alcohólicas.
El etanol se produce naturalmente por la fermentación de azúcares por levaduras o mediante procesos petroquímicos como la hidratación de etileno. Tiene aplicaciones médicas como antiséptico y desinfectante. Se utiliza como disolvente químico y en la síntesis de compuestos orgánicos. El etanol es una fuente de combustible.
Etimología
Etanol es el nombre sistemático definido por la Unión Internacional de Química Pura y Aplicada (IUPAC) para un compuesto que consta de un grupo alquilo con dos átomos de carbono (prefijo "eth-"), que tiene un enlace simple entre ellos (infijo "-an- ") y un grupo funcional adjunto -OH (sufijo "-ol").
El prefijo "eth-" y el calificativo "etilo" en "alcohol etílico" provienen originalmente del nombre "etilo" asignado en 1834 al grupo C2H5− de Justus Liebig. Acuñó la palabra del nombre alemán Aether del compuesto C2H5−O− C2H5(comúnmente llamado "éter" en inglés, más específicamente llamado "éter dietílico"). Según el Oxford English Dictionary, Ethyl es una contracción del griego antiguo αἰθήρ (aithḗr, "aire superior") y la palabra griega ὕλη (hýlē, "sustancia").
El nombre etanol se acuñó como resultado de una resolución que se adoptó en la Conferencia Internacional sobre Nomenclatura Química que se celebró en abril de 1892 en Ginebra, Suiza.
El término "alcohol" ahora se refiere a una clase más amplia de sustancias en la nomenclatura química, pero en el lenguaje común sigue siendo el nombre de etanol. Es un préstamo medieval del árabe al-kuḥl, un mineral de antimonio en polvo utilizado desde la antigüedad como cosmético, y conservó ese significado en el latín medio. El uso de "alcohol" para etanol (en su totalidad, "alcohol de vino") es moderno y se registró por primera vez en 1753. Antes de finales del siglo XVIII, el término "alcohol" generalmente se refería a cualquier sustancia sublimada.
Usos
Médico
Antiséptico
El etanol se usa en toallitas médicas y, más comúnmente, en geles desinfectantes para manos antibacterianos como antiséptico por sus efectos bactericidas y antifúngicos. El etanol mata los microorganismos al disolver la bicapa lipídica de su membrana y desnaturalizar sus proteínas, y es efectivo contra la mayoría de las bacterias, hongos y virus. Sin embargo, es ineficaz contra las esporas bacterianas, pero eso se puede aliviar usando peróxido de hidrógeno. Una solución de etanol al 70 % es más eficaz que el etanol puro porque el etanol depende de las moléculas de agua para una actividad antimicrobiana óptima. El etanol absoluto puede inactivar los microbios sin destruirlos porque el alcohol no puede penetrar completamente la membrana del microbio.El etanol también se puede usar como desinfectante y antiséptico porque causa deshidratación celular al alterar el equilibrio osmótico a través de la membrana celular, por lo que el agua sale de la célula y conduce a la muerte celular.
Antídoto
El etanol se puede administrar como antídoto para el envenenamiento por etilenglicol y el envenenamiento por metanol.
Disolvente medicinal
El etanol, a menudo en altas concentraciones, se usa para disolver muchos medicamentos insolubles en agua y compuestos relacionados. Las preparaciones líquidas de analgésicos, medicamentos para la tos y el resfriado y enjuagues bucales, por ejemplo, pueden contener hasta un 25 % de etanol y es posible que deban evitarse en personas con reacciones adversas al etanol, como reacciones respiratorias inducidas por el alcohol. El etanol está presente principalmente como conservante antimicrobiano en más de 700 preparaciones líquidas de medicamentos, incluidos paracetamol, suplementos de hierro, ranitidina, furosemida, manitol, fenobarbital, trimetoprima/sulfametoxazol y medicamentos para la tos de venta libre.
Farmacología
En los mamíferos, el etanol se metaboliza principalmente en el hígado y el estómago por las enzimas alcohol deshidrogenasa (ADH). Estas enzimas catalizan la oxidación del etanol en acetaldehído (etanal):CH 3 CH 2 OH + NAD → CH 3 CHO + NADH + H
Cuando está presente en concentraciones significativas, este metabolismo del etanol es asistido adicionalmente por la enzima CYP2E1 del citocromo P450 en humanos, mientras que la catalasa también metaboliza pequeñas cantidades.
El intermedio resultante, el acetaldehído, es un carcinógeno conocido y presenta una toxicidad significativamente mayor en humanos que el etanol mismo. Muchos de los síntomas típicamente asociados con la intoxicación por alcohol, así como muchos de los peligros para la salud típicamente asociados con el consumo prolongado de etanol, pueden atribuirse a la toxicidad del acetaldehído en humanos.
La oxidación posterior de acetaldehído en acetato se realiza mediante enzimas aldehído deshidrogenasa (ALDH). Una mutación en el gen ALDH2 que codifica una forma inactiva o disfuncional de esta enzima afecta aproximadamente al 50 % de las poblaciones del este de Asia, lo que contribuye a la característica reacción de sofoco alcohólico que puede causar enrojecimiento temporal de la piel, así como una serie de problemas relacionados y a menudo desagradables, síntomas de toxicidad por acetaldehído. Esta mutación suele ir acompañada de otra mutación en la enzima alcohol deshidrogenasa ADH1B en aproximadamente el 80 % de los asiáticos orientales, lo que mejora la eficiencia catalítica de convertir el etanol en acetaldehído.
Recreativo
Como depresor del sistema nervioso central, el etanol es una de las drogas psicoactivas más consumidas.
A pesar de las propiedades psicoactivas y cancerígenas del alcohol, está fácilmente disponible y su venta es legal en la mayoría de los países. Sin embargo, existen leyes que regulan la venta, exportación/importación, tributación, fabricación, consumo y tenencia de bebidas alcohólicas. La regulación más común es la prohibición para menores.
Gasolina
Combustible del motor
| Tipo de combustible | MJ/L | MJ/kg | Número deoctano de investigación |
|---|---|---|---|
| Madera seca (20% de humedad) | ~19.5 | ||
| metanol | 17.9 | 19.9 | 108.7 |
| Etanol | 21.2 | 26,8 | 108.6 |
| E85(85% etanol, 15% gasolina) | 25.2 | 33.2 | 105 |
| Gas natural licuado | 25.3 | ~55 | |
| Autogas (GLP)(60% propano + 40% butano) | 26,8 | 50 | |
| Gasolina de aviación(gasolina de alto octanaje, no combustible para aviones) | 33.5 | 46,8 | 100/130 (pobre/rico) |
| Gasohol(90% gasolina + 10% etanol) | 33.7 | 47.1 | 93/94 |
| Gasolina normal/gasolina | 34.8 | 44.4 | mín. 91 |
| gasolina premium/gasolina | máx. 104 | ||
| Diesel | 38.6 | 45.4 | 25 |
| Carbón, extruido | 50 | 23 |
El mayor uso individual del etanol es como combustible para motores y aditivo para combustibles. Brasil, en particular, depende en gran medida del uso de etanol como combustible para motores, debido en parte a su papel como uno de los principales productores de etanol del mundo. La gasolina vendida en Brasil contiene al menos un 25% de etanol anhidro. El etanol hidratado (alrededor del 95 % de etanol y el 5 % de agua) se puede utilizar como combustible en más del 90 % de los automóviles nuevos a gasolina que se venden en el país. El etanol brasileño se produce a partir de la caña de azúcar, que tiene rendimientos relativamente altos (830 % más de combustible que los combustibles fósiles utilizados para producirlo) en comparación con otros cultivos energéticos. Los EE. UU. y muchos otros países utilizan principalmente mezclas de etanol y gasolina E10 (10 % de etanol, a veces conocido como gasohol) y E85 (85 % de etanol).
La ley australiana limita el uso de etanol puro de residuos de caña de azúcar al 10% en automóviles. Los autos más viejos (y los autos antiguos diseñados para usar un combustible de combustión más lenta) deben actualizar o reemplazar las válvulas del motor.
Según un grupo de defensa de la industria, el etanol como combustible reduce las emisiones dañinas del tubo de escape de monóxido de carbono, partículas, óxidos de nitrógeno y otros contaminantes formadores de ozono. El Laboratorio Nacional de Argonne analizó las emisiones de gases de efecto invernadero de muchas combinaciones diferentes de motores y combustibles y descubrió que la mezcla de biodiésel/petrodiésel (B20) mostró una reducción del 8 %, la mezcla de etanol E85 convencional una reducción del 17 % y el etanol celulósico del 64 %, en comparación con el etanol puro. gasolina. El etanol tiene un número de octano de investigación (RON) mucho mayor que la gasolina, lo que significa que es menos propenso a preencenderse, lo que permite un mejor avance de la ignición, lo que significa más torque y eficiencia, además de menores emisiones de carbono.
La combustión de etanol en un motor de combustión interna genera muchos de los productos de la combustión incompleta producidos por la gasolina y cantidades significativamente mayores de formaldehído y especies relacionadas, como el acetaldehído. Esto conduce a una reactividad fotoquímica significativamente mayor y más ozono troposférico. Estos datos se han reunido en la comparación de emisiones de combustible del Informe de combustibles limpios y muestran que el escape de etanol genera 2,14 veces más ozono que el escape de gasolina. Cuando esto se agrega al Índice de Contaminación Localizada (LPI) personalizado del Informe de Combustibles Limpios, la contaminación local de etanol (contaminación que contribuye al smog) tiene una calificación de 1.7, donde la gasolina es 1.0 y los números más altos significan una mayor contaminación.La Junta de Recursos del Aire de California formalizó este problema en 2008 al reconocer los estándares de control de formaldehídos como un grupo de control de emisiones, al igual que los NOx convencionales y los gases orgánicos reactivos (ROG).
La producción mundial de etanol en 2006 fue de 51 gigalitros (1,3 × 10 galones estadounidenses), y el 69% del suministro mundial provino de Brasil y Estados Unidos. Más del 20 % de los automóviles brasileños pueden utilizar 100 % de etanol como combustible, lo que incluye motores de solo etanol y motores de combustible flexible.Los motores de combustible flexible en Brasil pueden funcionar con etanol, gasolina o cualquier mezcla de ambos. En los EE. UU., los vehículos de combustible flexible pueden funcionar con 0% a 85% de etanol (15% de gasolina), ya que las mezclas de etanol más altas aún no están permitidas ni son eficientes. Brasil apoya esta flota de automóviles que queman etanol con una gran infraestructura nacional que produce etanol a partir de caña de azúcar cultivada en el país. La caña de azúcar no solo tiene una mayor concentración de sacarosa que el maíz (alrededor del 30%), sino que también es mucho más fácil de extraer. El bagazo generado por el proceso no se desperdicia, sino que se utiliza en centrales eléctricas para producir electricidad.
En los Estados Unidos, la industria del combustible de etanol se basa principalmente en el maíz. Según la Asociación de Combustibles Renovables, al 30 de octubre de 2007, 131 biorrefinerías de etanol de grano en los Estados Unidos tienen la capacidad de producir 7.000 millones de galones estadounidenses (26.000.000 m3) de etanol al año. Otros 72 proyectos de construcción en curso (en los EE. UU.) pueden agregar 6.400 millones de galones estadounidenses (24.000.000 m) de nueva capacidad en los próximos 18 meses. Con el tiempo, se cree que una parte importante del mercado de gasolina de ≈150 000 millones de galones estadounidenses (570 000 000 m) al año comenzará a ser reemplazada por etanol combustible.
El sorgo dulce es otra fuente potencial de etanol y es adecuado para crecer en condiciones de secano. El Instituto Internacional de Investigación de Cultivos para los Trópicos Semiáridos (ICRISAT) está investigando la posibilidad de cultivar sorgo como fuente de combustible, alimento y alimento para animales en zonas áridas de Asia y África. El sorgo dulce tiene un tercio del requerimiento de agua de la caña de azúcar durante el mismo período de tiempo. También requiere un 22% menos de agua que el maíz (también conocido como maíz). La primera destilería de etanol de sorgo dulce del mundo comenzó su producción comercial en 2007 en Andhra Pradesh, India.
La alta miscibilidad del etanol con el agua lo hace inadecuado para el envío a través de tuberías modernas como los hidrocarburos líquidos. Los mecánicos han visto un aumento de los casos de daños en motores pequeños (en particular, el carburador) y atribuyen el daño a la mayor retención de agua por parte del etanol en el combustible.

Estación de bombeo de etanol en São Paulo, Brasil

Un Ford Taurus impulsado por etanol en la Ciudad de Nueva York

Camión de USPS que corre en E85 en Minnesota
Combustible para cohetes
El etanol se usaba comúnmente como combustible en los primeros vehículos de cohetes bipropulsados (propulsados por líquido), junto con un oxidante como el oxígeno líquido. El cohete balístico alemán A-4 de la Segunda Guerra Mundial, más conocido por su nombre propagandístico V-2, al que se atribuye el inicio de la era espacial, utilizaba etanol como componente principal de B-Stoff. Bajo dicha nomenclatura, el etanol se mezclaba con un 25% de agua para reducir la temperatura de la cámara de combustión. El equipo de diseño del V-2 ayudó a desarrollar cohetes estadounidenses después de la Segunda Guerra Mundial, incluido el cohete Redstone alimentado con etanol que lanzó el primer satélite estadounidense. Los alcoholes cayeron en desuso general a medida que se desarrollaron combustibles para cohetes más densos en energía, aunque el etanol se usa actualmente en aviones de carreras ligeros propulsados por cohetes.
Celdas de combustible
Las pilas de combustible comerciales funcionan con gas natural reformado, hidrógeno o metanol. El etanol es una alternativa atractiva debido a su amplia disponibilidad, bajo costo, alta pureza y baja toxicidad. Existe una amplia gama de conceptos de celdas de combustible que han entrado en pruebas, incluidas celdas de combustible de etanol directo, sistemas de reformado térmico automático y sistemas integrados térmicamente. La mayor parte del trabajo se está realizando a nivel de investigación, aunque hay una serie de organizaciones al comienzo de la comercialización de pilas de combustible de etanol.
Calefacción y cocina doméstica
Las chimeneas de etanol se pueden utilizar para la calefacción del hogar o para la decoración. El etanol también se puede usar como combustible para estufas para cocinar.
Materia prima
El etanol es un ingrediente industrial importante. Tiene un uso generalizado como precursor de otros compuestos orgánicos como haluros de etilo, ésteres de etilo, éter dietílico, ácido acético y aminas de etilo.
Solvente
El etanol se considera un disolvente universal, ya que su estructura molecular permite la disolución de compuestos hidrófobos polares, hidrófilos y no polares. Como el etanol también tiene un punto de ebullición bajo, es fácil de eliminar de una solución que se ha utilizado para disolver otros compuestos, lo que lo convierte en un popular agente de extracción de aceites botánicos. Los métodos de extracción de aceite de cannabis a menudo usan etanol como solvente de extracción y también como solvente de procesamiento posterior para eliminar aceites, ceras y clorofila de la solución en un proceso conocido como preparación para el invierno.
El etanol se encuentra en pinturas, tinturas, marcadores y productos para el cuidado personal como enjuagues bucales, perfumes y desodorantes. Sin embargo, los polisacáridos precipitan de una solución acuosa en presencia de alcohol, y la precipitación con etanol se usa por esta razón en la purificación de ADN y ARN.
Líquido a baja temperatura
Debido a su bajo punto de congelación -173,20 °F (-114,14 °C) y su baja toxicidad, el etanol a veces se usa en laboratorios (con hielo seco u otros refrigerantes) como baño refrigerante para mantener los recipientes a temperaturas por debajo del punto de congelación del agua. Por la misma razón, también se utiliza como fluido activo en termómetros de alcohol.
Química
Fórmula química
El etanol es un alcohol de 2 carbonos. Su fórmula molecular es CH 3 CH 2 OH. Una notación alternativa es CH 3 −CH 2 −OH, que indica que el carbono de un grupo metilo (CH 3 −) está unido al carbono de un grupo metileno (−CH 2 –), que está unido al oxígeno de un grupo hidroxilo (-OH). Es un isómero constitucional del dimetil éter. El etanol a veces se abrevia como EtOH, usando la notación común de química orgánica de representar el grupo etilo (C 2 H 5 -) con Et.
Propiedades físicas
El etanol es un líquido volátil e incoloro que tiene un ligero olor. Arde con una llama azul sin humo que no siempre es visible con luz normal. Las propiedades físicas del etanol se derivan principalmente de la presencia de su grupo hidroxilo y la brevedad de su cadena de carbono. El grupo hidroxilo del etanol puede participar en los enlaces de hidrógeno, haciéndolo más viscoso y menos volátil que los compuestos orgánicos menos polares de peso molecular similar, como el propano.
El etanol es ligeramente más refractivo que el agua, con un índice de refracción de 1,36242 (a λ=589,3 nm y 18,35 °C o 65,03 °F). El punto triple del etanol es de 150 K a una presión de 4,3 × 10 Pa.
Propiedades del disolvente
El etanol es un solvente versátil, miscible con agua y con muchos solventes orgánicos, incluidos ácido acético, acetona, benceno, tetracloruro de carbono, cloroformo, éter dietílico, etilenglicol, glicerol, nitrometano, piridina y tolueno. Su uso principal como disolvente es en la fabricación de tintura de yodo, jarabes para la tos, etc. También es miscible con hidrocarburos alifáticos ligeros, como el pentano y el hexano, y con cloruros alifáticos como el tricloroetano y el tetracloroetileno.
La miscibilidad del etanol con el agua contrasta con la inmiscibilidad de los alcoholes de cadena más larga (cinco o más átomos de carbono), cuya miscibilidad con el agua disminuye drásticamente a medida que aumenta el número de carbonos. La miscibilidad del etanol con los alcanos se limita a los alcanos hasta el undecano: las mezclas con dodecano y alcanos superiores muestran un intervalo de miscibilidad por debajo de cierta temperatura (alrededor de 13 °C para el dodecano). La brecha de miscibilidad tiende a ensancharse con alcanos más altos, y aumenta la temperatura para una miscibilidad completa.
Las mezclas de etanol y agua tienen menos volumen que la suma de sus componentes individuales en las fracciones dadas. La mezcla de volúmenes iguales de etanol y agua da como resultado solo 1,92 volúmenes de mezcla. La mezcla de etanol y agua es exotérmica, con hasta 777 J/mol liberados a 298 K.
Las mezclas de etanol y agua forman un azeótropo con aproximadamente 89 % molar de etanol y 11 % molar de agua o una mezcla de 95,6 % de etanol en masa (o aproximadamente 97 % de alcohol en volumen) a presión normal, que hierve a 351 K (78 °C). C). Esta composición azeotrópica depende en gran medida de la temperatura y la presión y desaparece a temperaturas inferiores a 303 K.
El enlace de hidrógeno hace que el etanol puro sea higroscópico en la medida en que absorbe fácilmente el agua del aire. La naturaleza polar del grupo hidroxilo hace que el etanol disuelva muchos compuestos iónicos, en particular hidróxidos de sodio y potasio, cloruro de magnesio, cloruro de calcio, cloruro de amonio, bromuro de amonio y bromuro de sodio. Los cloruros de sodio y potasio son ligeramente solubles en etanol. Debido a que la molécula de etanol también tiene un extremo no polar, también disolverá sustancias no polares, incluidos la mayoría de los aceites esenciales y numerosos agentes saborizantes, colorantes y medicinales.
La adición de incluso un pequeño porcentaje de etanol al agua reduce drásticamente la tensión superficial del agua. Esta propiedad explica parcialmente el fenómeno de las "lágrimas de vino". Cuando el vino se agita en una copa, el etanol se evapora rápidamente de la fina película de vino en la pared de la copa. A medida que el contenido de etanol del vino disminuye, su tensión superficial aumenta y la película delgada se "perfora" y corre por la copa en canales en lugar de como una lámina lisa.
Inflamabilidad
Una solución de etanol y agua se incendiará si se calienta por encima de una temperatura llamada punto de inflamación y luego se le aplica una fuente de ignición. Para un 20 % de alcohol en masa (alrededor de un 25 % en volumen), esto ocurrirá a unos 25 °C (77 °F). El punto de inflamación del etanol puro es de 13 °C (55 °F), pero puede verse influenciado muy levemente por la composición atmosférica, como la presión y la humedad. Las mezclas de etanol pueden encenderse por debajo de la temperatura ambiente promedio. El etanol se considera un líquido inflamable (material peligroso de clase 3) en concentraciones superiores al 2,35 % en masa (3,0 % en volumen; 6 pruebas).
| Fracción de masa de etanol, % | Temperatura | |
|---|---|---|
| ºC | °F | |
| 1 | 84.5 | 184.1 |
| 2 | 64 | 147 |
| 2.35 | 60 | 140 |
| 3 | 51.5 | 124.7 |
| 5 | 43 | 109 |
| 6 | 39.5 | 103.1 |
| 10 | 31 | 88 |
| 20 | 25 | 77 |
| 30 | 24 | 75 |
| 40 | 21,9 | 71.4 |
| 50 | 20 | 68 |
| 60 | 17.9 | 64.2 |
| 70 | dieciséis | 61 |
| 80 | 15.8 | 60.4 |
| 90 | 14 | 57 |
| 100 | 12.5 | 54.5 |
Los platos que usan alcohol ardiente para efectos culinarios se llaman flambeados.

Ocurrencia natural
El etanol es un subproducto del proceso metabólico de la levadura. Como tal, el etanol estará presente en cualquier hábitat de levadura. El etanol se puede encontrar comúnmente en frutas demasiado maduras. El etanol producido por la levadura simbiótica se puede encontrar en las flores de la palma de Bertam. Aunque algunas especies animales, como la musaraña arborícola de cinco puntas, exhiben comportamientos de búsqueda de etanol, la mayoría no muestra interés o evita las fuentes de alimentos que contienen etanol. El etanol también se produce durante la germinación de muchas plantas como resultado de la anaerobiosis natural. Se ha detectado etanol en el espacio exterior, formando una capa helada alrededor de los granos de polvo en las nubes interestelares. Se encontraron cantidades mínimas (promedio de 196 ppb) de etanol endógeno y acetaldehído en el aliento exhalado de voluntarios sanos.El síndrome de la cervecería automática, también conocido como síndrome de fermentación intestinal, es una condición médica rara en la que se producen cantidades intoxicantes de etanol a través de la fermentación endógena dentro del sistema digestivo.
Producción
El etanol se produce como petroquímico, a través de la hidratación del etileno y, a través de procesos biológicos, mediante la fermentación de azúcares con levadura. Qué proceso es más económico depende de los precios prevalecientes de las materias primas de petróleo y cereales. En la década de 1970, la mayor parte del etanol industrial en los Estados Unidos se fabricaba como petroquímico, pero en la década de 1980, Estados Unidos introdujo subsidios para el etanol a base de maíz y hoy en día casi todo se fabrica a partir de esa fuente. En la India, el etanol se obtiene a partir de la caña de azúcar.
Hidratación de etileno
El etanol para uso como materia prima industrial o solvente (a veces denominado etanol sintético) se fabrica a partir de materias primas petroquímicas, principalmente mediante la hidratación de etileno catalizada por ácido:C2H4+ H2O → CH3CH2OH
El catalizador suele ser ácido fosfórico, adsorbido sobre un soporte poroso como gel de sílice o tierra de diatomeas. Este catalizador fue utilizado por primera vez para la producción de etanol a gran escala por Shell Oil Company en 1947. La reacción se lleva a cabo en presencia de vapor a alta presión a 300 °C (572 °F) con una relación de etileno a vapor de 5:3. mantenido Este proceso fue utilizado a escala industrial por Union Carbide Corporation y otros en los EE. UU., pero ahora solo LyondellBasell lo usa comercialmente.
En un proceso más antiguo, practicado por primera vez a escala industrial en 1930 por Union Carbide, pero ahora casi completamente obsoleto, el etileno se hidrataba indirectamente haciéndolo reaccionar con ácido sulfúrico concentrado para producir sulfato de etilo, que se hidrolizaba para producir etanol y regenerar el ácido sulfúrico.:C2H4+ H2ASI QUE4→ CH3CH2ASI QUE4HCH3CH _2ASI QUE4H + H2O → CH3CH _2OH + H2ASI QUE4
del CO2
El etanol se ha producido en el laboratorio mediante la conversión de dióxido de carbono a través de reacciones biológicas y electroquímicas.CO2 + H _2O → CH3CH2O H + productos secundarios
Fermentación
El etanol en bebidas alcohólicas y combustibles se produce por fermentación. Ciertas especies de levadura (p. ej., Saccharomyces cerevisiae) metabolizan el azúcar y producen etanol y dióxido de carbono. Las siguientes ecuaciones químicas resumen la conversión:C6H12O6→ 2 canales3CH2OH + 2 CO 2C12H22O11+ H2O → 4 canales3CH2OH + 4 CO 2
La fermentación es el proceso de cultivo de levadura en condiciones térmicas favorables para producir alcohol. Este proceso se lleva a cabo entre 35 y 40 °C (95 y 104 °F). La toxicidad del etanol para la levadura limita la concentración de etanol que se puede obtener mediante la elaboración de cerveza; por lo tanto, se obtienen concentraciones más altas por fortificación o destilación. Las cepas de levadura más tolerantes al etanol pueden sobrevivir hasta aproximadamente un 18 % de etanol por volumen.
Para producir etanol a partir de materiales ricos en almidón como los cereales, el almidón debe convertirse primero en azúcares. En la elaboración de cerveza, esto se ha logrado tradicionalmente permitiendo que el grano germine, o malta, que produce la enzima amilasa. Cuando se tritura el grano malteado, la amilasa convierte los almidones restantes en azúcares.
Celulosa
Los azúcares para la fermentación de etanol se pueden obtener de la celulosa. El despliegue de esta tecnología podría convertir una serie de subproductos agrícolas que contienen celulosa, como mazorcas de maíz, paja y aserrín, en recursos de energía renovable. Otros residuos agrícolas, como el bagazo de caña de azúcar y los cultivos energéticos, como el pasto varilla, también pueden ser fuentes de azúcar fermentable.
Pruebas
Las cervecerías y las plantas de biocombustibles emplean dos métodos para medir la concentración de etanol. Los sensores infrarrojos de etanol miden la frecuencia de vibración del etanol disuelto utilizando la banda C−H a 2900 cm. Este método utiliza un sensor de estado sólido relativamente económico que compara la banda C−H con una banda de referencia para calcular el contenido de etanol. El cálculo hace uso de la ley de Beer-Lambert. Alternativamente, midiendo la densidad del material de partida y la densidad del producto, usando un hidrómetro, el cambio en la gravedad específica durante la fermentación indica el contenido de alcohol. Este método económico e indirecto tiene una larga historia en la industria cervecera.
Purificación
Destilación
La hidratación o elaboración de etileno produce una mezcla de etanol y agua. Para la mayoría de los usos industriales y de combustible, el etanol debe purificarse. La destilación fraccionada a presión atmosférica puede concentrar etanol al 95,6 % en peso (89,5 % en moles). Esta mezcla es un azeótropo con un punto de ebullición de 78,1 °C (172,6 °F) y no se puede purificar más por destilación. La adición de un agente de arrastre, como benceno, ciclohexano o heptano, permite que se forme un nuevo azeótropo ternario que comprende etanol, agua y el agente de arrastre. Este azeótropo ternario de punto de ebullición más bajo se elimina preferentemente, dando lugar a etanol sin agua.
Tamices moleculares y desecantes
Además de la destilación, el etanol se puede secar mediante la adición de un desecante, como tamices moleculares, celulosa o harina de maíz. Los desecantes se pueden secar y reutilizar. Se pueden usar tamices moleculares para absorber selectivamente el agua de la solución de etanol al 95,6 %. Los tamices moleculares de un tamaño de poro de 3 Ångstrom, un tipo de zeolita, secuestran eficazmente las moléculas de agua y excluyen las moléculas de etanol. El calentamiento de los tamices húmedos expulsa el agua, lo que permite la regeneración de su capacidad desecante.
Membranas y ósmosis inversa
Las membranas también se pueden usar para separar etanol y agua. Las separaciones basadas en membranas no están sujetas a las limitaciones del azeótropo agua-etanol porque las separaciones no se basan en equilibrios vapor-líquido. Las membranas se utilizan a menudo en el llamado proceso de destilación de membrana híbrida. Este proceso utiliza una columna de destilación de preconcentración como primer paso de separación. La separación adicional se logra luego con una membrana operada en modo de permeación de vapor o pervaporación. La permeación de vapor utiliza una alimentación de membrana de vapor y la pervaporación utiliza una alimentación de membrana líquida.
Otras técnicas
Se ha discutido una variedad de otras técnicas, incluyendo las siguientes:
- La salazón con carbonato de potasio para aprovechar su insolubilidad provocará una separación de fases con etanol y agua. Esto ofrece una impureza de carbonato de potasio muy pequeña al alcohol que puede eliminarse por destilación. Este método es muy útil en la purificación de etanol por destilación, ya que el etanol forma un azeótropo con el agua.
- Reducción electroquímica directa de dióxido de carbono a etanol en condiciones ambientales utilizando nanopartículas de cobre en una película de nanopuntas de carbono como catalizador;
- Extracción de etanol a partir de puré de cereales mediante dióxido de carbono supercrítico;
- pervaporación;
- La congelación fraccionada también se utiliza para concentrar soluciones alcohólicas fermentadas, como el Applejack (bebida) elaborado de manera tradicional;
- Adsorción por oscilación de presión.
Grados de etanol
Alcohol desnaturalizado
El etanol puro y las bebidas alcohólicas están fuertemente gravados como drogas psicoactivas, pero el etanol tiene muchos usos que no implican su consumo. Para aliviar la carga fiscal sobre estos usos, la mayoría de las jurisdicciones exonera el impuesto cuando se ha agregado un agente al etanol para hacerlo no apto para beber. Estos incluyen agentes amargos como el benzoato de denatonio y toxinas como el metanol, la nafta y la piridina. Los productos de este tipo se denominan alcohol desnaturalizado.
Alcohol absoluto
El alcohol absoluto o anhidro se refiere al etanol con un bajo contenido de agua. Hay varios grados con contenidos máximos de agua que van desde el 1% hasta unas pocas partes por millón (ppm). Si se utiliza la destilación azeotrópica para eliminar el agua, esta contendrá trazas del agente de separación de materiales (p. ej., benceno). El alcohol absoluto no está destinado al consumo humano. El etanol absoluto se utiliza como disolvente para aplicaciones industriales y de laboratorio, donde el agua reaccionará con otros productos químicos, y como alcohol combustible. El etanol espectroscópico es un etanol absoluto con baja absorbancia en luz ultravioleta y visible, apto para su uso como disolvente en espectroscopia ultravioleta-visible.
El etanol puro se clasifica como 200 grados en los EE. UU., equivalente a 175 grados en el sistema del Reino Unido.
Espíritus rectificados
El alcohol rectificado, una composición azeotrópica de 96% de etanol que contiene 4% de agua, se usa en lugar de etanol anhidro para diversos fines. Los licores de vino son alrededor del 94% de etanol (prueba 188). Las impurezas son diferentes de las del etanol de laboratorio al 95 % (prueba 190).
Reacciones
El etanol se clasifica como un alcohol primario, lo que significa que el carbono al que se une su grupo hidroxilo también tiene al menos dos átomos de hidrógeno unidos. Muchas reacciones de etanol ocurren en su grupo hidroxilo.
Formación de éster
En presencia de catalizadores ácidos, el etanol reacciona con los ácidos carboxílicos para producir ésteres etílicos y agua:RCOOH + HOCH 2 CH 3 → RCOOCH 2 CH 3 + H 2 O
Esta reacción, que se lleva a cabo industrialmente a gran escala, requiere la eliminación del agua de la mezcla de reacción a medida que se forma. Los ésteres reaccionan en presencia de un ácido o base para devolver el alcohol y una sal. Esta reacción se conoce como saponificación porque se utiliza en la preparación de jabón. El etanol también puede formar ésteres con ácidos inorgánicos. El sulfato de dietilo y el fosfato de trietilo se preparan tratando el etanol con trióxido de azufre y pentóxido de fósforo, respectivamente. El sulfato de dietilo es un agente de etilación útil en la síntesis orgánica. El nitrito de etilo, preparado a partir de la reacción de etanol con nitrito de sodio y ácido sulfúrico, se usaba antiguamente como diurético.
Deshidración
En presencia de catalizadores ácidos, el etanol se convierte en etileno. Normalmente se utilizan ácidos sólidos como la alúmina: CH 3 CH 2 OH → H 2 C=CH 2 + H 2 O
El etileno producido a partir de etanol derivado del azúcar (principalmente en Brasil) compite con el etileno producido a partir de materias primas petroquímicas como la nafta y el etano.
En condiciones alternativas, el éter dietílico da como resultado:2 CH 3 CH 2 OH → CH 3 CH 2 OCH 2 CH 3 + H 2 O
Combustión
La combustión completa del etanol forma dióxido de carbono y agua:C 2 H 5 OH (l) + 3 O 2 (g) → 2 CO 2 (g) + 3 H 2 O (l); −ΔHc = 1371 kJ/mol = 29,8 kJ/g = 327 kcal/mol = 7,1 kcal/gC2H5OH (l) + 3O2 ( g ) → 2CO2 ( g) + 3H2O ( g); −ΔH c = 1236 kJ/mol = 26,8 kJ/g = 295,4 kcal/mol = 6,41 kcal/g
Calor específico = 2,44 kJ/(kg·K)
Química ácido-base
El etanol es una molécula neutra y el pH de una solución de etanol en agua es de casi 7,00. El etanol se puede convertir cuantitativamente en su base conjugada, el ion etóxido (CH 3 CH 2 O), por reacción con un metal alcalino como el sodio:2 CH 3 CH 2 OH + 2 Na → 2 CH 3 CH 2 ONa + H 2
o una base muy fuerte como hidruro de sodio:CH 3 CH 2 OH + NaH → CH 3 CH 2 ONa + H 2
Las acidez del agua y el etanol son casi las mismas, como lo indica su pKa de 15,7 y 16 respectivamente. Por lo tanto, el etóxido de sodio y el hidróxido de sodio existen en un equilibrio que está estrechamente equilibrado:CH 3 CH 2 OH + NaOH ⇌ CH 3 CH 2 ONa + H 2 O
Halogenación
El etanol no se usa industrialmente como precursor de los haluros de etilo, pero las reacciones son ilustrativas. El etanol reacciona con haluros de hidrógeno para producir haluros de etilo como cloruro de etilo y bromuro de etilo a través de una reacción S N 2:CH 3 CH 2 OH + HCl → CH 3 CH 2 Cl + H 2 O
Estas reacciones requieren un catalizador como el cloruro de zinc. HBr requiere reflujo con un catalizador de ácido sulfúrico. En principio, los haluros de etilo también se pueden producir tratando el etanol con agentes halogenantes más especializados, como el cloruro de tionilo o el tribromuro de fósforo.CH 3 CH 2 OH + SOCl 2 → CH 3 CH 2 Cl + SO 2 + HCl
Tras el tratamiento con halógenos en presencia de una base, el etanol da la haloforma correspondiente (CHX 3, donde X = Cl, Br, I). Esta conversión se llama reacción de haloformo. "Un intermedio en la reacción con el cloro es el aldehído llamado cloral, que forma hidrato de cloral al reaccionar con el agua:4 Cl 2 + CH 3 CH 2 OH → CCl 3 CHO + 5 HClCCl 3 CHO + H 2 O → CCl 3 C(OH) 2 H
Oxidación
El etanol puede oxidarse a acetaldehído y luego oxidarse a ácido acético, dependiendo de los reactivos y las condiciones. Esta oxidación no tiene importancia industrial, pero en el cuerpo humano, estas reacciones de oxidación son catalizadas por la enzima alcohol deshidrogenasa del hígado. El producto de oxidación del etanol, el ácido acético, es un nutriente para los humanos, siendo un precursor del acetil CoA, donde el grupo acetilo puede gastarse como energía o utilizarse para la biosíntesis.
Metabolismo
El etanol es similar a los macronutrientes como las proteínas, las grasas y los carbohidratos en que proporciona calorías. Cuando se consume y se metaboliza, aporta 7 calorías por gramo a través del metabolismo del etanol.
La seguridad
El etanol puro irritará la piel y los ojos. Las náuseas, los vómitos y la intoxicación son síntomas de ingestión. El uso a largo plazo por ingestión puede resultar en daño hepático grave. Las concentraciones atmosféricas por encima de uno en mil están por encima de los límites de exposición ocupacional de la Unión Europea.
Historia
La fermentación del azúcar en etanol es una de las primeras biotecnologías empleadas por los humanos. Históricamente, el etanol se ha identificado de diversas formas como aguardiente de vino o aguardiente ardiente, y como aqua vitae o aqua vita. Los efectos embriagantes de su consumo se conocen desde la antigüedad. El etanol ha sido utilizado por los seres humanos desde la prehistoria como ingrediente intoxicante de las bebidas alcohólicas. Los residuos secos en cerámica de 9.000 años de antigüedad encontrados en China sugieren que las personas del Neolítico consumían bebidas alcohólicas.
La naturaleza inflamable de las exhalaciones del vino ya era conocida por filósofos naturales antiguos como Aristóteles (384-322 a. C.), Teofrasto (c. 371-287 a. C.) y Plinio el Viejo (23/24-79 d. C.). Sin embargo, esto no condujo inmediatamente al aislamiento del etanol, incluso a pesar del desarrollo de técnicas de destilación más avanzadas en el Egipto romano de los siglos II y III. Un reconocimiento importante, encontrado por primera vez en uno de los escritos atribuidos a Jābir ibn Ḥayyān (siglo IX d. C.), fue que al agregar sal al vino hirviendo, lo que aumenta la volatilidad relativa del vino, se puede mejorar la inflamabilidad de los vapores resultantes.La destilación del vino está atestiguada en obras árabes atribuidas a al-Kindī (c. 801–873 EC) y a al-Fārābī (c. 872–950), y en el libro 28 de al-Zahrāwī (latín: Abulcasis, 936 –1013) Kitāb al-Taṣrīf (más tarde traducido al latín como Liber servatoris). En el siglo XII, las recetas para la producción de aqua ardens ("agua ardiente", es decir, etanol) mediante la destilación de vino con sal comenzaron a aparecer en una serie de obras latinas, y a fines del siglo XIII se había convertido en un ampliamente popular. sustancia conocida entre los químicos de Europa occidental.
Los trabajos de Taddeo Alderotti (1223-1296) describen un método para concentrar etanol que implica la destilación fraccionada repetida a través de un alambique refrigerado por agua, mediante el cual se puede obtener una pureza de etanol del 90%. Las propiedades medicinales del etanol fueron estudiadas por Arnald de Villanova (1240-1311 CE) y John de Rupescissa (c. 1310-1366), el último de los cuales lo consideró como una sustancia que conserva la vida capaz de prevenir todas las enfermedades (el aqua vitae o "agua de vida", también llamada por Juan la quintaesencia del vino).
En China, la evidencia arqueológica indica que la verdadera destilación del alcohol comenzó durante las dinastías Jin (1115-1234) o Song del Sur (1127-1279). Se ha encontrado un alambique en un sitio arqueológico en Qinglong, Hebei, que data del siglo XII. En India, la verdadera destilación de alcohol se introdujo desde el Medio Oriente y se usó ampliamente en el Sultanato de Delhi en el siglo XIV.
En 1796, el químico germano-ruso Johann Tobias Lowitz obtuvo etanol puro mezclando etanol parcialmente purificado (el azeótropo de alcohol y agua) con un exceso de álcali anhidro y luego destilando la mezcla a fuego lento. El químico francés Antoine Lavoisier describió el etanol como un compuesto de carbono, hidrógeno y oxígeno, y en 1807 Nicolas-Théodore de Saussure determinó la fórmula química del etanol. Cincuenta años después, Archibald Scott Couper publicó la fórmula estructural del etanol. Fue una de las primeras fórmulas estructurales determinadas.
El etanol fue preparado sintéticamente por primera vez en 1825 por Michael Faraday. Descubrió que el ácido sulfúrico podía absorber grandes volúmenes de gas de carbón. Le dio la solución resultante a Henry Hennell, un químico británico, quien descubrió en 1826 que contenía "ácido sulfovínico" (hidrogenosulfato de etilo). En 1828, Hennell y el químico francés Georges-Simon Serullas descubrieron de forma independiente que el ácido sulfovínico podía descomponerse en etanol. Por lo tanto, en 1825, Faraday había descubierto sin darse cuenta que el etanol se podía producir a partir de etileno (un componente del gas de carbón) mediante hidratación catalizada por ácido, un proceso similar a la síntesis de etanol industrial actual.
El etanol se usó como combustible para lámparas en los Estados Unidos ya en 1840, pero un impuesto aplicado al alcohol industrial durante la Guerra Civil hizo que este uso no fuera económico. El impuesto fue derogado en 1906. El uso como combustible para automóviles se remonta a 1908, con el Ford Model T capaz de funcionar con gasolina (gasolina) o etanol. Alimenta algunas lámparas de espíritu.
El etanol destinado a uso industrial a menudo se produce a partir de etileno. El etanol tiene un uso generalizado como solvente de sustancias destinadas al contacto o consumo humano, incluidos aromas, saborizantes, colorantes y medicamentos. En química, es tanto un solvente como una materia prima para la síntesis de otros productos. Tiene una larga historia como combustible para calor y luz, y más recientemente como combustible para motores de combustión interna.
Contenido relacionado
Windows Me
Pérdida de trayectoria en el espacio libre
Fundición (metalurgia)