Éster
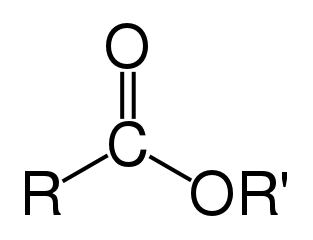
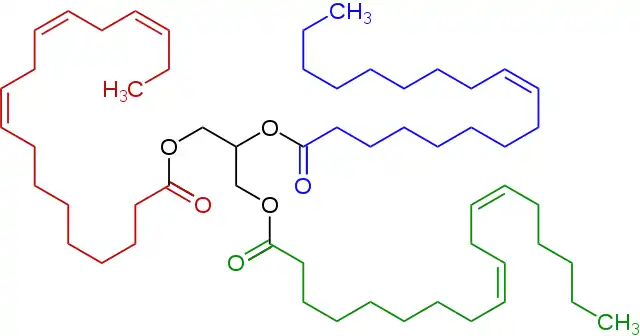
Un éster es un compuesto químico derivado de un ácido (orgánico o inorgánico) en el que al menos un grupo hidroxilo –OH se reemplaza por un grupo alquilo (alcoxi) –O–, como en la reacción de sustitución de un ácido carboxílico y un alcohol. Los glicéridos son ésteres de ácidos grasos de glicerol; son importantes en biología, siendo una de las principales clases de lípidos y constituyendo la mayor parte de las grasas animales y los aceites vegetales.
Los ésteres suelen tener un olor agradable; los de bajo peso molecular se usan comúnmente como fragancias y se encuentran en aceites esenciales y feromonas. Funcionan como solventes de alto grado para una amplia gama de plásticos, plastificantes, resinas y lacas, y son una de las clases más grandes de lubricantes sintéticos en el mercado comercial. Los poliésteres son plásticos importantes, con monómeros unidos por fracciones de éster. Los fosfoésteres forman la columna vertebral de las moléculas de ADN. Los ésteres de nitrato, como la nitroglicerina, son conocidos por sus propiedades explosivas.
Nomenclatura
Etimología
La palabra éster fue acuñada en 1848 por un químico alemán Leopold Gmelin, probablemente como una contracción del alemán Essigäther, "éter acético".
Nomenclatura IUPAC
Los nombres de los ésteres se derivan del alcohol original y del ácido original, donde el último puede ser orgánico o inorgánico. Los ésteres derivados de los ácidos carboxílicos más simples se nombran comúnmente de acuerdo con los llamados "nombres triviales" más tradicionales, por ejemplo, como formiato, acetato, propionato y butirato, a diferencia de la nomenclatura IUPAC de metanoato, etanoato, propanoato y butanoato. Los ésteres derivados de ácidos carboxílicos más complejos, por otro lado, se nombran más frecuentemente usando el nombre sistemático IUPAC, basado en el nombre del ácido seguido del sufijo -oato. Por ejemplo, el éster octanoato de hexilo, también conocido con el nombre trivial de caprilato de hexilo, tiene la fórmula CH 3 (CH 2) 6 CO 2 (CH2) 5 canales 3.
Las fórmulas químicas de los ésteres orgánicos suelen tomar la forma RCO 2 R′, donde R y R′ son las partes hidrocarbonadas del ácido carboxílico y el alcohol, respectivamente. Por ejemplo, el acetato de butilo (sistemáticamente etanoato de butilo), derivado de butanol y ácido acético (sistemáticamente ácido etanoico) se escribiría CH 3 CO 2 C 4 H 9. Las presentaciones alternativas son comunes, incluyendo BuOAc y CH 3 COOC 4 H 9.
Los ésteres cíclicos se denominan lactonas, independientemente de que se deriven de un ácido orgánico o inorgánico. Un ejemplo de una lactona orgánica es γ-valerolactona.
Ortoésteres
Una clase poco común de ésteres orgánicos son los ortoésteres, que tienen la fórmula RC(OR′) 3. El ortoformiato de trietilo (HC(OC 2 H 5) 3) se deriva, en términos de su nombre (pero no de su síntesis) del ácido ortofórmico (HC(OH) 3) y etanol.
ésteres inorgánicos
Los ésteres también se pueden derivar de ácidos inorgánicos.
- El ácido fosfórico forma ésteres de fosfato, por ejemplo, trifenilfosfato
- el ácido sulfúrico forma ésteres de sulfato, por ejemplo, dimetilsulfato
- el ácido nítrico forma ésteres de nitrato, por ejemplo, nitrato de metilo
- el ácido bórico forma boratos, por ejemplo, trimetilborato.
- el ácido carbónico forma ésteres de carbonato, por ejemplo, carbonato de etileno
Los ácidos inorgánicos que existen como tautómeros forman diversos ésteres.
- el ácido fosforoso forma dos tipos de ésteres de fosfito, por ejemplo, trietilfosfito (P(OEt) 3) y dietilfosfito (HP(O)(OEt) 2).
Los ácidos inorgánicos que son inestables o esquivos forman ésteres estables.
- el ácido crómico, que nunca se ha detectado, forma cromato de di-terc-butilo
- el ácido sulfuroso, que es raro, forma dimetilsulfito
En principio, todos los alcóxidos de metales y metaloides, de los cuales se conocen muchos cientos, podrían clasificarse como ésteres de los ácidos hipotéticos.
Estructura y unión
Los ésteres contienen un centro de carbonilo, lo que da lugar a ángulos de 120° C–C–O y O–C–O. A diferencia de las amidas, los ésteres son grupos funcionales estructuralmente flexibles porque la rotación alrededor de los enlaces C-O-C tiene una barrera baja. Su flexibilidad y baja polaridad se manifiesta en sus propiedades físicas; tienden a ser menos rígidos (punto de fusión más bajo) y más volátiles (punto de ebullición más bajo) que las amidas correspondientes. El p K a de los alfa-hidrógenos en los ésteres es de alrededor de 25.
Muchos ésteres tienen el potencial de isomería conformacional, pero tienden a adoptar una conformación s -cis (o Z) en lugar de la alternativa s -trans (o E), debido a una combinación de hiperconjugación y efectos de minimización de dipolos. La preferencia por la conformación Z está influenciada por la naturaleza de los sustituyentes y el solvente, si está presente. Las lactonas con anillos pequeños están restringidas a la conformación s -trans (es decir, E) debido a su estructura cíclica.

Propiedades físicas y caracterización
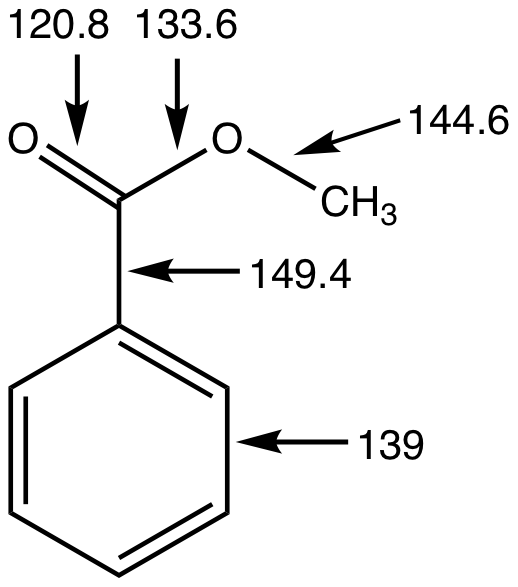
Los ésteres son más polares que los éteres pero menos polares que los alcoholes. Participan en los enlaces de hidrógeno como aceptores de enlaces de hidrógeno, pero no pueden actuar como donantes de enlaces de hidrógeno, a diferencia de sus alcoholes originales. Esta capacidad de participar en los enlaces de hidrógeno confiere cierta solubilidad en agua. Debido a su falta de capacidad para donar enlaces de hidrógeno, los ésteres no se autoasocian. En consecuencia, los ésteres son más volátiles que los ácidos carboxílicos de peso molecular similar.
Caracterización y análisis
Los ésteres se identifican generalmente por cromatografía de gases, aprovechando su volatilidad. Los espectros IR para los ésteres presentan una intensa banda nítida en el rango de 1730–1750 cm asignado a ν C=O. Este pico cambia según los grupos funcionales unidos al carbonilo. Por ejemplo, un anillo de benceno o un doble enlace en conjugación con el carbonilo reducirán el número de onda unos 30 cm.
Aplicaciones y ocurrencia
Los ésteres están muy extendidos en la naturaleza y se utilizan ampliamente en la industria. En la naturaleza, las grasas son en general triésteres derivados del glicerol y de los ácidos grasos. Los ésteres son responsables del aroma de muchas frutas, como manzanas, durianes, peras, plátanos, piñas y fresas. Cada año se producen industrialmente varios miles de millones de kilogramos de poliésteres, siendo productos importantes el tereftalato de polietileno, los ésteres de acrilato y el acetato de celulosa.
Preparación
Esterificación es el nombre general de una reacción química en la que dos reactivos (típicamente un alcohol y un ácido) forman un éster como producto de reacción. Los ésteres son comunes en la química orgánica y los materiales biológicos y, a menudo, tienen un olor afrutado característico agradable. Esto conduce a su uso extensivo en la industria de fragancias y sabores. Los enlaces éster también se encuentran en muchos polímeros.
Esterificación de ácidos carboxílicos con alcoholes
La síntesis clásica es la esterificación de Fischer, que consiste en tratar un ácido carboxílico con un alcohol en presencia de un agente deshidratante:RCO2H + R′OH ⇌ RCO2R ′ + H2O
La constante de equilibrio para tales reacciones es de alrededor de 5 para ésteres típicos, por ejemplo, acetato de etilo. La reacción es lenta en ausencia de un catalizador. El ácido sulfúrico es un catalizador típico para esta reacción. También se utilizan muchos otros ácidos, como los ácidos sulfónicos poliméricos. Dado que la esterificación es altamente reversible, el rendimiento del éster se puede mejorar utilizando el principio de Le Chatelier:
- Usar el alcohol en gran exceso (es decir, como solvente).
- Uso de un agente deshidratante: el ácido sulfúrico no solo cataliza la reacción sino que secuestra agua (un producto de la reacción). Otros agentes secantes, como los tamices moleculares, también son efectivos.
- Eliminación de agua por medios físicos como la destilación como azeótropos de bajo punto de ebullición con tolueno, junto con un aparato Dean-Stark.
Se conocen reactivos que impulsan la deshidratación de mezclas de alcoholes y ácidos carboxílicos. Un ejemplo es la esterificación de Steglich, que es un método para formar ésteres en condiciones suaves. El método es popular en la síntesis de péptidos, donde los sustratos son sensibles a condiciones adversas como altas temperaturas. Se utiliza DCC (diciclohexilcarbodiimida) para activar el ácido carboxílico para que siga reaccionando. La 4-dimetilaminopiridina (DMAP) se utiliza como catalizador de transferencia de acilo.
Otro método para la deshidratación de mezclas de alcoholes y ácidos carboxílicos es la reacción de Mitsunobu:RCO 2 H + R′OH + P(C 6 H 5) 3 + R 2 N 2 → RCO 2 R′ + OP(C 6 H 5) 3 + R 2 N 2 H 2
Los ácidos carboxílicos se pueden esterificar usando diazometano:RCO 2 H + CH 2 N 2 → RCO 2 CH 3 + N 2
Usando este diazometano, las mezclas de ácidos carboxílicos se pueden convertir en sus ésteres metílicos con rendimientos casi cuantitativos, por ejemplo, para análisis por cromatografía de gases. El método es útil en operaciones sintéticas orgánicas especializadas, pero se considera demasiado peligroso y costoso para aplicaciones a gran escala.
Esterificación de ácidos carboxílicos con epóxidos
Los ácidos carboxílicos se esterifican por tratamiento con epóxidos, dando β-hidroxiésteres:RCO2H + RCHCH2O → RCO2CH2CH (OH) R
Esta reacción se emplea en la producción de resinas de éster vinílico a partir de ácido acrílico.
Alcohólisis de cloruros de acilo y anhídridos de ácido
Los alcoholes reaccionan con cloruros de acilo y anhídridos de ácido para dar ésteres:RCOCl + R′OH → RCO 2 R′ + HCl(RCO) 2 O + R′OH → RCO 2 R′ + RCO 2 H
Las reacciones son irreversibles, lo que simplifica el tratamiento. Dado que los cloruros de acilo y los anhídridos de ácido también reaccionan con el agua, se prefieren las condiciones anhidras. Las acilaciones análogas de aminas para dar amidas son menos sensibles porque las aminas son nucleófilos más fuertes y reaccionan más rápidamente que el agua. Este método se emplea solo para procedimientos a escala de laboratorio, ya que es costoso.
Alquilación de sales de carboxilato
Aunque no se emplean ampliamente para esterificaciones, las sales de aniones carboxilato pueden ser agentes alquilantes con haluros de alquilo para dar ésteres. En el caso de que se utilice un cloruro de alquilo, una sal de yoduro puede catalizar la reacción (reacción de Finkelstein). La sal de carboxilato a menudo se genera in situ. En casos difíciles se puede utilizar el carboxilato de plata, ya que el ion plata se coordina con el haluro facilitando su salida y mejorando la velocidad de reacción. Esta reacción puede sufrir problemas de disponibilidad de aniones y, por lo tanto, puede beneficiarse de la adición de catalizadores de transferencia de fase o disolventes apróticos altamente polares como DMF.
Transesterificación
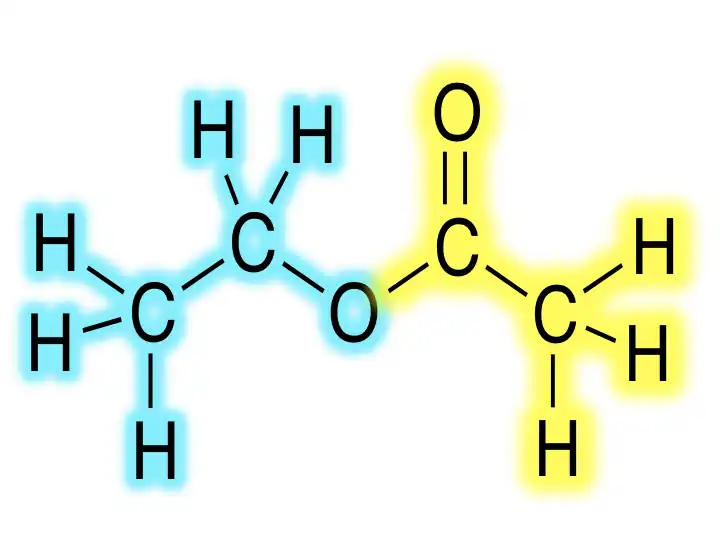
La transesterificación, que consiste en cambiar un éster por otro, se practica ampliamente:RCO2R ′ + CH3OH → RCO2CH3 + R′OH _
Al igual que la hidrolización, la transesterificación es catalizada por ácidos y bases. La reacción se usa ampliamente para degradar triglicéridos, por ejemplo, en la producción de ésteres de ácidos grasos y alcoholes. El poli(tereftalato de etileno) se produce mediante la transesterificación de tereftalato de dimetilo y etilenglicol:(C 6 H 4)(CO 2 CH 3) 2 + 2 C 2 H 4 (OH) 2 → 1 ⁄ norte {(C 6 H 4)(CO 2) 2 (C 2 H 4)} norte + 2 CH 3 OH
Un subconjunto de transesterificación es la alcoholisis de diceteno. Esta reacción produce 2-cetoésteres.(CH2CO ) 2 + ROH → CH3C ( O) CH2CO2R
Carbonilación
Los alquenos se someten a "hidroesterificación" en presencia de catalizadores de carbonilo metálico. Los ésteres de ácido propanoico se producen comercialmente mediante este método:C 2 H 4 + ROH + CO → C 2 H 5 CO 2 R
Una preparación de propionato de metilo es un ejemplo ilustrativo.C 2 H 4 + CO + MeOH → MeO 2 CCH 2 CH 3
La carbonilación del metanol produce formiato de metilo, que es la principal fuente comercial de ácido fórmico. La reacción es catalizada por metóxido de sodio:CH 3 OH + CO → CH 3 O 2 CH
Adición de ácidos carboxílicos a alquenos y alquinos
En presencia de catalizadores a base de paladio, el etileno, el ácido acético y el oxígeno reaccionan para dar acetato de vinilo:C 2 H 4 + CH 3 CO 2 H + 1 ⁄ 2 O 2 → C 2 H 3 O 2 CCH 3 + H 2 O
Las rutas directas a este mismo éster no son posibles porque el alcohol vinílico es inestable.
Los ácidos carboxílicos también se suman a los alquinos para dar los mismos productos.
El ácido silicotúngstico se utiliza para fabricar acetato de etilo mediante la alquilación del ácido acético con etileno:C 2 H 4 + CH 3 CO 2 H → CH 3 CO 2 C 2 H 5
De aldehídos
La reacción de Tishchenko implica la desproporción de un aldehído en presencia de una base anhidra para dar un éster. Los catalizadores son alcóxidos de aluminio o alcóxidos de sodio. El benzaldehído reacciona con el bencilóxido de sodio (generado a partir de sodio y alcohol bencílico) para generar benzoato de bencilo. El método se utiliza en la producción de acetato de etilo a partir de acetaldehído.
Otros metodos
- Reordenamiento de Favorskii de α-halocetonas en presencia de base
- Oxidación de cetonas con peróxidos de Baeyer-Villiger
- Reacción de Pinner de nitrilos con un alcohol.
- Abstracción nucleófila de un complejo metal-acilo
- Hidrólisis de ortoésteres en ácido acuoso
- Celulólisis por esterificación
- Ozonólisis de alquenos mediante elaboración en presencia de ácido clorhídrico y diversos alcoholes.
- Oxidación anódica de metilcetonas que conducen a ésteres metílicos.
- La interesterificación intercambia los grupos de ácidos grasos de diferentes ésteres.
Reacciones
Los ésteres reaccionan con los nucleófilos en el carbono del carbonilo. El carbonilo es débilmente electrofílico pero es atacado por nucleófilos fuertes (aminas, alcóxidos, fuentes de hidruros, compuestos de organolitio, etc.). Los enlaces C-H adyacentes al carbonilo son débilmente ácidos pero sufren desprotonación con bases fuertes. Este proceso es el que suele iniciar las reacciones de condensación. El oxígeno del carbonilo en los ésteres es débilmente básico, menos que el oxígeno del carbonilo en las amidas debido a la donación por resonancia de un par de electrones del nitrógeno en las amidas, pero forma aductos.
Hidrólisis y saponificación
La esterificación es una reacción reversible. Los ésteres se hidrolizan en condiciones ácidas y básicas. En condiciones ácidas, la reacción es la reacción inversa de la esterificación de Fischer. En condiciones básicas, el hidróxido actúa como nucleófilo, mientras que un alcóxido es el grupo saliente. Esta reacción, la saponificación, es la base de la elaboración del jabón.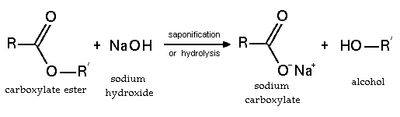
El grupo alcóxido también puede ser desplazado por nucleófilos más fuertes como el amoníaco o aminas primarias o secundarias para dar amidas: (reacción de amonólisis)RCO 2 R′ + NH 2 R″ → RCONHR″ + R′OH
Esta reacción no suele ser reversible. Se pueden usar hidrazinas e hidroxilamina en lugar de aminas. Los ésteres se pueden convertir en isocianatos a través de ácidos hidroxámicos intermedios en el reordenamiento de Lossen.
Las fuentes de nucleófilos de carbono, por ejemplo, los reactivos de Grignard y los compuestos de organolitio, se añaden fácilmente al carbonilo.
Reducción
En comparación con las cetonas y los aldehídos, los ésteres son relativamente resistentes a la reducción. La introducción de la hidrogenación catalítica a principios del siglo XX fue un gran avance; los ésteres de ácidos grasos se hidrogenan a alcoholes grasos.RCO 2 R′ + 2 H 2 → RCH 2 OH + R′OH
Un catalizador típico es el cromito de cobre. Antes del desarrollo de la hidrogenación catalítica, los ésteres se reducían a gran escala mediante la reducción de Bouveault-Blanc. Este método, en gran parte obsoleto, utiliza sodio en presencia de fuentes de protones.
Especialmente para las síntesis químicas finas, el hidruro de litio y aluminio se utiliza para reducir los ésteres a dos alcoholes primarios. El reactivo relacionado borohidruro de sodio es lento en esta reacción. DIBAH reduce los ésteres a aldehídos.
La reducción directa para dar el éter correspondiente es difícil ya que el hemiacetal intermedio tiende a descomponerse para dar un alcohol y un aldehído (que se reduce rápidamente para dar un segundo alcohol). La reacción se puede lograr usando trietilsilano con una variedad de ácidos de Lewis.
Condensación de Claisen y reacciones relacionadas
En cuanto a los aldehídos, los átomos de hidrógeno en el carbono adyacente ("α to") al grupo carboxilo en los ésteres son lo suficientemente ácidos para sufrir desprotonación, lo que a su vez conduce a una variedad de reacciones útiles. La desprotonación requiere bases relativamente fuertes, como los alcóxidos. La desprotonación da un enolato nucleófilo, que puede reaccionar más, por ejemplo, la condensación de Claisen y su equivalente intramolecular, la condensación de Dieckmann. Esta conversión se aprovecha en la síntesis del éster malónico, en la que el diéster del ácido malónico reacciona con un electrófilo (por ejemplo, un haluro de alquilo) y se descarboxila posteriormente. Otra variación es la alquilación de Fráter-Seebach.
Otras reacciones
- Los ésteres de fenilo reaccionan a las hidroxiarilcetonas en el reordenamiento de Fries.
- Los ésteres específicos se funcionalizan con un grupo α-hidroxilo en el reordenamiento de Chan.
- Los ésteres con átomos de hidrógeno β se pueden convertir en alquenos en la pirólisis de ésteres.
- Una conversión directa de ésteres a nitrilos.
Grupos protectores
Como clase, los ésteres sirven como grupos protectores para los ácidos carboxílicos. La protección de un ácido carboxílico es útil en la síntesis de péptidos, para evitar las autorreacciones de los aminoácidos bifuncionales. Los ésteres metílicos y etílicos están comúnmente disponibles para muchos aminoácidos; el éster t -butílico tiende a ser más caro. Sin embargo, los ésteres de t -butilo son particularmente útiles porque, en condiciones fuertemente ácidas, los ésteres de t -butilo se eliminan para dar el ácido carboxílico y el isobutileno, lo que simplifica el procesamiento.
Lista de odorantes de éster
Muchos ésteres tienen olores característicos a frutas y muchos se encuentran naturalmente en los aceites esenciales de las plantas. Esto también ha llevado a su uso común en aromatizantes y fragancias artificiales cuyo objetivo es imitar esos olores.
| Nombre de éster | Estructura | Olor o ocurrencia |
|---|---|---|
| Hexanoato de alilo | piña | |
| Acetato de bencilo | pera, fresa, jazmín | |
| Acetato de bornilo |  | pino |
| acetato de butilo | manzana, miel | |
| butirato de butilo | piña | |
| propanoato de butilo | gotas de pera | |
| Acetato de etilo | quitaesmalte, pintura para maquetas, pegamento para maquetas de aviones, peras | |
| benzoato de etilo | dulce, gaulteria, afrutado, medicinal, cereza, uva | |
| butirato de etilo | plátano, piña, fresa | |
| Hexanoato de etilo | piña, plátano verde ceroso | |
| cinamato de etilo | canela | |
| formiato de etilo | limón, ron, fresa | |
| heptanoato de etilo | albaricoque, cereza, uva, frambuesa | |
| isovalerato de etilo | manzana | |
| lactato de etilo |  | mantequilla, crema |
| nonanoato de etilo | uva | |
| Pentanoato de etilo | manzana | |
| Acetato de geranilo | geranio | |
| butirato de geranilo | cereza | |
| pentanoato de geranilo | manzana | |
| Acetato de isobutilo |  | cereza, frambuesa, fresa |
| formiato de isobutilo | frambuesa | |
| Acetato de isoamilo | pera, plátano (aroma en gotas de pera) | |
| Acetato de isopropilo | sabroso | |
| Acetato de linalilo | lavanda, salvia | |
| butirato de linalilo | durazno | |
| formiato de linalilo | manzana, durazno | |
| Acetato de metilo |  | pegamento |
| antranilato de metilo |  | uva, jazmín |
| benzoato de metilo |  | afrutado, ylang ylang, feijoa |
| Butirato de metilo (butanoato de metilo) | piña, manzana, fresa | |
| cinamato de metilo | fresa | |
| Pentanoato de metilo (valerato de metilo) | florido | |
| fenilacetato de metilo | miel | |
| Salicilato de metilo (aceite de gaulteria) | 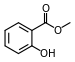 | Ungüentos modernos de cerveza de raíz, gaulteria, Germolene y Ralgex (Reino Unido) |
| caprilato de nonilo | naranja | |
| acetato de octilo | afrutado-naranja | |
| butirato de octilo | chirivía | |
| Acetato de amilo (acetato de pentilo) | manzana platano | |
| butirato de pentilo (butirato de amilo) | albaricoque, pera, piña | |
| Hexanoato de pentilo (caproato de amilo) | manzana, piña | |
| Pentanoato de pentilo (valerato de amilo) | manzana | |
| Acetato de propilo | pera | |
| hexanoato de propilo | mora, piña, queso, vino | |
| isobutirato de propilo | Ron | |
| butirato de terpenilo |  | cereza |
Contenido relacionado
Metátesis de olefinas
Magnesio
Fenol