Orbitales atómicos
En teoría atómica y mecánica cuántica, un orbital atómico es una función que describe la ubicación y el comportamiento ondulatorio de un electrón en... (leer más)
Un fenol (también llamado ácido carbólico) es un compuesto orgánico aromático con la fórmula molecular C 6 H 5 OH. Es un sólido cristalino blanco que es volátil. La molécula consta de un grupo fenilo (−C 6 H 5) unido a un grupo hidroxi (−OH). Ligeramente ácido, requiere un manejo cuidadoso porque puede causar quemaduras químicas.
El fenol se extrajo primero del alquitrán de hulla, pero hoy en día se produce a gran escala (unos 7 000 millones de kg/año) a partir de materias primas derivadas del petróleo. Es un producto industrial importante como precursor de muchos materiales y compuestos útiles. Se utiliza principalmente para sintetizar plásticos y materiales relacionados. El fenol y sus derivados químicos son esenciales para la producción de policarbonatos, resinas epoxi, baquelita, nailon, detergentes, herbicidas como los herbicidas fenoxi y numerosas drogas farmacéuticas.
El fenol es un compuesto orgánico apreciablemente soluble en agua, con alrededor de 84,2 g disolviéndose en 1000 ml (0,895 M). Son posibles mezclas homogéneas de fenol y agua en proporciones de masa de fenol a agua de ~2,6 y superiores. La sal de sodio del fenol, el fenóxido de sodio, es mucho más soluble en agua.
El fenol es un ácido débil. En solución acuosa en el rango de pH aprox. 8 - 12 está en equilibrio con el anión fenolato C 6 H 5 O (también llamado fenóxido):C 6 H 5 OH ⇌ C 6 H 5 O + H
El fenol es más ácido que los alcoholes alifáticos. El pKa diferente se atribuye a la estabilización por resonancia del anión fenóxido. De esta manera, la carga negativa del oxígeno se deslocaliza en los átomos de carbono orto y para a través del sistema pi. Una explicación alternativa implica el marco sigma, que postula que el efecto dominante es la inducción de los carbonos con hibridación sp más electronegativos; la extracción inductiva comparativamente más poderosa de la densidad de electrones que proporciona el sistema sp en comparación con un sistema sp permite una gran estabilización del oxianión. En apoyo de la segunda explicación, el p K a del enol de la acetona en agua es 10,9, lo que lo hace ligeramente menos ácido que el fenol (p K a10.0). Así, el mayor número de estructuras de resonancia de las que dispone el fenóxido en comparación con el enolato de acetona parece contribuir muy poco a su estabilización. Sin embargo, la situación cambia cuando se excluyen los efectos de solvatación . Una comparación in silico reciente de las acidez en fase gaseosa de los vinilogos de fenol y ciclohexanol en conformaciones que permiten o excluyen la estabilización por resonancia conduce a la inferencia de que alrededor de 1 ⁄3 del aumento de la acidez del fenol es atribuible a efectos inductivos, teniendo en cuenta la resonancia. por la diferencia restante.
En los disolventes de tetracloruro de carbono y alcano, el fenol se une con una amplia gama de bases de Lewis, como la piridina, el éter dietílico y el sulfuro de dietilo. Se han estudiado las entalpías de formación de aductos y los cambios de frecuencia IR –OH que acompañan a la formación de aductos. El fenol se clasifica como un ácido duro que es compatible con la relación C / E del modelo ECW con E A = 2,27 y C A = 1,07. La fuerza aceptora relativa del fenol frente a una serie de bases, frente a otros ácidos de Lewis, se puede ilustrar mediante gráficos CB.
El anión fenóxido es un nucleófilo fuerte con una nucleofilia comparable a la de los carbaniones o aminas terciarias. Puede reaccionar tanto en sus sitios de oxígeno como de carbono como un nucleófilo ambidente (ver teoría HSAB). En general, el ataque de oxígeno de los aniones fenóxido se favorece cinéticamente, mientras que el ataque de carbono se prefiere termodinámicamente (ver Termodinámica versus control de reacción cinético). Se suele observar un ataque mixto de oxígeno/carbono y por esto una pérdida de selectividad si la velocidad de reacción alcanza el control de difusión.
El fenol exhibe tautomerismo de ceto-enol con su inestable tautómero ceto ciclohexadienona, pero solo existe una pequeña fracción de fenol en forma ceto. La constante de equilibrio para la enolización es de aproximadamente 10, lo que significa que solo una de cada diez billones de moléculas está en forma ceto en cualquier momento. La pequeña cantidad de estabilización ganada al intercambiar un enlace C=C por un enlace C=O es más que compensada por la gran desestabilización resultante de la pérdida de aromaticidad. Por lo tanto, el fenol existe esencialmente en su totalidad en forma de enol. La ciclohexadienona 4,4' sustituida puede sufrir un reordenamiento de dienona-fenol en condiciones ácidas y formar fenol disustituido en 3,4 estable.
Los fenóxidos son enolatos estabilizados por aromaticidad. En circunstancias normales, el fenóxido es más reactivo en la posición de oxígeno, pero la posición de oxígeno es un nucleófilo "duro" mientras que las posiciones de carbono alfa tienden a ser "blandas".
El fenol es altamente reactivo frente a la sustitución aromática electrófila. La nucleofilia mejorada se atribuye a la donación de densidad de electrones pi del O al anillo. Muchos grupos se pueden unir al anillo mediante halogenación, acilación, sulfonación y procesos relacionados. El anillo del fenol está tan fuertemente activado que la bromación y la cloración conducen fácilmente a la polisustitución. El fenol reacciona con ácido nítrico diluido a temperatura ambiente para dar una mezcla de 2-nitrofenol y 4-nitrofenol, mientras que con ácido nítrico concentrado se introducen grupos nitro adicionales, por ejemplo, para dar 2,4,6-trinitrofenol.
Las soluciones acuosas de fenol son débilmente ácidas y tornan el tornasol azul ligeramente a rojo. El fenol es neutralizado por hidróxido de sodio formando fenato o fenolato de sodio, pero al ser más débil que el ácido carbónico, no puede ser neutralizado por bicarbonato de sodio o carbonato de sodio para liberar dióxido de carbono.C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O
Cuando se agita una mezcla de fenol y cloruro de benzoílo en presencia de una solución diluida de hidróxido de sodio, se forma benzoato de fenilo. Este es un ejemplo de la reacción de Schotten-Baumann:C 6 H 5 COCl + HOC 6 H 5 → C 6 H 5 CO 2 C 6 H 5 + HCl
El fenol se reduce a benceno cuando se destila con polvo de zinc o cuando su vapor se pasa sobre gránulos de zinc a 400 °C:C 6 H 5 OH + Zn → C 6 H 6 + ZnO
Cuando el fenol se trata con diazometano en presencia de trifluoruro de boro (BF 3), se obtiene anisol como producto principal y gas nitrógeno como subproducto.C 6 H 5 OH + CH 2 N 2 → C 6 H 5 OCH 3 + N 2
Cuando el fenol reacciona con una solución de cloruro de hierro (III), se forma una solución violeta-púrpura intensa.
Debido a la importancia comercial del fenol, se han desarrollado muchos métodos para su producción, pero el proceso de cumeno es la tecnología dominante.
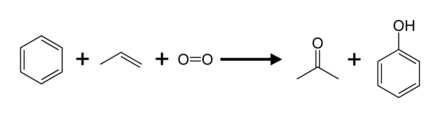
El proceso de cumeno, también llamado proceso Hock, representa el 95% de la producción (2003). Implica la oxidación parcial de cumeno (isopropilbenceno) a través del reordenamiento de Hock: en comparación con la mayoría de los otros procesos, el proceso de cumeno utiliza condiciones relativamente suaves y materias primas relativamente económicas. Para que el proceso sea económico, tanto el fenol como el subproducto de acetona deben tener demanda. En 2010, la demanda mundial de acetona fue de aproximadamente 6,7 millones de toneladas, de las cuales el 83 % se satisfizo con la acetona producida por el proceso de cumeno.
Una ruta análoga al proceso del cumeno comienza con el ciclohexilbenceno. Se oxida a un hidroperóxido, similar a la producción de hidroperóxido de cumeno. A través del reordenamiento de Hock, el hidroperóxido de ciclohexilbenceno se escinde para dar fenol y ciclohexanona. La ciclohexanona es un importante precursor de algunas medias de nailon.
La oxidación directa de benceno a fenol es teóricamente posible y de gran interés, pero no ha sido comercializada:C 6 H 6 + O → C 6 H 5 OH
El óxido nitroso es un oxidante potencialmente "verde" que es un oxidante más potente que el O 2. Sin embargo, las rutas para la generación de óxido nitroso siguen siendo poco competitivas.
Una electrosíntesis empleando corriente alterna da fenol a partir de benceno.
La oxidación del tolueno, desarrollada por Dow Chemical, implica una reacción catalizada por cobre del benzoato de sodio fundido con el aire:C 6 H 5 CH 3 + 2 O 2 → C 6 H 5 OH + CO 2 + H 2 O
Se propone que la reacción proceda a través de la formación de salicilato de benzoílo.
Los primeros métodos se basaban en la extracción de fenol a partir de derivados del carbón o la hidrólisis de derivados del benceno.
Una de las primeras rutas comerciales, desarrollada por Bayer y Monsanto a principios del siglo XX, comienza con la reacción de una base fuerte con ácido bencenosulfónico. La conversión está representada por esta ecuación idealizada:C 6 H 5 SO 3 H + 2 NaOH → C 6 H 5 OH + Na 2 SO 3 + H 2 O
El clorobenceno se puede hidrolizar a fenol usando una base (proceso Dow) o vapor (proceso Raschig-Hooker):C 6 H 5 Cl + NaOH → C 6 H 5 OH + NaClC 6 H 5 Cl + H 2 O → C 6 H 5 OH + HCl
Estos métodos adolecen del coste del clorobenceno y de la necesidad de eliminar el subproducto de cloruro.
El fenol también es un subproducto recuperable de la pirólisis del carbón. En el Proceso Lummus, la oxidación de tolueno a ácido benzoico se realiza por separado.
Las sales de fenildiazonio se hidrolizan a fenol. El método no tiene interés comercial ya que el precursor es caro.C 6 H 5 NH 2 + HCl/NaNO 2 → C 6 H 5 OH + N 2 + H 2 O + NaCl![]()
El ácido salicílico se descarboxila a fenol.
Los principales usos del fenol, que consumen dos tercios de su producción, implican su conversión en precursores de plásticos. La condensación con acetona da bisfenol-A, un precursor clave de policarbonatos y resinas epoxi. La condensación de fenol, alquilfenoles o difenoles con formaldehído da resinas fenólicas, un famoso ejemplo de las cuales es la baquelita. La hidrogenación parcial del fenol da ciclohexanona, un precursor del nailon. Los detergentes no iónicos se producen por alquilación de fenol para dar los alquilfenoles, por ejemplo, nonilfenol, que luego se someten a etoxilación.
El fenol también es un precursor versátil de una gran colección de medicamentos, sobre todo la aspirina, pero también muchos herbicidas y fármacos.
El fenol es un componente de la técnica de extracción de fenol-cloroformo líquido-líquido que se utiliza en biología molecular para obtener ácidos nucleicos a partir de tejidos o muestras de cultivos celulares. Dependiendo del pH de la solución, se puede extraer ADN o ARN.
El fenol es ampliamente utilizado como antiséptico, su uso fue iniciado por Joseph Lister (ver la sección de Historia).
Desde principios del siglo XX hasta la década de 1970 se utilizó en la producción de jabón carbólico. Los líquidos concentrados de fenol se usan comúnmente para el tratamiento permanente de las uñas encarnadas de los dedos de los pies y las manos, un procedimiento conocido como matrixectomía química. El procedimiento fue descrito por primera vez por Otto Boll en 1945. Desde entonces, se ha convertido en el producto químico de elección para las matricectomías químicas realizadas por los podólogos.
El fenol líquido concentrado se puede usar tópicamente como anestésico local para procedimientos de otología, como miringotomía y colocación de tubos de timpanotomía, como alternativa a la anestesia general u otros anestésicos locales. También tiene cualidades hemostáticas y antisépticas que lo hacen ideal para este uso.
El aerosol de fenol, generalmente con un 1,4% de fenol como ingrediente activo, se usa médicamente para tratar el dolor de garganta. Es el principio activo de algunos analgésicos orales como el spray Chloraseptic, TCP y Carmex.
El fenol es tan económico que atrae muchos usos a pequeña escala. Es un componente de los decapantes de pintura industriales utilizados en la industria de la aviación para la eliminación de epoxi, poliuretano y otros revestimientos químicamente resistentes.
Los derivados de fenol se han utilizado en la preparación de cosméticos, incluidos filtros solares, tintes para el cabello y preparaciones para aclarar la piel. Sin embargo, debido a problemas de seguridad, el uso de fenol en productos cosméticos está prohibido en la Unión Europea y Canadá.
El fenol fue descubierto en 1834 por Friedlieb Ferdinand Runge, quien lo extrajo (en forma impura) del alquitrán de hulla. Runge llamó al fenol "Karbolsäure" (ácido de carbón-aceite, ácido carbólico). El alquitrán de hulla siguió siendo la fuente principal hasta el desarrollo de la industria petroquímica. En 1841, el químico francés Auguste Laurent obtuvo fenol en forma pura.
En 1836, Auguste Laurent acuñó el nombre "phène" para el benceno; esta es la raíz de la palabra "fenol" y "fenilo". En 1843, el químico francés Charles Gerhardt acuñó el nombre de "fenol".
Las propiedades antisépticas del fenol fueron utilizadas por Sir Joseph Lister (1827-1912) en su técnica pionera de cirugía antiséptica. Lister decidió que las heridas en sí tenían que limpiarse a fondo. Luego cubría las heridas con un trapo o pelusa cubierta con fenol, o ácido carbólico como él lo llamaba. La irritación de la piel causada por la exposición continua al fenol condujo eventualmente a la introducción de técnicas asépticas (libres de gérmenes) en cirugía.
Joseph Lister fue estudiante en el University College London con Robert Liston, y luego ascendió al rango de cirujano en la Royal Infirmary de Glasgow. Lister experimentó con telas cubiertas de ácido fénico después de estudiar los trabajos y experimentos de su contemporáneo, Louis Pasteur, en la esterilización de varios medios biológicos. Lister se inspiró para tratar de encontrar una manera de esterilizar heridas vivas, lo que no se podía hacer con el calor requerido por los experimentos de Pasteur. Al examinar la investigación de Pasteur, Lister comenzó a armar su teoría: que los gérmenes estaban matando a los pacientes. Él teorizó que si los gérmenes pudieran ser eliminados o prevenidos, no ocurriría ninguna infección. Lister razonó que se podría usar un químico para destruir los microorganismos que causan la infección.
Mientras tanto, en Carlisle, Inglaterra, los funcionarios estaban experimentando con un tratamiento de aguas residuales, utilizando ácido carbólico para reducir el olor de los pozos negros de aguas residuales. Habiendo oído hablar de estos desarrollos y habiendo experimentado él mismo previamente con otros productos químicos con fines antisépticos sin mucho éxito, Lister decidió probar el ácido fénico como antiséptico para heridas. Tuvo su primera oportunidad el 12 de agosto de 1865, cuando recibió un paciente: un niño de once años con una fractura de tibia que le atravesó la piel de la parte inferior de la pierna. Normalmente, la amputación sería la única solución. Sin embargo, Lister decidió probar con ácido fénico. Después de colocar el hueso y sujetar la pierna con férulas, Lister empapó toallas de algodón limpias en ácido fénico sin diluir y las aplicó a la herida, cubriendo con una capa de papel de aluminio, dejándolas durante cuatro días. Cuando revisó la herida, Lister se sorprendió gratamente al no encontrar signos de infección, solo enrojecimiento cerca de los bordes de la herida debido al ligero ardor causado por el ácido fénico. Al volver a aplicar vendajes frescos con ácido carbólico diluido, el niño pudo caminar a casa después de unas seis semanas de tratamiento.
El 16 de marzo de 1867, cuando se publicaron los primeros resultados del trabajo de Lister en The Lancet, había tratado a un total de once pacientes con su nuevo método antiséptico. De ellos, solo uno había muerto, y eso fue por una complicación que no tenía nada que ver con la técnica de vendaje de heridas de Lister. Ahora, por primera vez, era probable que los pacientes con fracturas compuestas salieran del hospital con todas sus extremidades intactas— Richard Hollingham, Blood and Guts: A History of Surgery, p. 62
Antes de que se introdujeran las operaciones antisépticas en el hospital, hubo dieciséis muertes en treinta y cinco casos quirúrgicos. Casi uno de cada dos pacientes fallece. Después de que se introdujera la cirugía antiséptica en el verano de 1865, solo hubo seis muertes en cuarenta casos. La tasa de mortalidad se había reducido de casi el 50 por ciento a alrededor del 15 por ciento. fue un logro notable— Richard Hollingham, Blood and Guts: A History of Surgery, p. 63
El fenol fue el ingrediente principal de Carbolic Smoke Ball, un dispositivo ineficaz comercializado en Londres en el siglo XIX como protección contra la influenza y otras dolencias, y el tema del famoso caso legal Carlill v Carbolic Smoke Ball Company.
El efecto tóxico del fenol sobre el sistema nervioso central, que se analiza a continuación, provoca un colapso repentino y pérdida del conocimiento tanto en humanos como en animales; un estado de calambres precede a estos síntomas debido a la actividad motora controlada por el sistema nervioso central. Las inyecciones de fenol fueron utilizadas como medio de ejecución individual por la Alemania nazi durante la Segunda Guerra Mundial. Originalmente fue utilizado por los nazis en 1939 como parte del programa de eutanasia Aktion T4.Los alemanes aprendieron que el exterminio de grupos más pequeños era más económico inyectando fenol a cada víctima. Se administraron inyecciones de fenol a miles de personas. Maximilian Kolbe también fue asesinado con una inyección de fenol después de sobrevivir dos semanas de deshidratación y hambre en Auschwitz cuando se ofreció como voluntario para morir en lugar de un extraño. Aproximadamente un gramo es suficiente para causar la muerte.
El fenol es un producto metabólico normal, excretado en cantidades de hasta 40 mg/L en la orina humana.
La secreción de la glándula temporal de los elefantes machos mostró la presencia de fenol y 4-metilfenol durante el mosto.
También es uno de los compuestos químicos que se encuentran en el castóreo. Este compuesto se ingiere de las plantas que come el castor.
El fenol es un componente medible en el aroma y el sabor del distintivo whisky escocés Islay, generalmente ~30 ppm, pero puede superar las 160 ppm en la cebada malteada utilizada para producir whisky. Esta cantidad es diferente y presumiblemente mayor que la cantidad en el destilado.
Cryptanaerobacter fenolicus es una especie de bacteria que produce benzoato a partir de fenol a través de 4-hidroxibenzoato. Rhodococcus fenolicus es una especie de bacteria capaz de degradar el fenol como única fuente de carbono.
El fenol y sus vapores son corrosivos para los ojos, la piel y las vías respiratorias. Su efecto corrosivo sobre la piel y las mucosas se debe a un efecto degenerativo de las proteínas. El contacto repetido o prolongado de la piel con fenol puede causar dermatitis o incluso quemaduras de segundo y tercer grado. La inhalación de vapor de fenol puede causar edema pulmonar. La sustancia puede causar efectos nocivos en el sistema nervioso central y el corazón, dando como resultado arritmia, convulsiones y coma. Los riñones también pueden verse afectados. La exposición prolongada o repetida a la sustancia puede tener efectos nocivos para el hígado y los riñones. No hay evidencia de que el fenol cause cáncer en humanos.Además de sus efectos hidrófobos, otro mecanismo de toxicidad del fenol puede ser la formación de radicales fenoxilo.
Dado que el fenol se absorbe a través de la piel con relativa rapidez, puede producirse una intoxicación sistémica además de las quemaduras cáusticas locales. El envenenamiento por reabsorción por una gran cantidad de fenol puede ocurrir incluso con solo una pequeña área de la piel, lo que lleva rápidamente a la parálisis del sistema nervioso central y una caída severa de la temperatura corporal. La LD 50 para toxicidad oral es inferior a 500 mg/kg para perros, conejos o ratones; la dosis humana letal mínima se citó como 140 mg/kg. La Agencia para Sustancias Tóxicas y Registro de Enfermedades (ATSDR), Departamento de Salud y Servicios Humanos de los EE. UU. establece que la dosis fatal por ingestión de fenol es de 1 a 32 g.
Las quemaduras químicas por exposición de la piel se pueden descontaminar lavándolas con polietilenglicol, alcohol isopropílico o incluso con abundante agua. Se requiere quitarse la ropa contaminada, así como tratamiento hospitalario inmediato para salpicaduras grandes. Esto es particularmente importante si el fenol se mezcla con cloroformo (una mezcla comúnmente utilizada en biología molecular para la purificación de ADN y ARN). El fenol también es una toxina reproductiva que causa un mayor riesgo de aborto espontáneo y bajo peso al nacer, lo que indica un desarrollo retardado en el útero.
La palabra fenol también se usa para referirse a cualquier compuesto que contiene un anillo aromático de seis miembros, unido directamente a un grupo hidroxilo (-OH). Por lo tanto, los fenoles son una clase de compuestos orgánicos de los cuales el fenol discutido en este artículo es el miembro más simple.
En teoría atómica y mecánica cuántica, un orbital atómico es una función que describe la ubicación y el comportamiento ondulatorio de un electrón en... (leer más)
El europio es un elemento químico con el símbolo Eu y el número atómico 63. El europio es el lantánido más reactivo con diferencia, y debe almacenarse... (leer más)
(leer más)