Estallido respiratorio
El estallido respiratorio (o estallido oxidativo) es la liberación rápida de especies reactivas de oxígeno (ROS), el anión superóxido (O −
>2) y peróxido de hidrógeno (H
2O
2), de diferentes tipos de células.
Esto generalmente se utiliza para la defensa inmunológica de los mamíferos, pero también desempeña un papel en la señalización celular. El estallido respiratorio también está implicado en el óvulo de los animales después de la fertilización. También puede ocurrir en células vegetales.
Inmunidad
Las células inmunes se pueden dividir en células mieloides y células linfoides. Las células mieloides, incluidos los macrófagos y los neutrófilos, están especialmente implicadas en el estallido respiratorio. Son fagocíticos y el estallido respiratorio es vital para la posterior degradación de las bacterias internalizadas u otros patógenos. Este es un aspecto importante de la inmunidad innata.
El estallido respiratorio requiere un aumento de 10 a 20 veces en el consumo de oxígeno a través de la actividad de la NADPH oxidasa (NOX2 en humanos). NADPH es el sustrato clave de NOX2 y tiene poder reductor. La descomposición del glucógeno es vital para producir NADPH. Esto ocurre a través de la vía de las pentosas fosfato.
La enzima NOX2 está unida a la membrana del fagolisosoma. Después de la fagocitosis bacteriana, se activa y produce superóxido a través de su centro redox, que transfiere electrones del NADPH citosólico al O2 en el fagosoma.
2O2 + NADPH — título 2O2•– + NADP+ + H+
El superóxido puede reaccionar espontánea o enzimáticamente con otras moléculas para dar lugar a otras ROS. La membrana fagocítica se vuelve a sellar para limitar la exposición del entorno extracelular a los radicales libres reactivos generados.
Vías para la generación de especies reactivas
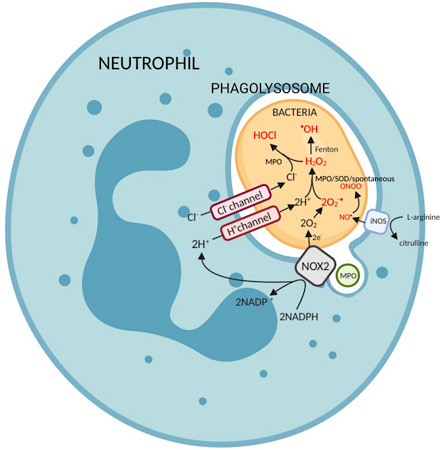
Existen 3 vías principales para la generación de especies reactivas de oxígeno o especies reactivas de nitrógeno (RNS) en las células efectoras:
- Superoxide dismutase (o alternativamente, mieloperoxidase) genera peróxido de hidrógeno de superóxido. Los radicales hidroxilos se generan a través de la reacción Haber-Weiss o de la reacción Fenton, de la cual ambos son catalizados por Fe2+.
O2•–+ H2O2 — •OH + OH– + O2 - En presencia de iones de halido, iones prominentes de cloruro, la mieloperoxidasa utiliza peróxido de hidrógeno para producir ácido hipocloroso.
H2O2 + Cl− — titulado ClO− + H2O - La sintasa de óxido nítrico (la isoform inducible, iNOS, en inmunidad) cataliza la producción de óxido nítrico de L-arginina. 2L-arginina + 3NADPH + 3 H+ + 4O2 — título 2citrulline + 2NO• + 4H2O + 3NADP+
El óxido nítrico puede reaccionar con aniones superóxidos para producir anión peroxinitrito.
Defensa contra patógenos
La exposición a estas especies reactivas en el estallido respiratorio produce patología. Esto se debe al daño oxidativo de las bacterias engullidas.
En particular, el peroxinitrito es un agente oxidante muy fuerte que puede provocar peroxidación de lípidos, oxidación de proteínas y nitración de proteínas, que son responsables de sus efectos bactericidas. Puede reaccionar directamente con proteínas que contienen centros de metales de transición, como FeS, liberando Fe2+ para la reacción de Fenton. El peroxinitrito también puede reaccionar con varios aminoácidos de la cadena peptídica, alterando así la estructura de las proteínas y, posteriormente, su función. Por lo general, oxida la cisteína y puede inducir indirectamente la nitración de tirosina a través de otros RNS generados. La función alterada de las proteínas incluye cambios en la actividad catalítica enzimática, la organización del citoesqueleto y la transducción de señales celulares.
El ácido hipocloroso reacciona con una variedad de biomoléculas, incluidos ADN, lípidos y proteínas. El HClO puede oxidar cisteínas y metioninas a través de sus grupos sulfhidrilo y azufre, respectivamente. El primero conduce a la formación de enlaces disulfuro, lo que induce el entrecruzamiento de proteínas. Ambas oxidaciones dan como resultado la agregación de proteínas y, en última instancia, la muerte celular. Los grupos sulfhidrilo pueden ser oxidados hasta tres veces por tres moléculas de HClO, formando ácidos sulfénicos, ácidos sulfínicos y R–SO3H, que son cada vez más irreversibles y bactericidas. Mientras tanto, la oxidación de la metionina es reversible. El HOCl también puede reaccionar con aminas primarias o secundarias, produciendo cloroaminas que son tóxicas para las bacterias. También pueden ocurrir agregación y entrecruzamiento de proteínas, así como también alteración de los grupos FeS.
Un elemento integral de la formación de ácido hipocloroso es la mieloperoxidasa. La mieloperoxidasa es más abundante en los neutrófilos, donde la fagocitosis se acompaña de desgranulación. Se trata de la fusión de los gránulos con el fagolisosoma, liberando su contenido, incluida la mieloperoxidasa. Como muchos productos microbicidas se forman durante el estallido respiratorio, no se comprende del todo la importancia de las moléculas individuales para matar patógenos invasores.
Debido a la alta toxicidad de los productos antimicrobianos generados, incluidas las ROS, los neutrófilos tienen una vida corta para limitar el daño al tejido del huésped durante la inflamación.
Enfermedad
La enfermedad granulomatosa crónica es una enfermedad hereditaria de los neutrófilos humanos, en la que el NOX2 es defectuoso. Aún puede ocurrir fagocitosis, pero sin el funcionamiento adecuado de NOX2, no hay producción de superóxido y, por lo tanto, no hay explosión respiratoria. La infección bacteriana no desaparece.
Señalización celular
Células no fagocíticas
En las células no fagocíticas, los productos de explosión oxidativa se utilizan en las vías de señalización intracelular. Las ROS generadas logran esto cambiando el estado redox de la célula. Esto puede controlarse mediante la relación entre la enzima antioxidante glutatión y su producto oxidado, disulfuro de glutatión (GSH:GSSG). Las enzimas antioxidantes contrarrestan la señalización redox eliminando las moléculas involucradas, principalmente el anión superóxido y el óxido nítrico. La señalización redox es fundamental para procesos normales como la proliferación, la diferenciación, así como la función vascular y la neurotransmisión. También está implicado en estados patológicos como el cáncer.
La isoforma NOX1 de la NADPH oxidasa produce transitoriamente una explosión de superóxido en respuesta a la estimulación del factor de crecimiento (por ejemplo, EGF) de los respectivos receptores. El superóxido se dismuta en peróxido de hidrógeno a una velocidad cercana a la velocidad limitada por difusión. Esta restricción espacial para la dismutación del superóxido permite la especificidad de la señalización redox. La especificidad también está garantizada por la localización de NOX1 en microdominios específicos de la membrana plasmática de la célula. A través de canales como la acuaporina o la difusión, el peróxido de hidrógeno ingresa al citosol. Allí oxida los grupos cisteína de las proteínas sensibles a redox, que luego pueden transducir señales.
Macrófagos
El estallido oxidativo en los fagocitos se asocia más comúnmente con la muerte bacteriana. Sin embargo, los macrófagos, especialmente los alveolares, generalmente producen niveles mucho más bajos de ROS que los neutrófilos y pueden requerir activación para sus propiedades bactericidas. En cambio, su estallido oxidativo transitorio regula la respuesta inflamatoria al inducir la síntesis de citoquinas para la señalización redox, lo que resulta en una afluencia de neutrófilos y macrófagos activados.
Células cancerosas
Las células cancerosas pueden manipular la señalización celular produciendo niveles excesivos de ROS, activando así de manera constitutiva vías para promover su crecimiento y proliferación celular. Las vías implicadas incluyen NF-κB, PI3K, HIF y MAPK. En los seres humanos, las ROS mitocondriales son necesarias junto con las liberadas en el estallido oxidativo para la estimulación de la vía mitogénica en las células KRAS oncogénicas. Sin embargo, en los fibroblastos oncogénicos de ratones Kras, se ha demostrado que los inhibidores de la NADPH oxidasa son suficientes para bloquear estas vías de los factores de crecimiento. Las células tumorigénicas también mantienen simultáneamente altos niveles de antioxidantes para proteger contra la muerte de las células cancerosas.
Fertilización
En particular, el estallido oxidativo posterior a la fertilización se puede observar en el huevo del erizo de mar. Se cree que esto es evolutivamente divergente del de los neutrófilos.
El peróxido de hidrógeno se produce por la actividad oxidasa del huevo tras un aumento en el consumo de oxígeno. Esto es esencial para el entrecruzamiento de las proteínas del óvulo para prevenir la polispermia letal. El peróxido de hidrógeno en sí también es espermicida. Sin embargo, las especies reactivas generadas se mantienen en niveles más bajos que en la inmunidad para proteger el óvulo fertilizado del daño oxidativo. Esto se logra mediante la eliminación del peróxido de hidrógeno principalmente a través de la función dual de la misma oxidasa del huevo y, en segundo lugar, a través de eliminadores de ROS citoplasmáticos, como la catalasa y el glutatión.
En plantas
La explosión oxidativa actúa como un mecanismo de defensa contra la infección por patógenos en las plantas. Esto se observa después de la detección de PAMP por parte de receptores ubicados en la superficie celular (por ejemplo, FLS2 o EFR). Al igual que en los animales, la producción de especies reactivas de oxígeno en las plantas está mediada por la NADPH oxidasa. En la inmunidad de las plantas, las subunidades de la NADPH oxidasa, RbohD y RbohF, tienen funciones superpuestas y se expresan en diferentes tejidos y en diferentes niveles. Sin embargo, a diferencia de los fagocitos animales, en los que las ROS generadas están contenidas en el fagolisosoma sellado, el estallido oxidativo en las plantas no está contenido. En consecuencia, las ROS generadas tienen efectos adicionales además de la toxicidad de los patógenos. El peróxido de hidrógeno induce el entrecruzamiento oxidativo de las glicoproteínas de la pared celular de la planta. Esto reduce la susceptibilidad a la degradación enzimática por parte de patógenos. En las células vegetales expuestas también se induce una resistencia sistémica adquirida, análoga a la inmunidad innata en los animales. La exposición al peróxido de hidrógeno también puede provocar una respuesta hipersensible, que es la muerte de una pequeña cantidad de células huésped en el sitio de la infección, con el fin de limitar la infección patógena. La producción de ROS en plantas se puede utilizar como lectura para el reconocimiento exitoso de patógenos mediante un ensayo basado en luminol-peroxidasa.
Contenido relacionado
Ley de Fick
Híbrido (biología)
Evolución divergente