Californio
El californio es un elemento químico radiactivo con el símbolo Cf y el número atómico 98. El elemento se sintetizó por primera vez en 1950 en el... (leer más)
La energía química es la energía de las sustancias químicas que se libera cuando sufren una reacción química y se transforman en otras sustancias. Algunos ejemplos de medios de almacenamiento de energía química incluyen baterías, alimentos, gasolina y gas oxígeno. La ruptura y reconstrucción de enlaces químicos implica energía, que puede ser absorbida por un sistema químico o evolucionar a partir de él.
La energía que puede ser liberada o absorbida por una reacción entre sustancias químicas es igual a la diferencia entre el contenido energético de los productos y los reactivos, si la temperatura inicial y final es la misma. Este cambio de energía se puede estimar a partir de las energías de enlace de los reactivos y productos. También se puede calcular a partir de 

Un término relacionado es el calor de combustión, que es la energía principalmente de los dobles enlaces débiles de oxígeno molecular liberados debido a una reacción de combustión y que a menudo se aplica en el estudio de los combustibles. Los alimentos son similares a los combustibles de hidrocarburos y carbohidratos, y cuando se oxidan a dióxido de carbono y agua, la energía liberada es análoga al calor de combustión (aunque se evalúa de manera diferente que para un combustible de hidrocarburos; consulte energía alimentaria).
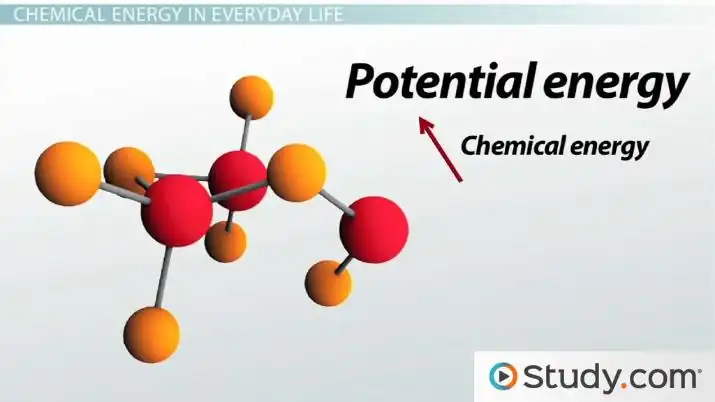
La energía potencial química es una forma de energía potencial relacionada con la disposición estructural de los átomos o moléculas. Este arreglo puede ser el resultado de enlaces químicos dentro de una molécula o interacciones entre ellos. La energía química de una sustancia química puede transformarse en otras formas de energía mediante una reacción química. Por ejemplo, cuando se quema un combustible, la energía química del oxígeno molecular se convierte en calor. Las plantas verdes transforman la energía solar en energía química (principalmente de oxígeno) a través del proceso de fotosíntesis, y la energía eléctrica se puede convertir en energía química y viceversa a través de reacciones electroquímicas.
El término similar potencial químico se usa para indicar el potencial de una sustancia para sufrir un cambio de configuración, ya sea en forma de reacción química, transporte espacial, intercambio de partículas con un reservorio, etc. No esuna forma de energía potencial en sí misma, pero está más estrechamente relacionada con la energía libre. La confusión en la terminología surge del hecho de que en otras áreas de la física no dominadas por la entropía, toda la energía potencial está disponible para realizar un trabajo útil e impulsa al sistema a experimentar espontáneamente cambios de configuración y, por lo tanto, no hay distinción entre "libre" y "libre". energía potencial "no libre" (de ahí la palabra "potencial"). Sin embargo, en sistemas de gran entropía como los sistemas químicos, la cantidad total de energía presente (y conservada según la primera ley de la termodinámica) de la que forma parte esta energía potencial química,segunda ley).