Electrodo clark
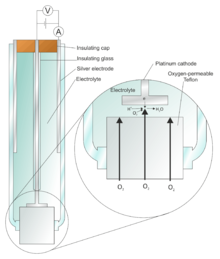
El electrodo Clark es un electrodo que mide la presión parcial de oxígeno ambiental en un líquido utilizando una superficie catalítica de platino según la reacción neta:
- O2 + 4 e− + 4 H+ → 2 H2O
Mejora en un electrodo de platino desnudo mediante el uso de una membrana para reducir la manipulación y el platino metálico en el platino.
Historia
Leland Clark (Profesor de Química, Antioch College, Yellow Springs, Ohio, y Fels Research Institute, Yellow Springs, Ohio) había desarrollado el primer oxigenador de burbujas para uso en cirugía cardíaca. Sin embargo, cuando llegó a publicar sus resultados, el editor rechazó su artículo porque no se podía medir la tensión de oxígeno en la sangre que salía del dispositivo. Esto motivó a Clark a desarrollar el electrodo de oxígeno.
El electrodo, cuando se implanta in vivo, reducirá el oxígeno y, por lo tanto, será necesario agitarlo para mantener el equilibrio con el medio ambiente. Severinghaus mejoró el diseño añadiendo una cubeta agitada en un termostato. Una discrepancia entre la presión parcial de oxígeno medida (pO2) entre muestras de sangre y mezclas gaseosas de pO2 idéntica, significó que el electrodo modificado requería calibración; en consecuencia, se añadió un microtonómetro al termostato de agua.
Mecanismo de acción
El compartimento del electrodo está aislado de la cámara de reacción mediante una fina membrana de teflón; la membrana es permeable al oxígeno molecular y permite que este gas llegue al cátodo, donde se reduce electrolíticamente.
La reacción anterior requiere un flujo constante de electrones hacia el cátodo, que depende de la velocidad a la que el oxígeno puede alcanzar la superficie del electrodo. Aumentar el voltaje aplicado (entre el electrodo de Pt y un segundo electrodo de Ag) aumentará la velocidad de electrocatálisis. Clark fijó una membrana permselectiva de oxígeno sobre el electrodo de Pt. Esto limita la tasa de difusión de oxígeno al electrodo de Pt.
Por encima de cierto voltaje, la corriente se estabiliza y el aumento adicional del potencial no da como resultado una mayor velocidad de electrocatálisis de la reacción. En este punto, la reacción está limitada por difusión y depende sólo de las propiedades de permeabilidad de la membrana (que idealmente está bien caracterizada, el electrodo está calibrado contra soluciones estándar conocidas) y de la concentración de oxígeno gaseoso, que es la cantidad medida.
Aplicaciones
El electrodo de oxígeno de Clark sentó las bases para el primer biosensor de glucosa (de hecho, el primer biosensor de cualquier tipo), inventado por Clark y Lyons en 1962. Este sensor utilizó un único electrodo de oxígeno Clark acoplado con un contraelectrodo. Al igual que con el electrodo de Clark, una membrana permselectiva cubre el electrodo de Pt. Ahora, sin embargo, la membrana está impregnada con glucosa oxidasa (GOx) inmovilizada. El GOx consumirá parte del oxígeno a medida que se difunde hacia el electrodo PT, incorporándolo en H2O2 y ácido glucónico. La velocidad de la corriente de reacción está limitada por la difusión tanto de glucosa como de oxígeno. Esta difusión se puede caracterizar bien para una membrana tanto para el oxígeno como para la glucosa, dejando como única variable las concentraciones de oxígeno y glucosa en el lado del analito de la membrana de glucosa, que es la cantidad que se mide.
Contenido relacionado
Ley de Fick
Historia de la cámara
Miscibilidad