Distribución de Maxwell-Boltzmann
Función de distribución de probabilidad específica, importante en la física
En física (en particular en mecánica estadística), la distribución de Maxwell-Boltzmann, o distribución de Maxwell(ian), es una distribución de probabilidad particular que lleva el nombre de James Clerk Maxwell y Ludwig Boltzmann.
Se definió y usó por primera vez para describir las velocidades de las partículas en gases idealizados, donde las partículas se mueven libremente dentro de un contenedor estacionario sin interactuar entre sí, excepto en colisiones muy breves en las que intercambian energía y cantidad de movimiento entre sí o con sus ambiente termal. El término "partícula" en este contexto se refiere únicamente a partículas gaseosas (átomos o moléculas), y se supone que el sistema de partículas ha alcanzado el equilibrio termodinámico. Las energías de tales partículas siguen lo que se conoce como estadísticas de Maxwell-Boltzmann, y la distribución estadística de velocidades se obtiene equiparando las energías de las partículas con la energía cinética.
Matemáticamente, la distribución Maxwell-Boltzmann es la distribución chi con tres grados de libertad (los componentes del vector de velocidad en el espacio euclidiano), con un parámetro escala velocidades de medición en unidades proporcionales a la raíz cuadrada  (la relación de temperatura y masa de partículas).
(la relación de temperatura y masa de partículas).
La distribución de Maxwell-Boltzmann es el resultado de la teoría cinética de los gases, que proporciona una explicación simplificada de muchas propiedades fundamentales de los gases, incluidas la presión y la difusión. La distribución de Maxwell-Boltzmann se aplica fundamentalmente a las velocidades de las partículas en tres dimensiones, pero resulta depender únicamente de la velocidad (la magnitud de la velocidad) de las partículas. Una distribución de probabilidad de velocidad de partículas indica qué velocidades son más probables: una partícula elegida al azar tendrá una velocidad seleccionada al azar de la distribución, y es más probable que esté dentro de un rango de velocidades que otro. La teoría cinética de los gases se aplica al gas ideal clásico, que es una idealización de los gases reales. En los gases reales, hay varios efectos (por ejemplo, interacciones de van der Waals, flujo de vórtices, límites de velocidad relativistas e interacciones de intercambio cuántico) que pueden hacer que su distribución de velocidad sea diferente de la forma de Maxwell-Boltzmann. Sin embargo, los gases enrarecidos a temperaturas ordinarias se comportan casi como un gas ideal y la distribución de velocidad de Maxwell es una excelente aproximación para tales gases. Esto también es cierto para los plasmas ideales, que son gases ionizados de densidad suficientemente baja.
La distribución fue deducida por primera vez por Maxwell en 1860 por motivos heurísticos. Boltzmann más tarde, en la década de 1870, llevó a cabo importantes investigaciones sobre los orígenes físicos de esta distribución. La distribución se puede derivar sobre la base de que maximiza la entropía del sistema. Una lista de derivaciones son:
- Distribución máxima de probabilidad de entropía en el espacio de fase, con la limitación de conservación de la energía promedio
 ;
; - Conjunto canónico.
Función de distribución
Para un sistema que contiene un gran número de partículas clásicas no-interactantes idénticas no-relativistas en el equilibrio themodynamic, la fracción de las partículas dentro de un elemento infinitesimal del espacio de velocidad tridimensional  , centrado en un vector de velocidad de magnitud
, centrado en un vector de velocidad de magnitud  , se da por
, se da por






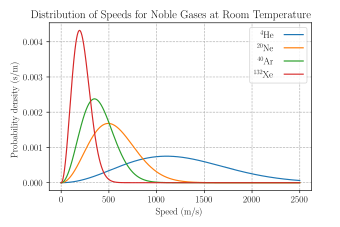
La densidad de probabilidad de velocidad de las velocidades de unos pocos gases nobles a una temperatura de 298.15 K (25 °C). El
Sí.-eje está en s/m para que el área bajo cualquier sección de la curva (que representa la probabilidad de que la velocidad esté en ese rango) sea indimensional.
Uno puede escribir el elemento de espacio de velocidad como  , para velocidades en un sistema de coordenadas cartesiano estándar, o como
, para velocidades en un sistema de coordenadas cartesiano estándar, o como  en un sistema de coordinación esférica estándar, donde
en un sistema de coordinación esférica estándar, donde  es un elemento de ángulo sólido.
es un elemento de ángulo sólido.
La función de distribución de Maxwellian para partículas que se mueven en una sola dirección, si esta dirección es  , es
, es



Reconociendo la simetría de  , se puede integrar sobre ángulo sólido y escribir una distribución de probabilidad de velocidades como la función
, se puede integrar sobre ángulo sólido y escribir una distribución de probabilidad de velocidades como la función

Esta función de densidad de probabilidad da la probabilidad, por velocidad de unidad, de encontrar la partícula con una velocidad cercana  . Esta ecuación es simplemente la distribución Maxwell-Boltzmann (dada en el cuadro de información) con parámetro de distribución
. Esta ecuación es simplemente la distribución Maxwell-Boltzmann (dada en el cuadro de información) con parámetro de distribución  .
La distribución de Maxwell-Boltzmann es equivalente a la distribución de chi con tres grados de libertad y parámetro escala
.
La distribución de Maxwell-Boltzmann es equivalente a la distribución de chi con tres grados de libertad y parámetro escala  .
.
La ecuación diferencial ordinaria más simple satisfecha por la distribución es:


o en presentación sin unidades:



Simulación de un gas 2D relajante hacia una distribución de velocidad Maxwell-Boltzmann
Relación con la distribución 2D Maxwell-Boltzmann
Para partículas confinadas a moverse en un plano, la distribución de velocidad está dada por

Esta distribución se utiliza para describir sistemas en equilibrio. Sin embargo, la mayoría de los sistemas no comienzan en su estado de equilibrio. La evolución de un sistema hacia su estado de equilibrio se rige por la ecuación de Boltzmann. La ecuación predice que para interacciones de corto alcance, la distribución de velocidad de equilibrio seguirá una distribución de Maxwell-Boltzmann. A la derecha hay una simulación de dinámica molecular (MD) en la que 900 partículas de esfera dura están restringidas para moverse en un rectángulo. Interactúan a través de colisiones perfectamente elásticas. El sistema se inicializa fuera del equilibrio, pero la distribución de velocidades (en azul) converge rápidamente a la distribución 2D de Maxwell-Boltzmann (en naranja).
Velocidades típicas
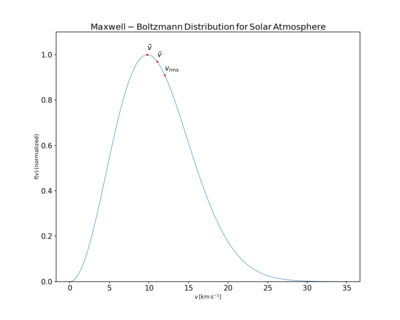
La distribución Maxwell-Boltzmann correspondiente a la atmósfera solar. Las masas de partículas son una masa de protones,

, y la temperatura es la temperatura efectiva de la fotosfera del sol,

.

marcar las velocidades cuadradas más probables, medias y root media, respectivamente. Sus valores son


y

.
La velocidad media  , velocidad más probable (modo) vp, y velocidad de mediana raíz
, velocidad más probable (modo) vp, y velocidad de mediana raíz  se puede obtener de propiedades de la distribución Maxwell.
se puede obtener de propiedades de la distribución Maxwell.
Esto funciona bien para gases monoatómicos casi ideales como el helio, pero también para gases moleculares como el oxígeno diatómico. Esto se debe a que a pesar de la mayor capacidad calorífica (mayor energía interna a la misma temperatura) debido a su mayor número de grados de libertad, su energía cinética de traslación (y por lo tanto su velocidad) no cambia.
- La velocidad más probable, vp, es la velocidad más probable que sea poseída por cualquier molécula (de la misma masa m) en el sistema y corresponde al valor máximo o al modo de f()v). Para encontrarlo, calculamos el derivado df/Dv, ponerlo a cero y resolver para v:





- La velocidad media es el valor esperado de la distribución de velocidad, estableciendo
 :
: 
- La media velocidad cuadrada
 es el momento crudo de segundo orden de la distribución de velocidad. La "raíz media cuadrada"
es el momento crudo de segundo orden de la distribución de velocidad. La "raíz media cuadrada"  es la raíz cuadrada de la velocidad cuadrada media, correspondiente a la velocidad de una partícula con energía cinética mediana, ajuste
es la raíz cuadrada de la velocidad cuadrada media, correspondiente a la velocidad de una partícula con energía cinética mediana, ajuste  :
:![{displaystyle {begin{aligned}v_{mathrm {rms} }&={sqrt {langle v^{2}rangle }}=left(int _{0}^{infty }v^{2},f(v),dvright)^{1/2}\&=left(4pi left({frac {b}{pi }}right)^{3/2}int _{0}^{infty }v^{4}e^{-bv^{2}}dvright)^{1/2}\&=left(4pi left({frac {b}{pi }}right)^{3/2}{frac {3}{8}}{sqrt {frac {pi }{b^{5}}}}right)^{1/2}=left({frac {3}{2b}}right)^{1/2}\[4pt]&={sqrt {frac {3kT}{m}}}={sqrt {frac {3RT}{M}}}={sqrt {frac {3}{2}}}v_{p}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e61f08e1e8713ea010c0d7f3046a1b77002b4d36)
En resumen, las velocidades típicas se relacionan de la siguiente manera:

La velocidad cuadrática media está directamente relacionada con la velocidad del sonido c en el gas, por

 f300 K
f300 K

La velocidad relativa media


La integral se puede hacer fácilmente cambiando a coordenadas  y
y 
Derivación y distribuciones relacionadas
Estadísticas de Maxwell-Boltzmann
La derivación original en 1860 por James Clerk Maxwell fue un argumento basado en las colisiones moleculares de la teoría cinética de los gases, así como ciertas simetrías en la función de distribución de velocidad; Maxwell también dio un argumento temprano de que estas colisiones moleculares implican una tendencia hacia el equilibrio. Después de Maxwell, Ludwig Boltzmann en 1872 también derivó la distribución por motivos mecánicos y argumentó que los gases deberían tender hacia esta distribución con el tiempo, debido a las colisiones (ver el teorema H). Más tarde (1877) derivó la distribución nuevamente bajo el marco de la termodinámica estadística. Las derivaciones en esta sección siguen las líneas de la derivación de Boltzmann de 1877, comenzando con el resultado conocido como estadística de Maxwell-Boltzmann (de la termodinámica estadística). Las estadísticas de Maxwell-Boltzmann dan el número promedio de partículas que se encuentran en un microestado de una sola partícula. Bajo ciertas suposiciones, el logaritmo de la fracción de partículas en un microestado dado es proporcional a la relación entre la energía de ese estado y la temperatura del sistema:

Esta relación se puede escribir como una ecuación introduciendo un factor de normalización:
 | | ()1) |
donde:
- Ni es el número esperado de partículas en el microestado de partículas únicas i,
- N es el número total de partículas en el sistema,
- Ei es la energía de microstate i,
- la suma sobre el índice j toma en cuenta todos los microestados,
- T es la temperatura del equilibrio del sistema,
- k es la constante de Boltzmann.
El denominador en la ecuación1) es un factor normalizador para que las ratios  añadir a la unidad — en otras palabras es una especie de función de partición (para el sistema de partícula única, no la función habitual de partición de todo el sistema).
añadir a la unidad — en otras palabras es una especie de función de partición (para el sistema de partícula única, no la función habitual de partición de todo el sistema).
Debido a que la velocidad y la velocidad están relacionadas con la energía, la Ecuación (1) se puede usar para derivar relaciones entre la temperatura y las velocidades de las partículas de gas. Todo lo que se necesita es descubrir la densidad de microestados en energía, que se determina dividiendo el espacio de momento en regiones de igual tamaño.
Distribución del vector impulso
La energía potencial se toma como cero, por lo que toda la energía está en forma de energía cinética.
La relación entre la energía cinética y el momento para partículas masivas no relativistas es
 | | ()2) |
donde p2 es el cuadrado del vector de impulso p = [p< /i>x, py, pz]. Por lo tanto, podemos reescribir la Ecuación (1) como:
![{displaystyle {frac {N_{i}}{N}}={frac {1}{Z}}exp left[-{frac {p_{i,x}^{2}+p_{i,y}^{2}+p_{i,z}^{2}}{2mkT}}right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8dc173ee0113a100c4713d64801c5f4d028cff71) | | ()3) |
Donde Z es la función de partición, correspondiente al denominador en la ecuación (1). Aquí. m es la masa molecular del gas, T es la temperatura termodinámica y k es la constante de Boltzmann. Esta distribución  es proporcional a la función de densidad de probabilidad fp para encontrar una molécula con estos valores de componentes de impulso, por lo que:
es proporcional a la función de densidad de probabilidad fp para encontrar una molécula con estos valores de componentes de impulso, por lo que:
![{displaystyle f_{mathbf {p} }(p_{x},p_{y},p_{z})propto exp left[-{frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3712e79fe2355995f5c9ee99a51c83127dff8a0a) | | ()4) |
La constante de normalización se puede determinar reconociendo que la probabilidad de que una molécula tenga algún impulso debe ser 1.
Integrando la exponencial en (4) sobre todo px, py, y pz produce un factor de
![{displaystyle iiint _{-infty }^{+infty }exp left[-{frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}right]dp_{x},dp_{y},dp_{z}=left({sqrt {pi }}{sqrt {2mkT}}right)^{3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/21e85bad795e923234bd7b9cbf7575ea66873272)
Para que la función de distribución normalizada sea:
![{displaystyle f_{mathbf {p} }(p_{x},p_{y},p_{z})=left(2pi mkTright)^{-3/2}exp left[-{frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/76fdc75e9040e7fa2bb88d60729f7183c2b1bf1a) ()6)
()6)
La distribución se considera el producto de tres variables distribuidas normalmente independientes  ,
,  , y
, y  , con diferencia
, con diferencia  . Además, se puede ver que la magnitud del impulso se distribuirá como una distribución Maxwell-Boltzmann, con
. Además, se puede ver que la magnitud del impulso se distribuirá como una distribución Maxwell-Boltzmann, con  . La distribución Maxwell-Boltzmann para el impulso (o por igual para las velocidades) se puede obtener más fundamentalmente utilizando el teorema H en equilibrio dentro del marco de la teoría Kinetic de los gases.
. La distribución Maxwell-Boltzmann para el impulso (o por igual para las velocidades) se puede obtener más fundamentalmente utilizando el teorema H en equilibrio dentro del marco de la teoría Kinetic de los gases.
Distribución de la energía
La distribución de energía se encuentra imponente
 | | ()7) |
Donde  es el volumen de fase-espacio infinitesimal de momenta correspondiente al intervalo de energía
es el volumen de fase-espacio infinitesimal de momenta correspondiente al intervalo de energía  .
Uso de la simetría esférica de la relación de dispersión energética-momentum
.
Uso de la simetría esférica de la relación de dispersión energética-momentum  , esto se puede expresar en términos de
, esto se puede expresar en términos de  como
como
 | | ()8) |
Usando entonces (8En7), y expresar todo en términos de la energía  , tenemos
, tenemos

 ()9)
()9)
Puesto que la energía es proporcional a la suma de los cuadrados de los tres componentes de impulso normalmente distribuidos, esta distribución de energía se puede escribir equivalentemente como una distribución gamma, utilizando un parámetro de forma,  y un parámetro de escala,
y un parámetro de escala,  .
.
Usando el teorema de equipartición, dado que la energía se distribuye uniformemente entre los tres grados de libertad en equilibrio, también podemos dividir  en un conjunto de distribuciones quiscuas, donde la energía por grado de libertad,
en un conjunto de distribuciones quiscuas, donde la energía por grado de libertad,  , se distribuye como una distribución con un grado de libertad,
, se distribuye como una distribución con un grado de libertad,

En el equilibrio, esta distribución será válida para cualquier número de grados de libertad. Por ejemplo, si las partículas son dipolos de masa rígida de momento dipolar fijo, tendrán tres grados de libertad de traslación y dos grados de libertad de rotación adicionales. La energía en cada grado de libertad se describirá de acuerdo con la distribución de chi-cuadrado anterior con un grado de libertad, y la energía total se distribuirá de acuerdo con una distribución de chi-cuadrado con cinco grados de libertad. Esto tiene implicaciones en la teoría del calor específico de un gas.
Distribución del vector de velocidad
Reconociendo que la densidad de probabilidad de velocidad fv es proporcional a la función de densidad de probabilidad de impulso por

y usando p = mv obtenemos
![f_{{mathbf {v}}}(v_{x},v_{y},v_{z})=left({frac {m}{2pi kT}}right)^{{3/2}}exp left[-{frac {m(v_{x}^{2}+v_{y}^{2}+v_{z}^{2})}{2kT}}right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/efc0617ed7d78e1282e9dffef06398cadf8b74b9)
que es la distribución de velocidad de Maxwell-Boltzmann. La probabilidad de encontrar una partícula con velocidad en el elemento infinitesimal [dvx, dv< /i>y, dvz] sobre la velocidad < abarcan clase="texhtml">v = [vx, v< sub>y, vz] es

Como el impulso, esta distribución se considera el producto de tres variables distribuidas normalmente independientes  ,
,  , y
, y  , pero con varianza
, pero con varianza  .
También se puede ver que la distribución de velocidad Maxwell-Boltzmann para la velocidad del vector
[vx, vSí., vz] es el producto de las distribuciones para cada una de las tres direcciones:
.
También se puede ver que la distribución de velocidad Maxwell-Boltzmann para la velocidad del vector
[vx, vSí., vz] es el producto de las distribuciones para cada una de las tres direcciones:


Cada componente del vector de velocidad tiene una distribución normal con media  y desviación estándar
y desviación estándar  , por lo que el vector tiene una distribución normal tridimensional, un tipo particular de distribución normal multivariada, con media
, por lo que el vector tiene una distribución normal tridimensional, un tipo particular de distribución normal multivariada, con media  y covariancia
y covariancia  , donde
, donde  es
es  matriz de identidad.
matriz de identidad.
Distribución de la velocidad
La distribución de Maxwell-Boltzmann para la velocidad se sigue inmediatamente de la distribución del vector de velocidad anterior. Tenga en cuenta que la velocidad es






![{displaystyle f(v)=left({frac {2}{pi }}right)^{1/2}left({frac {m}{kT}}right)^{3/2}v^{2}exp left[-{frac {mv^{2}}{2kT}}right].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8efeebc81e96ca2166aa4652f1228131ab1eeb66)
En espacio n-dimensional
En un espacio n-dimensional, la distribución de Maxwell-Boltzmann se convierte en:

La distribución de velocidad se convierte en:

El siguiente resultado integral es útil:
![{displaystyle {begin{aligned}int _{0}^{+infty }v^{a}e^{-{frac {mv^{2}}{2kT}}}dv&=left[{frac {2kT}{m}}right]^{(a+1)/2}int _{0}^{+infty }e^{-x}x^{frac {a}{2}}dx^{frac {1}{2}}\&=left[{frac {2kT}{m}}right]^{(a+1)/2}int _{0}^{+infty }e^{-x}x^{frac {a}{2}}{frac {x^{-{frac {1}{2}}}}{2}}dx\&=left[{frac {2kT}{m}}right]^{(a+1)/2}{frac {Gamma ({frac {a+1}{2}})}{2}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a5aa880a767dda0a1e61815cab2be0c852f49e72)

![{displaystyle {begin{aligned}langle vrangle &={frac {displaystyle int _{0}^{+infty }vcdot v^{n-1}e^{-{frac {mv^{2}}{2kT}}}dv}{displaystyle int _{0}^{+infty }v^{n-1}e^{-{frac {mv^{2}}{2kT}}}dv}}\[4pt]&=left[{frac {2kT}{m}}right]^{1/2}{frac {Gamma left({frac {n+1}{2}}right)}{Gamma left({frac {n}{2}}right)}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/154ad7695a948053a64d09525a8afc8f5d453bce)
![{textstyle v_{text{avg}}=langle vrangle =left[{frac {2kT}{m}}right]^{1/2}{frac {Gamma left({frac {n+1}{2}}right)}{Gamma left({frac {n}{2}}right)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c010a817b5628538a0dab5538be135a7a02194c0)
![{displaystyle {begin{aligned}langle v^{2}rangle &={frac {displaystyle int _{0}^{+infty }v^{2}cdot v^{n-1}e^{-{frac {mv^{2}}{2kT}}}dv}{displaystyle int _{0}^{+infty }v^{n-1}e^{-{frac {mv^{2}}{2kT}}}dv}}\&=left[{frac {2kT}{m}}right]{frac {Gamma ({frac {n+2}{2}})}{Gamma ({frac {n}{2}})}}\&=left[{frac {2kT}{m}}right]{frac {n}{2}}={frac {nkT}{m}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/89444d8cb7634d33b4ea48ddb9f6c7f8e3bac976)
![{textstyle v_{text{rms}}={sqrt {langle v^{2}rangle }}=left[{frac {nkT}{m}}right]^{1/2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b78dc8e93fa9ed7531bdaceba0d484ca15f3a968)
La derivada de la función de distribución de velocidad:

Esto produce la velocidad más probable (modo) ![{textstyle v_{text{p}}=left[{frac {(n-1)kT}{m}}right]^{1/2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe3156873fe3af07e3ab412ca750885c7ea4d032) .
.
