Dimetil éter
Dimethyl ether ()DME; también conocido como metoximetano) es el compuesto orgánico con la fórmula CH3OCH3, (a veces ambiguo simplificado a C2H6O como es un isómero de etanol). El éter más simple, es un gas incoloro que es un precursor útil para otros compuestos orgánicos y un propulsor aerosol que se está demostrando actualmente para su uso en una variedad de aplicaciones de combustible.
El éter Dimethyl fue sintetizado por Jean-Baptiste Dumas y Eugene Péligot en 1835 por destilación de metanol y ácido sulfúrico.
Producción
En 1985 se produjeron aproximadamente 50.000 toneladas en Europa occidental mediante deshidratación de metanol:
- 2 CH3Oh →3)2O + H2O
El metanol requerido se obtiene del gas de síntesis (syngas). Otras posibles mejoras requieren un sistema de catalizador dual que permita tanto la síntesis como la deshidratación de metanol en la misma unidad de proceso, sin aislamiento ni purificación de metanol. Tanto los procesos de un paso como los de dos pasos anteriores están disponibles comercialmente. El proceso de dos pasos es relativamente simple y los costos iniciales son relativamente bajos. Se está desarrollando un proceso en fase líquida de un solo paso.
De biomasa
El dimetiléter es un biocombustible sintético de segunda generación (BioDME), que puede producirse a partir de biomasa lignocelulósica. La UE está considerando BioDME en su posible combinación de biocombustibles en 2030; También se puede producir a partir de biogás o metano procedente de desechos animales, alimentarios y agrícolas, o incluso de gas de esquisto o gas natural.
El Grupo Volvo es el coordinador del proyecto BioDME del Séptimo Programa Marco de la Comunidad Europea, donde la planta piloto BioDME de Chemrec se basa en la gasificación de licor negro en Piteå, Suecia.
Aplicaciones
El mayor uso del éter dimetílico es como materia prima para la producción del agente metilante, sulfato de dimetilo, que implica su reacción con trióxido de azufre:
- CH3OCH3 + SO3 →3)2SO4
El dimetil éter también se puede convertir en ácido acético mediante la tecnología de carbonilación relacionada con el proceso del ácido acético de Monsanto:
- (CH)3)2O + 2 CO + H2O → 2 CH3CO2H
Reactivo y disolvente de laboratorio
El dimetiléter es un disolvente y agente de extracción de baja temperatura, aplicable a procedimientos de laboratorio especializados. Su utilidad está limitada por su bajo punto de ebullición (-23 °C (-9 °F)), pero la misma propiedad facilita su eliminación de las mezclas de reacción. El dimetil éter es el precursor del útil agente alquilante, el tetrafluoroborato de trimetiloxonio.
Aplicaciones de nicho
En algunos "spray congelante" de venta libre se utiliza una mezcla de éter dimetílico y propano. Productos para tratar las verrugas, congelándolas. En esta función, ha suplantado a los compuestos halocarbonados (freón).
El éter de dimetil es también un componente de ciertas mezclas de gas de soplado "Map-Pro" de alta temperatura, suplantando el uso de mezclas de metil acetileno y propadieno.
El éter de dimetil también se utiliza como propelente en productos de aerosol. Tales productos incluyen spray de pelo, pulverización de fallos y algunos productos de pegamento de aerosol.
Research
Combustible

Un uso potencialmente importante del éter dimetílico es como sustituto del propano en el GLP utilizado como combustible en el hogar y la industria. El éter dimetílico también se puede utilizar como mezcla en autogás propano.
También es un combustible prometedor en motores diésel y turbinas de gas. Para los motores diésel, una ventaja es el elevado índice de cetano de 55, en comparación con el del combustible diésel procedente del petróleo, que es de 40 a 53. Sólo se necesitan modificaciones moderadas para convertir un motor diésel para que queme éter dimetílico. La simplicidad de este compuesto de cadena corta de carbono conduce durante la combustión a emisiones muy bajas de partículas. Por estas razones, además de no contener azufre, el dimetiléter cumple incluso con las regulaciones de emisiones más estrictas en Europa (EURO5), EE. UU. (EE. UU. 2010) y Japón (Japón 2009).
En el European Shell Eco Marathon, un campeonato mundial no oficial de kilometraje, un vehículo que funcionaba con 100 % dimetiléter recorrió 589 km/L (169,8 cm3/100 km), combustible equivalente a gasolina con un motor de 2 tiempos de 50 cm3 de cilindrada. Además de ganar, batieron el antiguo récord de 306 km/litro (326,8 cm3/100 km), establecido por el mismo equipo en 2007.
Para estudiar el éter dimetílico para el proceso de combustión se requiere un mecanismo cinético químico que pueda usarse para el cálculo de la dinámica de fluidos computacional.
Refrigerante
El éter dimetílico es un refrigerante con designación de refrigerante ASHRAE R-E170. También se utiliza en mezclas de refrigerantes con, p. amoniaco, dióxido de carbono, butano y propeno. El dimetil éter fue el primer refrigerante. En 1876, el ingeniero francés Charles Tellier compró al antiguo Elder-Dempster un carguero Eboe de 690 toneladas y le instaló una planta de refrigeración de éter metílico diseñada por él. El barco pasó a llamarse Le Frigorifique e importó con éxito un cargamento de carne refrigerada desde Argentina. Sin embargo, la maquinaria pudo mejorarse y en 1877 se puso en servicio otro barco frigorífico llamado Paraguay con una instalación frigorífica mejorada por Ferdinand Carré en la ruta sudamericana.
Seguridad
A diferencia de otros éteres alquílicos, el éter dimetílico resiste la autooxidación. El éter dimetílico tampoco es relativamente tóxico, aunque es muy inflamable. La explosión de BASF del 28 de julio de 1948 en Ludwigshafen fue causada por este complejo: murieron 200 personas y un tercio de la planta industrial quedó destruida.
Hoja de datos
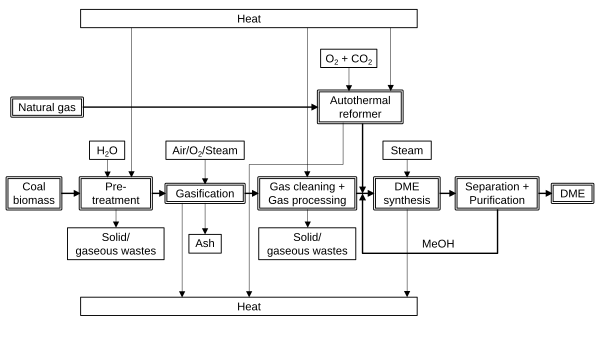
Rutas para producir dimetil éter
Presión de vapor
| Temperatura (K) | Presión (kPa) |
|---|---|
| 233.128 | 54.61 |
| 238.126 | 68.49 |
| 243.157 | 85.57 |
| 248.152 | 105.59 |
| 253.152 | 129.42 |
| 258.16 | 157.53 |
| 263.16 | 190.44 |
| 268.161 | 228.48 |
| 273.153 | 272.17 |
| 278.145 | 321.87 |
| 283.16 | 378.66 |
| 288.174 | 443.57 |
| 293.161 | 515.53 |
| 298.172 | 596.21 |
| 303.16 | 687.37 |
| 305.16 | 726.26 |
| 308.158 | 787.07 |
| 313.156 | 897.59 |
| 316.154 | 968.55 |
| 318.158 | 1018.91 |
| 323.148 | 1152.35 |
| 328.149 | 1298.23 |
| 333.157 | 1457,5 |
| 333.159 | 1457.76 |
| 338.154 | 1631.01 |
| 343.147 | 1818.8 |
| 348.147 | 2022.45 |
| 353.146 | 2242.74 |
| 353.158 | 2243.07 |
| 358.145 | 2479.92 |
| 363.148 | 2735.67 |
| 368.158 | 3010.81 |
| 373.154 | 3305.67 |
| 378.15 | 3622.6 |
| 383.143 | 3962.25 |
| 388.155 | 4331.48 |
| 393.158 | 4725.02 |
| 398.157 | 5146.82 |
| 400,378 | 5355.8 |
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar