Diastereoisómero
| Diasterómeros que también son epímeros | |
|---|---|
 |  |
 |  |
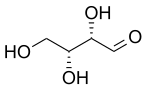
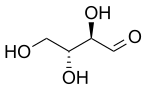
| D-Threose | D-Erythrose |
En estereoquímica, los diastereómeros (a veces llamados diastereoisómeros) son un tipo de estereoisómero. Los diastereómeros se definen como estereoisómeros no idénticos y sin imagen especular. Por lo tanto, ocurren cuando dos o más estereoisómeros de un compuesto tienen configuraciones diferentes en uno o más (pero no en todos) los estereocentros equivalentes (relacionados) y no son imágenes especulares entre sí. Cuando dos diastereoisómeros se diferencian entre sí en un solo estereocentro, se denominan epímeros. Cada estereocentro da lugar a dos configuraciones diferentes y, por tanto, normalmente aumenta el número de estereoisómeros en un factor de dos.
Los diastereómeros se diferencian de los enantiómeros en que estos últimos son pares de estereoisómeros que difieren en todos los estereocentros y, por lo tanto, son imágenes especulares entre sí. Los enantiómeros de un compuesto con más de un estereocentro también son diastereómeros de los otros estereoisómeros de ese compuesto que no son su imagen especular (es decir, excluyendo el enantiómero opuesto). Los diastereómeros tienen diferentes propiedades físicas (a diferencia de la mayoría de los aspectos de los enantiómeros) y, a menudo, diferente reactividad química.
Los diastereómeros difieren no solo en las propiedades físicas sino también en la reactividad química: cómo reacciona un compuesto con otros. La glucosa y la galactosa, por ejemplo, son diastereómeros. Aunque comparten el mismo peso molar, la glucosa es más estable que la galactosa. Esta diferencia de estabilidad hace que la galactosa se absorba ligeramente más rápido que la glucosa en el cuerpo humano.
Diastereoselectividad es la preferencia por la formación de uno o más de un diastereómero sobre el otro en una reacción orgánica. En general, la estereoselectividad se atribuye a interacciones estéricas y torsionales en el estereocentro que resultan de electrófilos que se acercan al estereocentro en reacción.
Sincronización/anti
Cuando el enlace simple entre los dos centros puede rotar libremente, los descriptores cis/trans dejan de ser válidos. Dos prefijos ampliamente aceptados que se utilizan para distinguir los diastereómeros en enlaces con hibridación sp³ en una molécula de cadena abierta son syn y anti. Masamune propuso descriptores que funcionan incluso si los grupos no están unidos a átomos de carbono adyacentes. También funciona independientemente de las prioridades del CIP. Syn describe grupos en la misma cara, mientras que anti describe grupos en caras opuestas. El concepto se aplica únicamente a la proyección en Zigzag. Los descriptores sólo describen la estereoquímica relativa en lugar de la estereoquímica absoluta. Todos los isómeros son iguales.
Eritro / treo
Dos prefijos más antiguos que todavía se utilizan comúnmente para distinguir los diastereómeros son treo y eritro. En el caso de los sacáridos, cuando se dibuja en la proyección de Fischer, el isómero eritro tiene dos sustituyentes idénticos en el mismo lado y el isómero treo los tiene en lados opuestos. Cuando se dibuja como una cadena en zig-zag, el isómero eritro tiene dos sustituyentes idénticos en diferentes lados del plano (anti). Los nombres se derivan de las aldosas diastereoméricas de cuatro carbonos eritrosa y treosa. No se recomienda el uso de estos prefijos fuera del ámbito de los sacáridos porque sus definiciones pueden dar lugar a interpretaciones contradictorias.
Otro compuesto treo es la treonina, uno de los aminoácidos esenciales. El diastereómero eritro se llama alotreonina.
  |
| L-Threonine (2)S,3R) y D-Threonine (2)R,3S) |
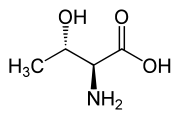 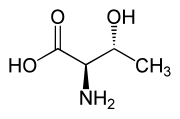 |
| L-Allothreonine (2S,3S) y D-Allothreonine (2R,3R) |
Múltiples estereocentros
Si una molécula contiene dos centros asimétricos, hay hasta cuatro configuraciones posibles y no todas pueden ser imágenes especulares no superponibles entre sí. Las posibilidades de diferentes isómeros continúan multiplicándose a medida que se añaden más estereocentros a una molécula. En general, el número de estereoisómeros de una molécula se puede determinar calculando 2n, donde n = el número de centros quirales en la molécula.. Esto es válido excepto en los casos en que la molécula tiene formas meso. Estos mesocompuestos son moléculas que contienen estereocentros, pero poseen un plano interno de simetría que les permite superponerse a su imagen especular. Estas configuraciones equivalentes no pueden considerarse diastereómeros.
Para n = 3, hay ocho estereoisómeros. Entre ellos, existen cuatro pares de enantiómeros: R,R,R y S,S,S; R,R,S y S,S,R; R,S,S y S,R,R; y R,S,R y S,R,S. Hay muchos más pares de diastereómeros, porque cada una de estas configuraciones es un diastereómero con respecto a cualquier otra configuración excluyendo su propio enantiómero (por ejemplo, R,R,R es un diastereómero de R,R,S; R,S,R; y R,S,S). Para n = 4, hay dieciséis estereoisómeros u ocho pares de enantiómeros. Los cuatro pares enantioméricos de aldopentosas y los ocho pares enantioméricos de aldohexosas (subconjuntos de azúcares de cinco y seis carbonos) son ejemplos de conjuntos de compuestos que difieren de esta manera.
Diastereomerismo en un doble enlace
Los isómeros de doble enlace siempre se consideran diastereómeros, no enantiómeros. La diastereomerización también puede ocurrir en un doble enlace, donde las posiciones relativas cis versus trans de los sustituyentes dan dos isómeros no superponibles. Muchos isómeros conformacionales también son diastereómeros.
En el caso de diastereomerismo que ocurre en un doble enlace, se utiliza E-Z, o entgegen y zusammen (alemán), para anotar la nomenclatura de los alquenos.
Aplicaciones
Como se indicó anteriormente, dos diastereómeros no tendrán propiedades químicas idénticas. Este conocimiento se aprovecha en la síntesis quiral para separar una mezcla de enantiómeros. Este es el principio detrás de la resolución quiral. Después de preparar los diastereómeros, se separan mediante cromatografía o recristalización. Obsérvese también el ejemplo de la estereoquímica de la cetonización de enoles y enolatos.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar