Daño al ADN por radicales libres
El daño de los radicales libres al ADN puede ocurrir como resultado de la exposición a la radiación ionizante oa los compuestos radiomiméticos. El daño al ADN como resultado del ataque de los radicales libres se denomina daño indirecto del ADN porque los radicales formados pueden difundirse por todo el cuerpo y afectar a otros órganos. El melanoma maligno puede ser causado por daño indirecto al ADN porque se encuentra en partes del cuerpo que no están expuestas a la luz solar. El ADN es vulnerable al ataque de los radicales debido a los hidrógenos muy lábiles que se pueden extraer y la prevalencia de dobles enlaces en las bases del ADN a las que los radicales pueden agregarse fácilmente.
Daños por exposición a la radiación
La radiólisis del agua intracelular por radiación ionizante crea peróxidos, que son precursores relativamente estables de los radicales hidroxilo. Entre el 60 % y el 70 % del daño del ADN celular es causado por los radicales hidroxilo; sin embargo, los radicales hidroxilo son tan reactivos que solo pueden difundir uno o dos diámetros moleculares antes de reaccionar con los componentes celulares. Por lo tanto, los radicales hidroxilo deben formarse inmediatamente adyacentes a los ácidos nucleicos para que reaccionen. La radiólisis del agua crea peróxidos que pueden actuar como formas latentes difusibles de radicales hidroxilo. Algunos iones metálicos en las cercanías del ADN generan los radicales hidroxilo a partir del peróxido.H 2 O + hν → H 2 O + eH 2 O + e → H 2 OH 2 O → H + OH ·H 2 O → OH + H ·2 OH · →H 2 O 2
Se cree que el daño de los radicales libres al ADN da como resultado mutaciones que pueden conducir a algunos tipos de cáncer.
La reacción de Fenton
La reacción de Fenton da como resultado la creación de radicales hidroxilo a partir de peróxido de hidrógeno y un catalizador de hierro (II). El hierro (III) se regenera mediante la reacción de Haber-Weiss. Los metales de transición con un sitio de coordinación libre son capaces de reducir los peróxidos a radicales hidroxilo. Se cree que el hierro es el metal responsable de la creación de radicales hidroxilo porque existe en la mayor concentración de cualquier metal de transición en la mayoría de los organismos vivos. La reacción de Fenton es posible porque los metales de transición pueden existir en más de un estado de oxidación y sus electrones de valencia pueden estar desapareados, lo que les permite participar en reacciones redox de un electrón.Fe + H 2 O 2 → Fe + OH · + OH
La creación de radicales hidroxilo por catálisis de hierro (II) es importante porque el hierro (II) se puede encontrar coordinado y, por lo tanto, muy cerca del ADN. Esta reacción permite que el peróxido de hidrógeno creado por la radiólisis del agua se difunda hacia el núcleo y reaccione con el hierro (II) para producir radicales hidroxilo, que a su vez reaccionan con el ADN. La ubicación y la unión del hierro (II) al ADN pueden desempeñar un papel importante en la determinación del sustrato y la naturaleza del ataque de los radicales al ADN. La reacción de Fenton genera dos tipos de oxidantes, Tipo I y Tipo II. Los oxidantes de tipo I son moderadamente sensibles a los peróxidos y al etanol. Los oxidantes de tipo I y tipo II se escinden preferentemente en las secuencias específicas.
Ataque de radicales hidroxilo
Los radicales hidroxilo pueden atacar el esqueleto y las bases del ADN de la desoxirribosa, causando potencialmente una gran cantidad de lesiones que pueden ser citotóxicas o mutagénicas. Las células han desarrollado mecanismos de reparación complejos y eficientes para reparar las lesiones. En el caso del ataque de radicales libres sobre el ADN, el mecanismo de reparación utilizado es la reparación por escisión de bases. Las reacciones de radicales hidroxilo con el esqueleto de azúcar desoxirribosa se inician mediante la extracción de hidrógeno de un carbono de desoxirribosa, y la consecuencia predominante es la ruptura final de la cadena y la liberación de bases. El radical hidroxilo reacciona con los diversos átomos de hidrógeno de la desoxirribosa en el orden 5′ H > 4′ H > 3′ H ≈ 2′ H ≈ 1′ H. Este orden de reactividad es paralelo a la exposición al disolvente de los hidrógenos de la desoxirribosa.
Los radicales hidroxilo reaccionan con las bases del ADN mediante la adición a los enlaces pi ricos en electrones. Estos enlaces pi en las bases se encuentran entre C5-C6 de pirimidinas y N7-C8 en purinas. Tras la adición del radical hidroxilo, se pueden formar muchos productos estables. En general, los ataques de radicales hidroxilo sobre los restos básicos no provocan azúcares alterados ni roturas de cadenas, excepto cuando las modificaciones estabilizan el enlace N-glicosilo, lo que permite la formación de sitios sin base que están sujetos a eliminación beta.
Sitios básicos
La extracción de hidrógeno del carbono 1'-desoxirribosa por el radical hidroxilo crea un radical 1'-desoxirribosilo. Luego, el radical puede reaccionar con el oxígeno molecular, creando un radical peroxilo que puede reducirse y deshidratarse para producir una 2'-desoxirribonolactona y una base libre. Una desoxirribonolactona es mutagénica y resistente a las enzimas reparadoras. Así, se crea un sitio básico.
Daño radical por compuestos radiomiméticos
El daño radical al ADN también puede ocurrir a través de la interacción del ADN con ciertos productos naturales conocidos como compuestos radiomiméticos, compuestos moleculares que afectan al ADN de manera similar a la exposición a la radiación. Los compuestos radiomiméticos inducen roturas de doble cadena en el ADN a través de ataques de radicales libres concertados y altamente específicos en los restos de desoxirribosa en ambas cadenas de ADN.
Mecanismo general
Muchos compuestos radiomiméticos son enediinos, que se someten a la reacción de ciclación de Bergman para producir un dirradical 1,4-didehidrobenceno. El dirradical 1,4-didehidrobenceno es altamente reactivo y extraerá hidrógenos de cualquier posible donante de hidrógeno.
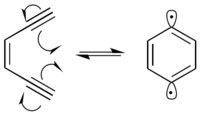
En presencia de ADN, el dirradical 1,4-didehidrobenceno extrae hidrógenos del esqueleto de azúcar desoxirribosa, predominantemente en las posiciones C-1', C-4' y C-5'. La extracción de hidrógeno provoca la formación de radicales en el carbono reaccionado. El radical de carbono reacciona con el oxígeno molecular, lo que conduce a una ruptura de la hebra en el ADN a través de una variedad de mecanismos. El 1,4-didehidrobenceno puede posicionarse de tal manera que puede extraer hidrógenos proximales de ambas cadenas de ADN. Esto produce una ruptura de doble cadena en el ADN, que puede conducir a la apoptosis celular si no se repara.

Enediynes generalmente se someten a la ciclación de Bergman a temperaturas superiores a 200 ° C. Sin embargo, la incorporación de la enedina en un hidrocarburo cíclico de 10 miembros hace que la reacción sea termodinámicamente más favorable al liberar la tensión del anillo de los reactivos. Esto permite que la ciclación de Bergman ocurra a 37 °C, la temperatura biológica de los humanos. Se ha descubierto que las moléculas que incorporan enediinas en estas estructuras de anillo más grandes son extremadamente citotóxicas.
Productos naturales
Enediynes están presentes en muchos productos naturales complicados. Fueron descubiertos originalmente a principios de la década de 1980 durante la búsqueda de nuevos productos contra el cáncer producidos por microorganismos. La caliqueamicina fue uno de los primeros productos identificados y se encontró originalmente en una muestra de suelo tomada de Kerrville, Texas. Estos compuestos son sintetizados por las bacterias como mecanismos de defensa debido a su capacidad para escindir el ADN mediante la formación de 1,4-didehidrobenceno a partir del componente enediino de la molécula.

La caliqueamicina y otros compuestos relacionados comparten varias características comunes. Las estructuras extendidas unidas a la enediina permiten que el compuesto se una específicamente al ADN, en la mayoría de los casos al surco menor de la doble hélice. Además, parte de la molécula se conoce como el “disparador” que, en condiciones fisiológicas específicas, activa la enedina, conocida como la “ojiva” y se genera 1,4-didehidrobenceno.
Desde entonces, se han identificado tres clases de enediinas: caliqueamicina, dinemicina y productos basados en cromoproteínas.
Los tipos de caliqueamicina se definen por un grupo trisulfuro de metilo que participa en la activación de la molécula mediante el siguiente mecanismo.

La caliqueamicina y la esperamicina estrechamente relacionada se han utilizado como fármacos contra el cáncer debido a su alta toxicidad y especificidad.
La dinemicina y sus parientes se caracterizan por la presencia de un núcleo de antraquinona y enedina. El componente de antraquinona permite la unión específica del ADN en el lado 3' de las bases de purina a través de la intercalación, un sitio que es diferente de la caliqueamicina. Su capacidad para escindir el ADN aumenta considerablemente en presencia de NADPH y compuestos de tiol. Este compuesto también ha encontrado prominencia como agente antitumoral.

Los enedinos cromoproteicos se caracterizan por un enedino cromóforo inestable unido a una apoproteína.

El cromóforo no reacciona cuando se une a la apoproteína. Tras su liberación, reacciona para formar 1,4-didehidrobenceno y posteriormente escinde el ADN.
Capacidad antitumoral
La mayoría de las enedinas, incluidas las enumeradas anteriormente, se han utilizado como potentes antibióticos antitumorales debido a su capacidad para escindir el ADN de manera eficaz. La caliqueamicina y la esperamicina son los dos tipos más utilizados debido a su alta especificidad al unirse al ADN, lo que minimiza las reacciones secundarias desfavorables. Se ha demostrado que son especialmente útiles para tratar la leucemia mieloide aguda.
Además, la caliqueamicina es capaz de escindir el ADN a bajas concentraciones, demostrando ser hasta 1000 veces más eficaz que la adriamicina para combatir ciertos tipos de tumores. En todos los casos, las células carecen de la capacidad de reparar roturas de ADN de doble cadena, lo que hace que estos compuestos sean especialmente efectivos para tratar células tumorales.
El mecanismo de radicales libres para tratar ciertos tipos de cáncer se extiende más allá de los enediynes. La tirapazamina genera un radical libre en condiciones anóxicas en lugar del mecanismo desencadenante de una enedina. Luego, el radical libre continúa escindiendo el ADN de manera similar al 1,4-didehidrobenceno para tratar las células cancerosas. Actualmente se encuentra en ensayos de fase III.
Contenido relacionado
Alimentos transgénicos
Haplogrupo
Edición de genes CRISPR