Cuprato
Cupados son una clase de compuestos que contienen cobre (Cu). Pueden clasificarse ampliamente en dos tipos principales:
1. Curatos Inorgánicos: Son compuestos no estequiométricos con una fórmula general de XYCu
mO
n. Muchos de estos compuestos son conocidos por sus propiedades superconductoras. Un ejemplo de cuprato inorgánico es el tetracloridocuprato ([CuCl4]2−), un complejo de coordinación aniónico que presenta un ion cobre rodeado por cuatro iones cloruro.
2. Curatos Orgánicos: Son compuestos organocobres con una fórmula general de R2Cu. Estos compuestos, caracterizados por el cobre unido a grupos orgánicos, se utilizan frecuentemente en síntesis orgánica debido a su reactividad. Un ejemplo de cuprato orgánico es cuprato de dimetilo [Cu(CH3)2]−.
Uno de los cupratos más estudiados es el YBa2Cu 3O7, un material superconductor de alta temperatura. Este óxido cuprato ha sido objeto de extensas investigaciones debido a su capacidad para conducir electricidad sin resistencia a temperaturas relativamente altas.
El término 'cuprate' Tiene su origen en 'cuprum', la palabra latina para cobre. Se utiliza principalmente en el contexto de materiales de óxido, complejos de coordinación aniónicos y compuestos orgánicos de cobre aniónicos, lo que refleja las diversas funciones del cobre en la química. El término se utiliza principalmente en tres contextos: materiales de óxido, complejos de coordinación aniónicos y compuestos orgánicos de cobre aniónicos.
Óxidos
Uno de los vasos más simples de óxido es el óxido de cobre(III) KCuO2, también conocido como "potassium cuprate(III)". Esta especie se puede ver como la K+ sal del polianión [CuO−
2]n. Como tal, el material se clasifica como un cuprate. Este sólido diamagnético azul oscuro se produce por peróxido de potasio y cobre(II) en un ambiente de oxígeno:
- K2O2 + 2 CuO → 2 KCuO2
se conocen otras cuprecias (iii) de metales alcalinos; Además, las estructuras de Kcuo 2 , RBCUO 2 y CSCUO 2 también se han determinado.
kcuo 2 fue descubierto primero en 1952 por V. K. Wahl y W. Klemm, sintetizaron este compuesto calentando el óxido de cobre (II) y el superóxido de potasio en una atmósfera de oxígeno.
- 2KO2 + 2CuO → KCuO2 + O2
También se puede sintetizar calentando superóxido de potasio y polvo de cobre:
- KO2 + Cu → KCuO2
KCuO2 reacciona con el aire bastante lentamente. Empieza a descomponerse a 760K y su color cambia de azul a verde pálido a 975K. Su punto de fusión es 1025K.
RbCuO2 (azul-negro) y CsCuO2 (negro) se pueden preparar mediante la reacción de óxido de rubidio y óxido de cesio con polvos de óxido de cobre (II), a 675 K y 655 K en atmósfera de oxígeno, respectivamente. Cualquiera de ellos reacciona rápidamente con el aire, a diferencia del KCuO2.
De hecho, KCuO2 es un compuesto no estequiométrico, por lo que la fórmula más exacta es KCuOx y x está muy cerca de 2. Esto provoca la formación de defectos en la estructura cristalina, y esto conduce a la tendencia de este compuesto a reducirse.
El cuprato de sodio (III) NaCuO2 se puede producir utilizando hipocloritos o hipobromitos para oxidar el hidróxido de cobre en condiciones alcalinas y de baja temperatura.
- 2NaOH + CuSO4 → Cu(OH)2 ↓
- Cu2 + 2NaOH + NaClO → 2NaCuO2 + NaCl + H
2O
Los cupratos (III) no son estables en el agua y también pueden oxidarla.
- 4CuO−
2 + 2H
2O → 4CuO + O
2 ↑ + 4Oh.−
El cuprato de sodio (III) es de color marrón rojizo, pero se vuelve negro gradualmente a medida que se descompone en óxido de cobre (II). Para evitar su descomposición se debe preparar a baja temperatura y en ausencia de luz.
Complejos de coordinación
El cobre forma muchos complejos de coordinación aniónicos con ligandos cargados negativamente como cianuro, hidróxido y haluros, así como alquilos y arilos.
Cobre(I)
Los cupratos que contienen cobre(I) tienden a ser incoloros, lo que refleja su configuración d10. Las estructuras varían desde lineales de 2 coordenadas, planas trigonales y tetraédricas. Los ejemplos incluyen dicloro y triclorocupratos, es decir, [CuCl2]− lineal y [CuCl3]2−. El cianuro produce complejos análogos, pero también el tetracianocuprato(I) trianiónico, [Cu(CN)4]3−. El dicianocuprato (I) existe en motivos moleculares o poliméricos, según el contracatión.
Cobre(II)
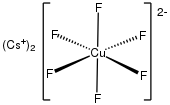
Los clorocupratos incluyen triclorocuprato(II) [CuCl3]-, que es un tetraclorocuprato(II) dimérico, cuadrado y plano [CuCl4]2−, y pentaclorocuprato(II) [CuCl5]3−. Los complejos de clorocuprato (II) de 3 coordenadas son raros.
Los complejos de tetraclorocuprato (II) tienden a adoptar una geometría tetraédrica aplanada con colores naranja.
El tetrahidroxicuprato de sodio (Na2[Cu(OH)4]) es un ejemplo de un complejo de hidróxido homoléptico (todos los ligandos son iguales).
- Cu2 + 2 NaOH → Na2Cu4
Cobre(III) y cobre(IV)
Hexafluorocuprate(III) [CuF6]3 - 3 and hexafluorocuprate(IV) [CuF6]2 - 2 son ejemplos raros de complejos de cobre(III) y cobre(IV). Son agentes oxidantes fuertes.
Cupos orgánicos
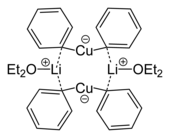
Los cuprates tienen un papel en la síntesis orgánica. Son invariablemente Cu(I), aunque Cu(II) o incluso Cu(III) intermediarios se invocan en algunos mecanismos. Los vasos orgánicos suelen tener las fórmulas idealizadas [CuR2]− [CuR3]2 - 2, donde R es un alquilo o aryl. Estos reactivos encuentran uso como reactivos alquilativos nucleófilos.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar