Compuesto aromático
Los compuestos aromáticos son compuestos orgánicos también conocidos como "hidrocarburos aromáticos mono y policíclicos". El miembro principal es el benceno. Los heteroarenos están estrechamente relacionados, ya que al menos un átomo de carbono del grupo CH se reemplaza por uno de los heteroátomos de oxígeno, nitrógeno o azufre. Ejemplos de compuestos diferentes al benceno con propiedades aromáticas son el furano, un compuesto heterocíclico con un anillo de cinco miembros que incluye un solo átomo de oxígeno, y la piridina, un compuesto heterocíclico con un anillo de seis miembros que contiene un átomo de nitrógeno.
Modelo de anillo de benceno
El benceno, 
Otras representaciones de la estructura representan el hexágono con un círculo dentro, para indicar que los seis electrones están flotando en orbitales moleculares deslocalizados del tamaño del anillo mismo. Esto representa la naturaleza equivalente de los seis enlaces carbono-carbono, todos de orden de enlace 1,5; la equivalencia se explica por formas de resonancia. Los electrones se visualizan flotando por encima y por debajo del anillo, y los campos electromagnéticos que generan actúan para mantener el anillo plano.
Propiedades generales de los hidrocarburos aromáticos:
- Muestran aromaticidad
- La relación carbono-hidrógeno es alta.
- Arden con una fuerte llama de color amarillo hollín debido a la alta relación carbono-hidrógeno.
- Sufren reacciones de sustitución electrofílica y sustituciones aromáticas nucleofílicas.
El símbolo del círculo para la aromaticidad fue introducido por Sir Robert Robinson y su alumno James Armit en 1925 y popularizado a partir de 1959 por el libro de texto de Morrison & Boyd sobre química orgánica. Se debate el uso adecuado del símbolo: algunas publicaciones lo usan para cualquier sistema π cíclico, mientras que otras lo usan solo para aquellos sistemas π que obedecen la regla de Hückel. Jensen argumenta que, de acuerdo con la propuesta original de Robinson, el uso del símbolo del círculo debe limitarse a sistemas monocíclicos de 6 electrones π. De esta manera, el símbolo del círculo para un enlace de seis electrones de seis centros se puede comparar con el símbolo Y para un enlace de dos electrones de tres centros.
Reacciones
Los sistemas de anillos aromáticos participan en muchas reacciones orgánicas.
Sustitución aromática
En la sustitución aromática, un sustituyente del anillo areno, generalmente hidrógeno, se reemplaza por otro sustituyente. Los dos tipos principales son la sustitución aromática electrófila cuando el reactivo activo es un electrófilo y la sustitución aromática nucleófila cuando el reactivo es un nucleófilo. En la sustitución radical nucleófila aromática el reactivo activo es un radical. Un ejemplo de sustitución aromática electrófila es la nitración del ácido salicílico:
Reacciones de acoplamiento
En las reacciones de acoplamiento, un metal cataliza un acoplamiento entre dos fragmentos radicales formales. Las reacciones de acoplamiento comunes con arenos dan como resultado la formación de nuevos enlaces carbono-carbono, por ejemplo, alquilarenos, vinil arenos, birarilos, nuevos enlaces carbono-nitrógeno (anilinas) o nuevos enlaces carbono-oxígeno (ariloxicompuestos). Un ejemplo es la arilación directa de perfluorobencenos.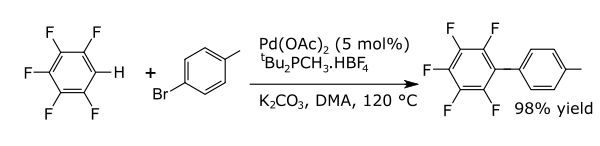
Hidrogenación
La hidrogenación de arenos crea anillos saturados. El compuesto 1-naftol se reduce completamente a una mezcla de isómeros de decalin-ol.
El compuesto resorcinol, hidrogenado con níquel Raney en presencia de hidróxido de sodio acuoso forma un enolato que se alquila con yoduro de metilo a 2-metil-1,3-ciclohexanodiona:
Cicloadiciones
Las reacciones de cicloadición no son comunes. La reactividad térmica inusual de Diels-Alder de los arenos se puede encontrar en la reacción de Wagner-Jauregg. Otras reacciones fotoquímicas de cicloadición con alquenos ocurren a través de excímeros.
Desaromatización
En las reacciones de desaromatización, la aromaticidad del reactivo se pierde permanentemente.
Benceno y derivados del benceno
Los derivados del benceno tienen de uno a seis sustituyentes unidos al núcleo central de benceno. Ejemplos de compuestos de benceno con un solo sustituyente son el fenol, que lleva un grupo hidroxilo, y el tolueno con un grupo metilo. Cuando hay más de un sustituyente presente en el anillo, su relación espacial se vuelve importante para lo cual se diseñan los patrones de sustitución de arenos orto, meta y para. Por ejemplo, existen tres isómeros para el cresol porque el grupo metilo y el grupo hidroxilo se pueden colocar uno al lado del otro (orto), en una posición separada (meta), o en dos posiciones separadas (párr.). El xilenol tiene dos grupos metilo además del grupo hidroxilo y, para esta estructura, existen 6 isómeros.
- compuestos de areno representativos
 tolueno
tolueno Etilbencina
Etilbencina p -Xileno
p -Xileno m -Xileno
m -Xileno mesitileno
mesitileno Durene
Durene 2-fenilhexano
2-fenilhexano Bifenilo
Bifenilo Fenol
Fenol Anilina
Anilina Nitrobenceno
Nitrobenceno Ácido benzoico
Ácido benzoico Aspirina
Aspirina Paracetamol
Paracetamol Ácido pícrico
Ácido pícrico
El anillo areno tiene la capacidad de estabilizar las cargas. Esto se ve, por ejemplo, en el fenol (C 6 H 5 -OH), que es ácido en el hidroxilo (OH), ya que una carga de este oxígeno (alcóxido -O) está parcialmente deslocalizada en el anillo de benceno.
Otros hidrocarburos aromáticos monocíclicos
Otros hidrocarburos aromáticos monocíclicos incluyen ciclotetradecaheptaeno o ciclooctadecanonaeno.
Hidrocarburos aromáticos policíclicos
Los hidrocarburos aromáticos polinucleares (HAP) son hidrocarburos aromáticos que consisten en anillos aromáticos fusionados y no contienen heteroátomos ni llevan sustituyentes. La naftalina es el ejemplo más simple de PAH. Los HAP se encuentran en depósitos de petróleo, carbón y alquitrán, y se producen como subproductos de la quema de combustibles (ya sea combustibles fósiles o biomasa). Como contaminantes, son motivo de preocupación porque algunos compuestos han sido identificados como cancerígenos, mutagénicos y teratogénicos. Los PAH también se encuentran en los alimentos cocinados. Los estudios han demostrado que se encuentran altos niveles de HAP, por ejemplo, en la carne cocinada a altas temperaturas, como a la parrilla o a la parrilla, y en el pescado ahumado.
También se encuentran en el medio interestelar, en cometas y meteoritos y son una molécula candidata para actuar como base de las primeras formas de vida. En el grafeno, el motivo PAH se extiende a grandes láminas 2D.
Contenido relacionado
Espectroscopia de transformada de Fourier
Participación de grupos vecinos
Sustitución aromática electrófila