Coenzima Q – citocromo c reductasa
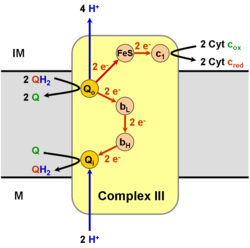
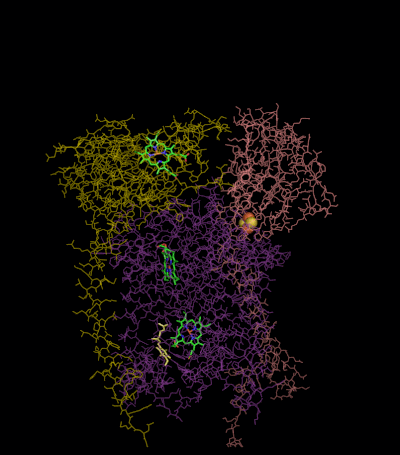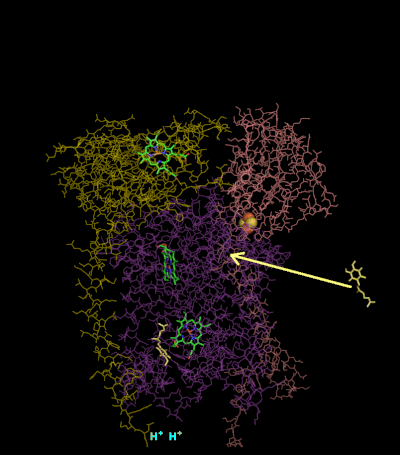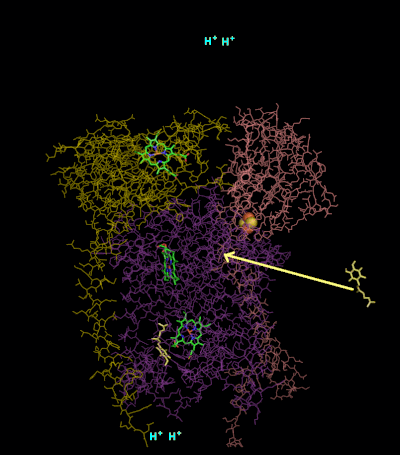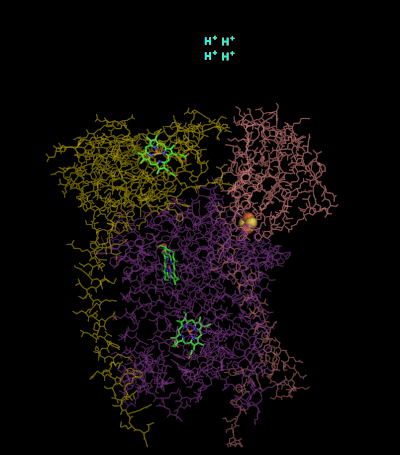
La coenzima Q: citocromo c - oxidorreductasa, a veces denominada complejo citocromo bc1 , y en otras ocasiones el complejo III, es el tercer complejo en la cadena de transporte de electrones (EC 1.10.2.2), y desempeña un papel fundamental en la generación bioquímica de ATP (fosforilación oxidativa). El complejo III es una proteína transmembrana de múltiples subunidades codificada por los genomas mitocondrial (citocromo b) y nuclear (todas las demás subunidades). El complejo III está presente en las mitocondrias de todos los animales y todos los eucariotas aeróbicos y en las membranas internas de la mayoría de las eubacterias. Las mutaciones en el Complejo III causan intolerancia al ejercicio, así como trastornos multisistémicos. El complejo bc1 contiene 11 subunidades, 3 subunidades respiratorias (citocromo B, citocromo C1, proteína Rieske), 2 proteínas centrales y 6 proteínas de bajo peso molecular.
Ubiquinol: la citocromo-c reductasa cataliza la reacción química
- QH2 + 2 ferricytochrome c ⇌ ⇌ {displaystyle rightleftharpoons } Q + 2 ferrocitocromo c + 2 H+
Así, los dos sustratos de esta enzima son el quinol (QH2) y el ferri- (Fe3+) citocromo c, mientras que sus 3 productos son la quinona (Q), ferro- (Fe2+) citocromo c y H+.
Esta enzima pertenece a la familia de las oxidorreductasas, concretamente las que actúan sobre los difenoles y sustancias afines como donante con un citocromo como aceptor. Esta enzima participa en la fosforilación oxidativa. Tiene cuatro cofactores: citocromo c1, citocromo b-562, citocromo b-566 y una ferrioxina de hierro 2 del tipo Rieske.
Nomenclatura
El nombre sistemático de esta clase de enzimas es ubiquinol:ferricitocromo-c oxidorreductasa. Otros nombres de uso común incluyen:
|
|
Estructura
En comparación con las otras subunidades principales de bombeo de protones de la cadena de transporte de electrones, la cantidad de subunidades encontradas puede ser pequeña, tan pequeña como tres cadenas polipeptídicas. Este número aumenta y se encuentran once subunidades en animales superiores. Tres subunidades tienen grupos protésicos. La subunidad del citocromo b tiene dos hemos de tipo b (bL y bH), la subunidad del citocromo c tiene un hemo de tipo c (c1), y la subunidad de la proteína de azufre de hierro (ISP) de Rieske tiene dos hierros, dos azufres de hierro- clúster de azufre (2Fe•2S).
Estructuras del complejo III: PDB: 1KYO, PDB: 1L0L
Composición del complejo
En los vertebrados, el complejo bc1, o Complejo III, contiene 11 subunidades: 3 subunidades respiratorias, 2 proteínas centrales y 6 proteínas de bajo peso molecular. Los complejos proteobacterianos pueden contener tan solo tres subunidades.
Tabla de composición de subunidades del complejo III
| No. | Nombre de subunidad | Proteína humana | Descripción de proteínas de UniProt | Familia Pfam con proteína humana |
|---|---|---|---|---|
| Proteínas de subunidad respiratoria | ||||
| 1 | MT-CYB / Cyt b | CYB_HUMAN | Cytochrome b | Pfam PF13631 |
| 2 | CYC1 / Cit c1 | CY1_HUMAN | Cytochrome c1, heme protein, mitocondrial | Pfam PF02167 |
| 3 | Rieske / UCR1 | UCRI_HUMAN | Cytochrome b-c1 complejo subunidad Rieske, mitocondrial EC 1.10.2 | Pfam PF02921 Pfam PF00355 |
| Subunidades de proteínas básicas | ||||
| 4 | QCR1 / SU1 | QCR1_HUMAN | Cytochrome b-c1 complejo subunidad 1, mitocondrial | Pfam PF00675, Pfam PF05193 |
| 5 | QCR2 / SU2 | QCR2_HUMAN | Cytochrome b-c1 complejo subunidad 2, mitocondrial | Pfam PF00675, Pfam PF05193 |
| Subunidades de proteína de bajo peso molecular | ||||
| 6 | QCR6 / SU6 | QCR6_HUMAN | Citocromo B-c1 complejo subunidad 6, mitocondrial | Pfam PF02320 |
| 7 | QCR7 / SU7 | QCR7_HUMAN | Subunidad compleja de citocromo b-c1 7 | Pfam PF02271 |
| 8 | QCR8 / SU8 | QCR8_HUMAN | Subunidad compleja de citocromo b-c1 8 | Pfam PF02939 |
| 9 | QCR9 / SU9 / UCRC | QCR9_HUMANa | Subunidad compleja de citocromo b-c1 9 | Pfam PF09165 |
| 10 | QCR10 / SU10 | QCR10_HUMAN | Subunidad compleja de citocromo b-c1 10 | Pfam PF05365 |
| 11 | QCR11 / SU11 | QCR11_HUMAN | Subunidad compleja de citocromo b-c1 11 | Pfam PF08997 |
- a En los vertebrados se conserva en el complejo un producto de 8 kDa de la proteína N-terminus de Rieske (péptido de señal) como subunidad 9. Así, las subunidades 10 y 11 corresponden a pCR9p hongos y QCR10p.
Reacción
Cataliza la reducción del citocromo c por oxidación de la coenzima Q (CoQ) y el bombeo concomitante de 4 protones desde la matriz mitocondrial al espacio intermembrana:
- QH2 + 2 citocromo c (Fe)III) + 2 H+
dentro → Q + 2 citocromo c (Fe)II) + 4 H+
Fuera.
En el proceso llamado ciclo Q, se consumen dos protones de la matriz (M), se liberan cuatro protones en el espacio intermembrana (IM) y se pasan dos electrones al citocromo c.
Mecanismo de reacción
El mecanismo de reacción del complejo III (citocromo bc1, coenzima Q: citocromo C oxidorreductasa) se conoce como ciclo de la ubiquinona ("Q"). En este ciclo, se liberan cuatro protones en el polo positivo "P" lado (espacio entre membranas), pero solo se toman dos protones del negativo "N" lado (matriz). Como resultado, se forma un gradiente de protones a través de la membrana. En la reacción general, dos ubiquinoles se oxidan a ubiquinonas y una ubiquinona se reduce a ubiquinol. En el mecanismo completo, se transfieren dos electrones del ubiquinol a la ubiquinona, a través de dos intermediarios del citocromo c.
General:
- 2 x QH2 óxidos a Q
- 1 x Q Reducción a QH2
- 2 x Cyt c Reducción
- 4 x H+ liberado en espacio intermembrano
- 2 x H+ recogido de la matriz
La reacción procede de acuerdo con los siguientes pasos:
Ronda 1:
- Cytochrome b une un ubiquinol y una ubiquinona.
- El centro 2Fe/2S y BL heme each pull an electron off the bound ubiquinol, releasing two protons into the intermembrane space.
- Un electrón se transfiere a citocromo c1 del centro 2Fe/2S, mientras que otro es transferido del BL heme to the BH Heme.
- Cytochrome c1 transfiere su electron a citocromo c (para no confundirse con citocromo c1), y el BH Heme transfiere su electron a una ubiquinona cercana, dando lugar a la formación de una ubisemiquinona.
- Citocromo c difusores. El primer ubiquinol (ahora oxidado a la ubiquinona) es liberado, mientras que la semiquinona permanece atada.
Ronda 2:
- Un segundo ubiquinol está ligado por el citocromo b.
- El centro 2Fe/2S y BL heme each pull an electron off the bound ubiquinol, releasing two protons into the intermembrane space.
- Un electrón se transfiere a citocromo c1 del centro 2Fe/2S, mientras que otro es transferido del BL heme to the BH Heme.
- Cytochrome c1 entonces transfiere su electron a cytochrome c, mientras que la semiquinona cercana producida de la vuelta 1 recoge un segundo electron de la BH Heme, junto con dos protones de la matriz.
- El segundo ubiquinol (ahora oxidado a la ubiquinona), junto con el recién formado ubiquinol son liberados.
Inhibidores del complejo III
Hay tres grupos distintos de inhibidores del Complejo III.
- Antimicina A se une a la Qi sitio e inhibe la transferencia de electrones en Complejo III de heme bH a Q oxidado (inhibidor del sitio Qi).
- Mixothiazol y estigmatización se unen a la Qo sitio e inhibe la transferencia de electrones de QH reducido2 a la proteína de azufre Rieske Iron. Myxothiazol y estigmatellina se unen a bolsillos distintos pero superpuestos dentro de la Qo sitio.
- Myxothiazol se une más cerca de la citocroma bL (de ahí denominado inhibidor "proximal").
- Stigmatellin se une más lejos del heme bL y más cerca de la proteína de azufre Rieske Iron, con la que interactúa fuertemente.
Algunos se han comercializado como fungicidas (los derivados de la estrobilurina, el más conocido de los cuales es la azoxistrobina; inhibidores de QoI) y como agentes contra la malaria (atovacuona).
También la propilhexedrina inhibe la citocromo c reductasa.
Radicales libres de oxígeno
Una pequeña fracción de electrones abandona la cadena de transporte de electrones antes de llegar al complejo IV. La fuga prematura de electrones al oxígeno da como resultado la formación de superóxido. La relevancia de esta reacción secundaria, por lo demás menor, es que el superóxido y otras especies reactivas del oxígeno son altamente tóxicas y se cree que desempeñan un papel en varias patologías, así como en el envejecimiento (la teoría de los radicales libres del envejecimiento). La fuga de electrones ocurre principalmente en el sitio Qo y es estimulada por la antimicina A. La antimicina A bloquea los hemos b en el estado reducido evitando su reoxidación en el Qi, que, a su vez, hace que aumenten las concentraciones en estado estacionario de la semiquinona Qo, esta última especie reacciona con el oxígeno para formar superóxido. Se cree que el efecto del alto potencial de membrana tiene un efecto similar. El superóxido producido en el sitio Qo puede liberarse tanto en la matriz mitocondrial como en el espacio intermembrana, donde puede llegar al citosol. Esto podría explicarse por el hecho de que el Complejo III podría producir superóxido como HOO• permeable a la membrana en lugar de O−.2 impermeable a la membrana.
Nombres de genes humanos
MT-CYB: citocromo b codificado por mtDNA; mutaciones asociadas con la intolerancia al ejercicio
CYC1: citocromo c1
CYCS: citocromo c
UQCRFS1: proteína de azufre de hierro de Rieske
UQCRB: proteína de unión a ubiquinona, mutación relacionada con la deficiencia del complejo mitocondrial III tipo nuclear 3
UQCRH: proteína bisagra
UQCRC2: Núcleo 2, mutaciones relacionadas con la deficiencia del complejo mitocondrial III, tipo nuclear 5
UQCRC1: Núcleo 1
UQCR: subunidad 6.4KD
UQCR10: subunidad 7.2KD
TTC19: subunidad recién identificada, mutaciones vinculadas a la deficiencia del complejo III nuclear tipo 2.
Mutaciones en genes del complejo III en enfermedades humanas
Las mutaciones en los genes relacionados con el complejo III generalmente se manifiestan como intolerancia al ejercicio. Se ha informado que otras mutaciones causan displasia septo-óptica y trastornos multisistémicos. Sin embargo, las mutaciones en BCS1L, un gen responsable de la maduración adecuada del complejo III, pueden provocar el síndrome de Björnstad y el síndrome GRACILE, que en los recién nacidos son enfermedades letales que tienen manifestaciones multisistémicas y neurológicas que tipifican trastornos mitocondriales graves. La patogenicidad de varias mutaciones se ha verificado en sistemas modelo como la levadura.
Actualmente se desconoce hasta qué punto estas diversas patologías se deben a deficiencias bioenergéticas o sobreproducción de superóxido.
Imágenes adicionales
Contenido relacionado
Unión cooperativa
Marsopa
Rana