Cloruro
El ion cloruro es el anión (ion con carga negativa) Cl. Se forma cuando el elemento cloro (un halógeno) gana un electrón o cuando un compuesto como el cloruro de hidrógeno se disuelve en agua u otros solventes polares. Las sales de cloruro, como el cloruro de sodio, suelen ser muy solubles en agua. Es un electrolito esencial ubicado en todos los fluidos corporales responsable de mantener el equilibrio ácido/base, transmitir los impulsos nerviosos y regular el flujo de líquido dentro y fuera de las células. Con menos frecuencia, la palabra clorurotambién puede formar parte del nombre "común" de compuestos químicos en los que uno o más átomos de cloro están unidos covalentemente. Por ejemplo, el cloruro de metilo, con el nombre estándar de clorometano (consulte los libros de la IUPAC) es un compuesto orgánico con un enlace C−Cl covalente en el que el cloro no es un anión.
Propiedades electrónicas
Un ion de cloruro (diámetro 167 pm) es mucho más grande que un átomo de cloro (diámetro 99 pm). Esto se debe a que el anión cloruro tiene 1 electrón más que el átomo de cloro, lo que reduce la retención del núcleo en la capa de valencia. El ion es incoloro y diamagnético. En solución acuosa, es altamente soluble en la mayoría de los casos; sin embargo, algunas sales de cloruro, como el cloruro de plata, el cloruro de plomo (II) y el cloruro de mercurio (I), solo son ligeramente solubles en agua. En solución acuosa, el cloruro se une al extremo prótico de las moléculas de agua.
Reacciones de cloruro
El cloruro se puede oxidar pero no reducir. La primera oxidación, como se emplea en el proceso de cloro-álcali, es la conversión a cloro gaseoso. El cloro puede oxidarse aún más a otros óxidos y oxianiones, incluido el hipoclorito (ClO, el ingrediente activo del blanqueador con cloro), dióxido de cloro (ClO 2), clorato (ClO3), y perclorato (ClO4).
En términos de sus propiedades ácido-base, el cloruro es una base débil como lo indica el valor negativo de p K a del ácido clorhídrico. El cloruro puede ser protonado por ácidos fuertes, como el ácido sulfúrico:NaCl + H2SO4 → NaHSO4 + HCl
Las sales de cloruro iónico reaccionan con otras sales para intercambiar aniones. La presencia de iones de haluro como el cloruro se puede detectar usando nitrato de plata. Una solución que contiene iones de cloruro producirá un precipitado de cloruro de plata blanco:Cl + Ag → AgCl
La concentración de cloruro en un ensayo se puede determinar usando un cloridómetro, que detecta los iones de plata una vez que todo el cloruro en el ensayo ha precipitado a través de esta reacción.
Los electrodos de plata clorada se usan comúnmente en electrofisiología ex vivo.
Otros oxianiones
El cloro puede asumir estados de oxidación de -1, +1, +3, +5 o +7. También se conocen varios óxidos de cloro neutros.
| Estado de oxidación del cloro | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Nombre | cloruro | hipoclorito | clorito | clorato | perclorato |
| Fórmula | cl | Cl O | Cl O2 | Cl O3 | Cl O4 |
| Estructura |  |  |  |
Ocurrencia en la naturaleza
En la naturaleza, el cloruro se encuentra principalmente en el agua de mar, que tiene una concentración de iones de cloruro de 19400 mg/litro. Cantidades más pequeñas, aunque en concentraciones más altas, ocurren en ciertos mares interiores y en pozos subterráneos de salmuera, como el Gran Lago Salado en Utah y el Mar Muerto en Israel. La mayoría de las sales de cloruro son solubles en agua, por lo tanto, los minerales que contienen cloruro generalmente solo se encuentran en abundancia en climas secos o bajo tierra. Algunos minerales que contienen cloruro incluyen halita (cloruro de sodio NaCl), silvita (cloruro de potasio KCl), bischofita (MgCl 2 ∙6H 2 O), carnalita (KCl∙MgCl 2 ∙6H 2 O) y kainita (KCl∙MgSO 4 ∙ 3H 2O). También se encuentra en minerales evaporíticos como la clorapatita y la sodalita.
Papel en biología
El cloruro tiene una gran importancia fisiológica, que incluye la regulación de la presión osmótica, el equilibrio electrolítico y la homeostasis ácido-base. El cloruro está presente en todos los fluidos corporales y es el anión extracelular más abundante que representa alrededor de un tercio de la tonicidad del fluido extracelular.
El cloruro es un electrolito esencial que juega un papel clave en el mantenimiento de la homeostasis celular y en la transmisión de potenciales de acción en las neuronas. Puede fluir a través de los canales de cloruro (incluido el receptor GABA A) y es transportado por los transportadores KCC2 y NKCC2.
El cloruro generalmente (aunque no siempre) se encuentra en una concentración extracelular más alta, lo que hace que tenga un potencial de inversión negativo (alrededor de -61 mV a 37 ° C en una célula de mamífero). Las concentraciones características de cloruro en organismos modelo son: tanto en E. coli como en la levadura en ciernes son de 10 a 200 mM (según el medio), en células de mamíferos de 5 a 100 mM y en plasma sanguíneo de 100 mM.
La concentración de cloruro en la sangre se denomina cloruro sérico y esta concentración está regulada por los riñones. Un ion cloruro es un componente estructural de algunas proteínas; por ejemplo, está presente en la enzima amilasa. Para estas funciones, el cloruro es uno de los minerales dietéticos esenciales (enumerados por su nombre de elemento cloro). Los niveles de cloruro sérico están regulados principalmente por los riñones a través de una variedad de transportadores que están presentes a lo largo de la nefrona. La mayor parte del cloruro, que es filtrado por el glomérulo, es reabsorbido por los túbulos proximal y distal (principalmente por el túbulo proximal) por transporte tanto activo como pasivo.
Corrosión
La presencia de cloruros, como en el agua de mar, empeora significativamente las condiciones para la corrosión por picaduras de la mayoría de los metales (incluidos los aceros inoxidables, el aluminio y los materiales de alta aleación). La corrosión del acero inducida por cloruros en el hormigón conduce a una descomposición local de la forma protectora de óxido en el hormigón alcalino, de modo que tiene lugar un ataque de corrosión localizado posterior.
Amenazas ambientales
El aumento de las concentraciones de cloruro puede causar una serie de efectos ecológicos tanto en ambientes acuáticos como terrestres. Puede contribuir a la acidificación de los arroyos, movilizar metales radiactivos del suelo por intercambio iónico, afectar la mortalidad y reproducción de plantas y animales acuáticos, promover la invasión de organismos de agua salada en ambientes que antes eran de agua dulce e interferir con la mezcla natural de los lagos. También se ha demostrado que el cloruro de sodio cambia la composición de las especies microbianas en concentraciones relativamente bajas. También puede dificultar el proceso de desnitrificación, un proceso microbiano esencial para la eliminación de nitratos y la conservación de la calidad del agua, e inhibir la nitrificación y la respiración de la materia orgánica.
Producción
La industria cloroalcalina es un importante consumidor del presupuesto mundial de energía. Este proceso convierte el cloruro de sodio en cloro e hidróxido de sodio, que se utilizan para fabricar muchos otros materiales y productos químicos. El proceso implica dos reacciones paralelas:2 Cl → Cl2 + 2 mi2 horas2O + 2 e → H 2 + 2 OH
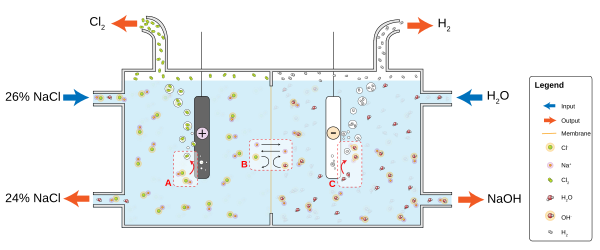 Celda de membrana básica utilizada en la electrólisis de salmuera. En el ánodo (
Celda de membrana básica utilizada en la electrólisis de salmuera. En el ánodo (
A), el cloruro (Cl) se oxida a cloro. La membrana selectiva de iones (
B) permite que el contraión Na fluya libremente, pero evita que aniones como el hidróxido (OH) y el cloruro se difundan. En el cátodo (
C), el agua se reduce a hidróxido e hidrógeno gaseoso.
Ejemplos y usos
Un ejemplo es la sal de mesa, que es cloruro de sodio con la fórmula química NaCl. En el agua se disocia en iones Na y Cl. Las sales como el cloruro de calcio, el cloruro de magnesio y el cloruro de potasio tienen usos variados que van desde tratamientos médicos hasta la formación de cemento.
El cloruro de calcio (CaCl 2) es una sal que se comercializa en forma de gránulos para eliminar la humedad de las habitaciones. El cloruro de calcio también se usa para el mantenimiento de caminos sin pavimentar y para fortalecer las bases de los caminos para nuevas construcciones. Además, el cloruro de calcio se usa ampliamente como descongelante, ya que es eficaz para reducir el punto de fusión cuando se aplica al hielo.
Ejemplos de cloruros con enlaces covalentes son el tricloruro de fósforo, el pentacloruro de fósforo y el cloruro de tionilo, los tres reactivos de cloración que se han utilizado en un laboratorio.
Calidad y procesamiento del agua
Una aplicación importante relacionada con el cloruro es la desalinización, que implica la eliminación de sales de cloruro que requiere mucha energía para obtener agua potable. En la industria del petróleo, los cloruros son un componente del sistema de lodo que se controla de cerca. Un aumento de los cloruros en el sistema de lodo puede ser una indicación de la perforación en una formación de agua salada de alta presión. Su aumento también puede indicar la mala calidad de una arena objetivo.
El cloruro también es un indicador químico útil y confiable de la contaminación fecal de ríos y aguas subterráneas, ya que el cloruro es un soluto no reactivo y ubicuo en las aguas residuales y el agua potable. Muchas empresas reguladoras de agua en todo el mundo utilizan cloruro para controlar los niveles de contaminación de los ríos y las fuentes de agua potable.
Alimento
Las sales de cloruro como el cloruro de sodio se utilizan para conservar los alimentos y como nutrientes o condimentos.
Contenido relacionado
Saborizante
Punto isoeléctrico
Desaminación