Cloruro de cobre (II)
El
cloruro de cobre(II), también conocido como cloruro cúprico, es un compuesto inorgánico con la fórmula química CuCl2. La forma anhidra monoclínica de color marrón amarillento absorbe lentamente la humedad para formar el dihidrato ortorrómbico azul verdoso CuCl2·2H2O, con dos moléculas de agua de hidratación. Se produce industrialmente para su uso como cocatalizador en el proceso Wacker.
Tanto la forma anhidra como la dihidrato se encuentran naturalmente como los minerales raros tolbachita y eriocalcita, respectivamente.
Estructura
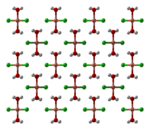
El cloruro de cobre (II) anhidro adopta una estructura de yoduro de cadmio distorsionada. En esta estructura, los centros de cobre son octaédricos. La mayoría de los compuestos de cobre (II) exhiben distorsiones de la geometría octaédrica idealizada debido al efecto Jahn-Teller, que en este caso describe la localización de un electrón d en un orbital molecular que es fuertemente antienlazante con respecto a un par de ligandos de cloruro. En CuCl2·2H2O, el cobre adopta nuevamente una geometría octaédrica muy distorsionada, estando rodeados los centros de Cu(II) por dos ligandos de agua y cuatro ligandos de cloruro, que puente asimétricamente a otros centros de Cu.
El cloruro de cobre (II) es paramagnético. De interés histórico, el CuCl2·2H2O fue utilizado en las primeras mediciones de resonancia paramagnética electrónica por Yevgeny Zavoisky en 1944.
Propiedades y reacciones
Las soluciones acuosas preparadas a partir de cloruro de cobre (II) contienen una variedad de complejos de cobre (II) dependiendo de la concentración, la temperatura y la presencia de iones de cloruro adicionales. Estas especies incluyen el color azul de [Cu(H2O)6]2+ y el color amarillo o rojo de los complejos de haluro de la fórmula [CuCl2+x]x−.
Hidrolisis
Cuando las soluciones de cloruro de cobre (II) se tratan con una base, se produce una precipitación de hidróxido de cobre (II):
- CuCl2 + 2 NaOH → Cu(OH)2 + 2 NaCl
La hidrólisis parcial produce trihidróxido de cloruro de dicobre, Cu2(OH)3Cl, un fungicida popular. Cuando una solución acuosa de cloruro de cobre (II) se deja en el aire y no se estabiliza con una pequeña cantidad de ácido, es propensa a sufrir una ligera hidrólisis.
Redox y descomposición
El cloruro de cobre (II) es un oxidante suave. Comienza a descomponerse en cloruro de cobre (I) y cloro gaseoso alrededor de los 400 °C (752 °F) y se descompone completamente cerca de los 1000 °C (1830 °F):
- 2 CuCl2 → 2 CuCl + Cl2
El punto de fusión informado del cloruro de cobre (II) de 498 °C (928 °F) es una fusión de una mezcla de cloruro de cobre (I) y cloruro de cobre (II). El verdadero punto de fusión de 630 °C (1166 °F) se puede extrapolar utilizando los puntos de fusión de las mezclas de CuCl y CuCl2. El cloruro de cobre (II) (CuCl2) reacciona con varios metales para producir cobre metálico o cloruro de cobre (I) (CuCl) con oxidación del otro metal. Para convertir cloruro de cobre (II) en cloruro de cobre (I), puede ser conveniente reducir una solución acuosa con dióxido de azufre como reductor:
- 2 CuCl2 + SO2 + 2 H2O → 2 CuCl + 2 HCl + H2Así que...4
Complejos de coordinación
CuCl2 reacciona con HCl u otras fuentes de cloruro para formar iones complejos: el CuCl3− rojo (en realidad es un dímero, Cu2Cl6 2−, un par de tetraedros que comparten una arista), y el CuCl42− verde o amarillo.
- CuCl
2 + Cl−
⇌ CuCl−
3 - CuCl
2 + 2 Cl−
⇌ CuCl2 - 2
4
Algunos de estos complejos pueden cristalizarse en una solución acuosa y adoptan una amplia variedad de estructuras.
El cloruro de cobre (II) también forma una variedad de complejos de coordinación con ligandos como amoníaco, piridina y óxido de trifenilfosfina:
- CuCl2 + 2 C5H5N → [CuCl2(C)5H5N)2] (tetragonal)
- CuCl2 + 2 (C6H5)3PO → [CuCl2(C)6H5)3PO)2] (tetraedral)
Sin embargo, ligands "soft" tales como fosfinas (por ejemplo, triphenylphosphine), iodida y cianuro, así como algunas aminas terciarias inducen reducción para dar complejos de cobre (I).
Preparación
El cloruro de cobre (II) se prepara comercialmente mediante la acción de la cloración del cobre. El cobre al rojo vivo (300-400°C) se combina directamente con cloro gaseoso, dando cloruro de cobre (II) (fundido). La reacción es muy exotérmica.
- Cu(s) + Cl2()g) → CuCl2()l)
Una solución de cloruro de cobre (II) se produce comercialmente añadiendo cloro gaseoso a una mezcla circulante de ácido clorhídrico y cobre. A partir de esta solución se puede producir el dihidrato por evaporación.
Aunque el cobre metálico en sí no puede oxidarse con ácido clorhídrico, las bases que contienen cobre, como el hidróxido, el óxido o el carbonato de cobre (II), pueden reaccionar para formar CuCl2 en una reacción ácido-base. que posteriormente se puede calentar por encima de 100 °C (212 °F) para producir el derivado anhidro.
Una vez preparada, una solución de CuCl2 se puede purificar mediante cristalización. Un método estándar toma la solución mezclada en ácido clorhídrico diluido caliente y hace que se formen cristales enfriándolos en un baño de hielo con cloruro de calcio (CaCl2).
Existen medios indirectos y poco utilizados para utilizar iones de cobre en solución para formar cloruro de cobre (II). La electrólisis del cloruro de sodio acuoso con electrodos de cobre produce (entre otras cosas) una espuma azul verdosa que puede recolectarse y convertirse en hidrato. Si bien esto generalmente no se hace debido a la emisión de cloro gaseoso tóxico y a la prevalencia del proceso cloro-álcali más general, la electrólisis convertirá el cobre metálico en iones de cobre en solución formando el compuesto. De hecho, cualquier solución de iones de cobre se puede mezclar con ácido clorhídrico y convertirla en cloruro de cobre eliminando cualquier otro ion.
Usos
Co-catalyst en el proceso de Wacker
Una de las principales aplicaciones industriales del cloruro de cobre(II) es como cocatalizador con cloruro de paladio(II) en el proceso Wacker. En este proceso, el eteno (etileno) se convierte en etanal (acetaldehído) utilizando agua y aire. Durante la reacción, el PdCl2 se reduce a Pd y el CuCl2 sirve para reoxidarlo nuevamente a PdCl2. Luego, el aire puede oxidar el CuCl resultante nuevamente a CuCl2, completando el ciclo.
- C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2 HCl
- Pd + 2 CuCl2 → 2 CuCl + PdCl2
- 4 CuCl + 4 HCl + O2 → 4 CuCl2 + 2 H2O
El proceso general es:
- 2 C2H4 + O2 → 2 CH3CHO
En síntesis orgánica
El cloruro de cobre (II) tiene algunas aplicaciones altamente especializadas en la síntesis de compuestos orgánicos. Afecta la cloración de hidrocarburos aromáticos; esto a menudo se realiza en presencia de óxido de aluminio. Es capaz de clorar la posición alfa de compuestos carbonílicos:
Esta reacción se realiza en un disolvente polar como dimetilformamida, a menudo en presencia de cloruro de litio, que acelera la reacción.
ElCuCl2, en presencia de oxígeno, también puede oxidar los fenoles. El producto principal puede dirigirse para dar una quinona o un producto acoplado de la dimerización oxidativa. Este último proceso proporciona una ruta de alto rendimiento para obtener 1,1-binaftol:
Dichos compuestos son intermediarios en la síntesis de BINAP y sus derivados.
El dihidrato de cloruro de cobre (II) promueve la hidrólisis de acetónidos, es decir, para la desprotección para regenerar dioles o aminoalcoholes, como en este ejemplo (donde TBDPS = terc-butildifenilsililo):
CuCl2 también cataliza la adición de radicales libres de cloruros de sulfonilo a alquenos; A continuación, la alfa-clorosulfona puede sufrir eliminación con una base para dar un producto de vinilsulfona.
Catalizador en producción de cloro
El cloruro de cobre (II) se utiliza como catalizador en una variedad de procesos que producen cloro mediante oxicloración. El proceso Deacon tiene lugar entre 400 y 450 °C en presencia de cloruro de cobre:
- 4 HCl + O2 → 2 Cl2 + 2 H2O
El cloruro de cobre (II) cataliza la cloración en la producción de cloruro de vinilo y diclorometano.
El cloruro de cobre (II) se utiliza en el ciclo cobre-cloro, donde reacciona con el vapor para formar dicloruro de óxido de cobre (II) y cloruro de hidrógeno y luego se recupera en el ciclo a partir de la electrólisis del cloruro de cobre (I).
Usos especializados
El cloruro de cobre (II) se utiliza en pirotecnia como agente colorante azul/verde. En una prueba de llama, los cloruros de cobre, como todos los compuestos de cobre, emiten una luz verde-azul.
En las tarjetas indicadoras de humedad (HIC), se pueden encontrar en el mercado HIC sin cobalto de color marrón a azul (base de cloruro de cobre (II). En 1998, la Comunidad Europea clasificó los artículos que contenían cloruro de cobalto (II) de 0,01 a 1% p/p como T (tóxicos), con la correspondiente frase R de R49 (puede provocar cáncer si se inhala). En consecuencia, se han desarrollado nuevas tarjetas indicadoras de humedad sin cobalto y que contienen cobre.
El cloruro de cobre (II) se utiliza como mordiente en la industria textil, edulcorante de petróleo, conservante de madera y limpiador de agua.
Ocurrencia natural

El cloruro de cobre (II) se produce naturalmente como el muy raro mineral anhidro tolbaquita y la eriocalcita dihidrato. Ambos se encuentran cerca de fumarolas y en algunas minas de cobre. Los cloruros de oxihidróxido mixtos como la atacamita (Cu2(OH)3Cl) son más comunes y surgen entre las zonas de oxidación de los lechos de mineral de Cu en climas áridos.
Seguridad e impacto biológico
El cloruro de cobre (II) puede ser tóxico. La Agencia de Protección Ambiental de EE. UU. sólo permite concentraciones inferiores a 1,3 ppm de iones de cobre acuosos en el agua potable. Si se absorbe cloruro de cobre, provoca dolor de cabeza, diarrea, descenso de la presión arterial y fiebre. La ingestión de grandes cantidades puede provocar intoxicación por cobre, trastornos del sistema nervioso central y hemólisis.
Se ha demostrado que el cloruro de cobre (II) causa aberraciones cromosómicas y alteraciones del ciclo mitótico dentro de las células de A. cepa (cebolla). Estas alteraciones celulares conducen a genotoxicidad. El cloruro de cobre (II) también se ha estudiado como un contaminante ambiental nocivo. A menudo presente en el agua de riego, puede afectar negativamente a los microbios del agua y del suelo. Específicamente, se descubrió que las bacterias desnitrificantes eran muy sensibles a la presencia de cloruro de cobre (II). Se encontró que a una concentración de 0,95 mg/L, el cloruro de cobre (II) provoca una inhibición del 50% (CI50) de la actividad metabólica de los microbios desnitrificantes.
Contenido relacionado
Ley de Fick
Masa molar
Miscibilidad


