Clorato
Clorato es el nombre común del ClO−< /sup>
3 anión, cuyo átomo de cloro es en el estado de oxidación +5. El término también puede referirse a compuestos químicos que contienen este anión, siendo los cloratos las sales del ácido clórico. Otros oxianiones de cloro pueden denominarse "clorato" seguido de un número romano entre paréntesis que indica el estado de oxidación del cloro: por ejemplo, ClO−< /sup>
4 El ion comúnmente llamado perclorato también puede llamarse clorato(VII).
Como lo predice la teoría de la repulsión de pares de electrones de la capa de valencia, los aniones clorato tienen estructuras piramidales trigonales.
Los cloratos son oxidantes potentes y deben mantenerse alejados de sustancias orgánicas o materiales que se oxidan fácilmente. Las mezclas de sales de clorato con prácticamente cualquier material combustible (azúcar, aserrín, carbón, solventes orgánicos, metales, etc.) deflagrarán fácilmente. Los cloratos alguna vez fueron ampliamente utilizados en pirotecnia por este motivo, aunque su uso ha disminuido debido a su inestabilidad. La mayoría de las aplicaciones pirotécnicas que anteriormente usaban cloratos ahora usan percloratos más estables.
Estructura y unión
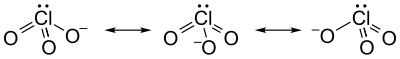
El ion clorato no puede representarse satisfactoriamente mediante una sola estructura de Lewis, ya que todos los enlaces Cl-O tienen la misma longitud (1,49 Å en clorato de potasio) y el átomo de cloro es hipervalente. En cambio, a menudo se lo considera un híbrido de múltiples estructuras de resonancia:
Preparación
Laboratorio
Los cloratos metálicos se pueden preparar agregando cloro a hidróxidos metálicos calientes como KOH:
- 3 Cl2 + 6 KOH → 5 KCl + KClO3 + 3 H2O
En esta reacción, el cloro sufre una desproporción, tanto de reducción como de oxidación. El cloro, número de oxidación 0, forma cloruro Cl− (número de oxidación −1) y clorato(V) ClO−
>3 (número de oxidación +5). La reacción de hidróxidos metálicos acuosos fríos con cloro produce cloruro e hipoclorito (número de oxidación +1).
Industrial
La síntesis a escala industrial del clorato de sodio comienza a partir de una solución acuosa de cloruro de sodio (salmuera) en lugar de cloro gaseoso. Si el equipo de electrólisis permite mezclar el cloro y el hidróxido de sodio, entonces ocurre la reacción de desproporción descrita anteriormente. El calentamiento de los reactivos a 50-70 °C se realiza mediante la energía eléctrica utilizada para la electrólisis.
Ocurrencia natural
Un estudio reciente ha descubierto la presencia de depósitos naturales de clorato en todo el mundo, con concentraciones relativamente altas en regiones áridas e hiperáridas. El clorato también se midió en muestras de lluvia con una cantidad de clorato similar a la de perclorato. Se sospecha que el clorato y el perclorato pueden compartir un mecanismo de formación natural común y podrían ser parte del ciclo biogeoquímico del cloro. Desde un punto de vista microbiano, la presencia de clorato natural también podría explicar por qué existe una variedad de microorganismos capaces de reducir el clorato a cloruro. Además, la evolución de la reducción de clorato puede ser un fenómeno antiguo ya que todas las bacterias reductoras de perclorato descritas hasta la fecha también utilizan clorato como aceptor terminal de electrones. Cabe señalar claramente que actualmente no se conocen minerales con predominio de clorato. Esto significa que el anión clorato existe sólo como sustitución en las especies minerales conocidas o, eventualmente, está presente en las soluciones que llenan los poros.
En 2011, un estudio del Instituto de Tecnología de Georgia reveló la presencia de clorato de magnesio en el planeta Marte.
Compuestos (sales)
Ejemplos de cloratos incluyen
- clorato de potasio, KClO3
- clorato de sodio, NaClO3
- clorato de magnesio, Mg(ClO3)2
Otros oxianiones
Si un número romano entre paréntesis sigue a la palabra "clorato", esto indica que el oxianión contiene cloro en el estado de oxidación indicado, a saber:
| Nombre común | Nombre del stock | Estado de oxidación | Formula |
|---|---|---|---|
| Hipoclorito | Chlorate(I) | + 1 | ClO− |
| Clorite | Chlorate(III) | +3 | ClO− 2 |
| Chlorate | Chlorate(V) | +5 | ClO− 3 |
| Perchlorate | Chlorate(VII) | +7 | ClO− 4 |
Usando esta convención, "clorato" significa cualquier oxianión de cloro. Por lo general, el "clorato" se refiere únicamente al cloro en el estado de oxidación +5.
Toxicidad
Los cloratos son relativamente tóxicos, aunque generalmente forman cloruros inofensivos al reducirse.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar