Cladograma
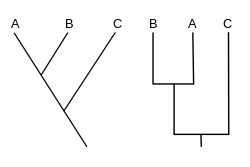
Un cladograma (del griego clados "rama" y gramma "carácter") es un diagrama usado en cladística para mostrar relaciones entre organismos. Sin embargo, un cladograma no es un árbol evolutivo porque no muestra cómo se relacionan los ancestros con los descendientes, ni cuánto han cambiado, por lo que muchos árboles evolutivos diferentes pueden ser consistentes con el mismo cladograma. Un cladograma usa líneas que se ramifican en diferentes direcciones y terminan en un clado, un grupo de organismos con un último ancestro común. Hay muchas formas de cladogramas, pero todos tienen líneas que se ramifican de otras líneas. Las líneas se pueden rastrear hasta donde se ramifican. Estos puntos de ramificación representan un ancestro hipotético (no una entidad real) que se puede inferir que exhibe los rasgos compartidos entre los taxones terminales que se encuentran por encima de él. Este antepasado hipotético podría proporcionar pistas sobre el orden de evolución de varias características, adaptación y otras narrativas evolutivas sobre los antepasados. Aunque tradicionalmente tales cladogramas se generaron en gran medida sobre la base de caracteres morfológicos, los datos de secuenciación de ADN y ARN y la filogenética computacional ahora se usan con mucha frecuencia en la generación de cladogramas, ya sea solos o en combinación con la morfología.
Generando un cladograma
Datos moleculares versus morfológicos
Las características utilizadas para crear un cladograma se pueden categorizar aproximadamente como morfológicas (cráneo sinápsido, sangre caliente, notocorda, unicelular, etc.) o moleculares (ADN, ARN u otra información genética). Antes del advenimiento de la secuenciación del ADN, el análisis cladístico utilizaba principalmente datos morfológicos. También se pueden usar datos de comportamiento (para animales).
A medida que la secuenciación del ADN se ha vuelto más barata y sencilla, la sistemática molecular se ha convertido en una forma cada vez más popular de inferir hipótesis filogenéticas. El uso de un criterio de parsimonia es solo uno de varios métodos para inferir una filogenia a partir de datos moleculares. Los enfoques como la máxima verosimilitud, que incorporan modelos explícitos de evolución de secuencias, son formas no hennigianas de evaluar datos de secuencias. Otro método poderoso para reconstruir filogenias es el uso de marcadores de retrotransposones genómicos, que se cree que son menos propensos al problema de reversión que afecta a los datos de secuencia. En general, también se supone que tienen una baja incidencia de homoplasias porque alguna vez se pensó que su integración en el genoma era completamente aleatoria; sin embargo, al menos a veces esto parece no ser el caso.

Plesiomorfias y sinapomorfias
Los investigadores deben decidir qué estados de carácter son "ancestrales" (plesiomorfias) y las que se derivan (sinapomorfias), porque solo los estados de caracteres sinapomórficos proporcionan evidencia de agrupación. Esta determinación generalmente se realiza por comparación con los estados de carácter de uno o más grupos externos. Los estados compartidos entre el grupo externo y algunos miembros del grupo interno son simplesiomorfias; los estados que están presentes solo en un subconjunto del endogrupo son sinapomorfias. Tenga en cuenta que los estados de caracteres exclusivos de un solo terminal (autapomorfias) no proporcionan evidencia de agrupación. La elección de un grupo externo es un paso crucial en el análisis cladístico porque diferentes grupos externos pueden producir árboles con topologías profundamente diferentes.
Homoplasias
Una homoplasia es un estado de carácter que comparten dos o más taxones debido a alguna causa diferente a la ascendencia común. Los dos tipos principales de homoplasia son la convergencia (evolución del mismo carácter en al menos dos linajes distintos) y la reversión (el retorno a un estado de carácter ancestral). Los caracteres que son obviamente homoplásticos, como el pelaje blanco en diferentes linajes de mamíferos árticos, no deben incluirse como carácter en un análisis filogenético ya que no contribuyen en nada a nuestra comprensión de las relaciones. Sin embargo, la homoplasia a menudo no es evidente a partir de la inspección del carácter en sí (como en la secuencia de ADN, por ejemplo), y luego se detecta por su incongruencia (distribución poco parsimoniosa) en un cladograma muy parsimonioso. Tenga en cuenta que los caracteres que son homoplásticos aún pueden contener una señal filogenética.
Un ejemplo bien conocido de homoplasia debido a la evolución convergente sería el carácter "presencia de alas". Aunque las alas de las aves, los murciélagos y los insectos tienen la misma función, cada una evolucionó de forma independiente, como puede verse por su anatomía. Si se calificara un ave, un murciélago y un insecto alado para el carácter "presencia de alas", se introduciría una homoplasia en el conjunto de datos y esto podría confundir el análisis, lo que posiblemente daría lugar a una hipótesis falsa. de relaciones Por supuesto, la única razón por la que una homoplasia es reconocible en primer lugar es porque hay otros caracteres que implican un patrón de relaciones que revelan su distribución homoplástica.
Qué no es un cladograma
Un cladograma es el resultado esquemático de un análisis, que agrupa taxones basándose únicamente en las sinapomorfias. Hay muchos otros algoritmos filogenéticos que tratan los datos de manera algo diferente y dan como resultado árboles filogenéticos que parecen cladogramas pero no son cladogramas. Por ejemplo, los algoritmos fenéticos, como UPGMA y Neighbor-Joining, agrupan por similitud general y tratan tanto las sinapomorfias como las simplesiomorfias como evidencia de agrupación. Los diagramas resultantes son fenogramas, no cladogramas. enfoques de probabilidad o bayesianos) que tienen en cuenta tanto el orden de ramificación como la "longitud de la rama" cuente tanto las sinapomorfias como las autapomorfias como evidencia a favor o en contra de la agrupación. Los diagramas resultantes de ese tipo de análisis tampoco son cladogramas.
Selección de cladogramas
Hay varios algoritmos disponibles para identificar el "mejor" cladograma. La mayoría de los algoritmos usan una métrica para medir qué tan consistente es un cladograma candidato con los datos. La mayoría de los algoritmos de cladogramas utilizan las técnicas matemáticas de optimización y minimización.
En general, los algoritmos de generación de cladogramas deben implementarse como programas de computadora, aunque algunos algoritmos se pueden realizar manualmente cuando los conjuntos de datos son modestos (por ejemplo, solo unas pocas especies y un par de características).
Algunos algoritmos son útiles solo cuando los datos característicos son moleculares (ADN, ARN); otros algoritmos son útiles solo cuando los datos característicos son morfológicos. Se pueden usar otros algoritmos cuando los datos característicos incluyen datos tanto moleculares como morfológicos.
Los algoritmos para cladogramas u otros tipos de árboles filogenéticos incluyen mínimos cuadrados, unión de vecinos, parsimonia, máxima verosimilitud e inferencia bayesiana.
Los biólogos a veces usan el término parsimonia para un tipo específico de algoritmo de generación de cladogramas y, a veces, como un término general para todos los algoritmos filogenéticos.
Los algoritmos que realizan tareas de optimización (como la creación de cladogramas) pueden ser sensibles al orden en que se presentan los datos de entrada (la lista de especies y sus características). Ingresar los datos en varios órdenes puede causar que el mismo algoritmo produzca diferentes "mejores" cladogramas. En estas situaciones, el usuario debe ingresar los datos en varios órdenes y comparar los resultados.
Usar diferentes algoritmos en un solo conjunto de datos a veces puede producir diferentes "mejores" cladogramas, porque cada algoritmo puede tener una definición única de lo que es "mejor".
Debido a la cantidad astronómica de cladogramas posibles, los algoritmos no pueden garantizar que la solución sea la mejor solución general. Se seleccionará un cladograma no óptimo si el programa se establece en un mínimo local en lugar del mínimo global deseado. Para ayudar a resolver este problema, muchos algoritmos de cladogramas utilizan un enfoque de recocido simulado para aumentar la probabilidad de que el cladograma seleccionado sea el óptimo.
La posición basal es la dirección de la base (o raíz) de un árbol filogenético o cladograma enraizado. Un clado basal es el clado más antiguo (de un rango taxonómico dado [a]) en ramificarse dentro de un clado más grande.
Estadísticas
Prueba de diferencia de longitud de incongruencia (o prueba de homogeneidad de partición)
La prueba de diferencia de longitud de incongruencia (ILD) es una medida de cómo la combinación de diferentes conjuntos de datos (por ejemplo, genes morfológicos y moleculares, plástidos y nucleares) contribuye a un árbol más largo. Se mide calculando primero la longitud total del árbol de cada partición y sumándolas. Luego se hacen réplicas haciendo particiones ensambladas al azar que consisten en las particiones originales. Las longitudes se suman. Se obtiene un valor de p de 0,01 para 100 repeticiones si 99 repeticiones tienen longitudes de árbol combinadas más largas.
Medición de homoplasia
Algunas medidas intentan medir la cantidad de homoplasia en un conjunto de datos con referencia a un árbol, aunque no está necesariamente claro con precisión qué propiedad pretenden cuantificar estas medidas.
Índice de consistencia
El índice de coherencia (CI) mide la coherencia de un árbol con un conjunto de datos: una medida de la cantidad mínima de homoplasia implícita en el árbol. Se calcula contando el número mínimo de cambios en un conjunto de datos y dividiéndolo por el número real de cambios necesarios para el cladograma. También se puede calcular un índice de consistencia para un carácter individual i, denotado ci.
Además de reflejar la cantidad de homoplasia, la métrica también refleja la cantidad de taxones en el conjunto de datos, (en menor medida) la cantidad de caracteres en un conjunto de datos, el grado en que cada carácter lleva información filogenética y la moda en qué caracteres aditivos están codificados, haciéndolo inadecuado para su propósito.
ci ocupa un rango de 1 a 1 / [n.taxa/2] en caracteres binarios con una distribución uniforme del estado; su valor mínimo es mayor cuando los estados no se propagan uniformemente. En general, para un carácter binario o no binario con , ci ocupa un rango de 1 a 1 .
Índice de retención
El índice de retención (RI) se propuso como una mejora del IC "para ciertas aplicaciones" Esta métrica también pretende medir la cantidad de homoplasia, pero también mide qué tan bien las sinapomorfias explican el árbol. Se calcula tomando el (número máximo de cambios en un árbol menos el número de cambios en el árbol) y dividiéndolo por (el número máximo de cambios en el árbol menos el número mínimo de cambios en el conjunto de datos).
El índice de consistencia reescalado (RC) se obtiene multiplicando el IC por el RI; en efecto, esto extiende el rango del IC de tal manera que su valor mínimo teóricamente alcanzable se vuelve a escalar a 0, y su máximo permanece en 1. El índice de homoplasia (HI) es simplemente 1 - IC.
Razón de exceso de homoplasia
Esto mide la cantidad de homoplasia observada en un árbol en relación con la cantidad máxima de homoplasia que teóricamente podría estar presente: 1 − (exceso de homoplasia observado) / (exceso de homoplasia máximo). Un valor de 1 indica que no hay homoplasia; 0 representa tanta homoplasia como habría en un conjunto de datos completamente aleatorio, y los valores negativos indican aún más homoplasia (y tienden a ocurrir solo en ejemplos artificiales). El HER se presenta como la mejor medida de homoplasia disponible actualmente.
Contenido relacionado
La transcriptasa inversa
Okapi
Estímulo (fisiología)