Cianobacterias
Las cianobacterias utilizan pigmentos fotosintéticos, como carotenoides, ficobilinas y diversas formas de clorofila, que absorben la energía de la luz. A diferencia de los procariotas heterótrofos, las cianobacterias tienen membranas internas. Estos son sacos aplanados llamados tilacoides donde se realiza la fotosíntesis. Los eucariotas fototróficos, como las plantas verdes, realizan la fotosíntesis en plástidos que se cree que tienen su ascendencia en las cianobacterias, adquiridas hace mucho tiempo a través de un proceso llamado endosimbiosis. Estas cianobacterias endosimbióticas en eucariotas luego evolucionaron y se diferenciaron en orgánulos especializados como cloroplastos, cromoplastos, etioplastos y leucoplastos, conocidos colectivamente como plástidos.
Las cianobacterias son los primeros organismos que se sabe que produjeron oxígeno. Al producir y liberar oxígeno como un subproducto de la fotosíntesis, se cree que las cianobacterias han convertido la atmósfera reductora y pobre en oxígeno en una oxidante, lo que provocó el Gran Evento de Oxidación y la "oxidación de la Tierra", que cambió drásticamente la composición de las formas de vida de la Tierra.
Las cianobacterias Synechocystis y Cyanothece son organismos modelo importantes con aplicaciones potenciales en biotecnología para la producción de bioetanol, colorantes alimentarios, como fuente de alimentación humana y animal, suplementos dietéticos y materias primas. Las cianobacterias producen una variedad de toxinas conocidas como cianotoxinas que pueden representar un peligro para los humanos y los animales.
Resumen
Las cianobacterias son un filo muy grande y diverso de procariotas fotoautotróficas. Se definen por su combinación única de pigmentos y su capacidad para realizar la fotosíntesis oxigénica. A menudo viven en agregados coloniales que pueden adoptar una multitud de formas. De particular interés son las especies filamentosas, que a menudo dominan las capas superiores de los tapetes microbianos que se encuentran en ambientes extremos, como fuentes termales, aguas hipersalinas, desiertos y regiones polares, pero también están ampliamente distribuidas en ambientes más mundanos.
Las cianobacterias son un grupo de bacterias fotosintéticas optimizadas evolutivamente para condiciones ambientales de bajo oxígeno. Algunas especies son fijadoras de nitrógeno y viven en una amplia variedad de suelos húmedos y agua, ya sea libremente o en una relación simbiótica con plantas u hongos formadores de líquenes (como en el género de líquenes Peltigera). Van desde unicelulares hasta filamentosas e incluyen especies coloniales. Las colonias pueden formar filamentos, láminas o incluso esferas huecas.
Las cianobacterias son procariotas fotosintéticas distribuidas globalmente y contribuyen de manera importante a los ciclos biogeoquímicos globales. Son los únicos procariotas fotosintéticos oxigénicos y prosperan en hábitats diversos y extremos. Se encuentran entre los organismos más antiguos de la Tierra con registros fósiles que datan de 3.500 millones de años. Desde entonces, las cianobacterias han sido actores esenciales en los ecosistemas de la Tierra. Las cianobacterias planctónicas son un componente fundamental de las redes alimentarias marinas y son los principales contribuyentes a los flujos globales de carbono y nitrógeno. Algunas cianobacterias forman floraciones de algas nocivas que alteran los servicios de los ecosistemas acuáticos y provocan la intoxicación de la vida silvestre y los seres humanos mediante la producción de potentes toxinas (cianotoxinas) como las microcistinas, la saxitoxina y la cilindrospermopsina. Hoy en día, las floraciones de cianobacterias representan una seria amenaza para los ambientes acuáticos y la salud pública, y están aumentando en frecuencia y magnitud a nivel mundial.
Las cianobacterias son omnipresentes en los entornos marinos y desempeñan un papel importante como productores primarios. El fitoplancton marino contribuye hoy en día con casi la mitad de la producción primaria total de la Tierra. Dentro de las cianobacterias, solo unos pocos linajes colonizaron el mar abierto (es decir, Crocosphaera y parientes, cianobacteria UCYN-A, Trichodesmium, así como Prochlorococcus y Synechococcus). De estos linajes, las cianobacterias fijadoras de nitrógeno son particularmente importantes porque ejercen un control sobre la productividad primaria y la exportación de carbono orgánico a las profundidades del océano, al convertir el gas nitrógeno en amonio, que luego se utiliza para producir aminoácidos y proteínas. Las picocianobacterias marinas (es decir, Prochlorococcus y Synechococcus) dominan numéricamente la mayoría de los ensamblajes de fitoplancton en los océanos modernos y contribuyen de manera importante a la productividad primaria. Mientras que algunas cianobacterias planctónicas son células unicelulares y de vida libre (por ejemplo, Crocosphaera, Prochlorococcus, Synechococcus), otras han establecido relaciones simbióticas con algas haptofitas, como los cocolitóforos. Entre las formas filamentosas, Trichodesmium son de vida libre y forman agregados. Sin embargo, las cianobacterias formadoras de heterocistos filamentosos (p. ej., Richelia, Calothrix) se encuentran en asociación con diatomeas como Hemiaulus, Rhizosolenia y Chaetoceros.
Las cianobacterias marinas incluyen los organismos fotosintéticos más pequeños que se conocen. El más pequeño de todos, Prochlorococcus, mide entre 0,5 y 0,8 micrómetros de diámetro. En términos de números individuales, Prochlorococcus es posiblemente la especie más abundante en la Tierra: un solo mililitro de agua de mar superficial puede contener 100.000 células o más. Se estima que en todo el mundo hay varios octillones (1027) de individuos. Prochlorococcus es ubicuo entre 40°N y 40°S y domina en las regiones oligotróficas (pobres en nutrientes) de los océanos. La bacteria representa alrededor del 20% del oxígeno en la atmósfera terrestre.
Morfología
Las cianobacterias tienen una morfología variable, desde formas unicelulares y filamentosas hasta formas coloniales. Las formas filamentosas exhiben una diferenciación celular funcional, como los heterocistos (para la fijación de nitrógeno), los aquinetos (células en estado de reposo) y las hormogonias (filamentos móviles reproductivos). Estos, junto con las conexiones intercelulares que poseen, se consideran los primeros signos de pluricelularidad.
Muchas cianobacterias forman filamentos móviles de células, llamados hormogonios, que se alejan de la biomasa principal para brotar y formar nuevas colonias en otros lugares. Las células de un hormogonio suelen ser más delgadas que en el estado vegetativo, y las células en cualquier extremo de la cadena móvil pueden estar ahusadas. Para separarse de la colonia original, un hormogonio a menudo debe desgarrar una célula más débil en un filamento, llamada necridio.
barras de escala alrededor de 10 μm

• Non-heterocytous: (c) Arthrospira maxima,
Algunas especies filamentosas pueden diferenciarse en varios tipos de células diferentes:
- Células vegetales – las células normales y fotosintéticas que se forman bajo condiciones favorables de crecimiento
- Akinetes – esporas resistentes al clima que pueden formar cuando las condiciones ambientales se vuelven duras
- Heterocitos de paredes gruesas – que contienen la enzima nitrogenasa vital para la fijación de nitrógeno en un ambiente anaeróbico debido a su sensibilidad al oxígeno.
Cada célula individual (cada cianobacteria individual) normalmente tiene una pared celular espesa y gelatinosa. Carecen de flagelos, pero los hormogonios de algunas especies pueden moverse deslizándose por las superficies. Muchas de las formas filamentosas multicelulares de Oscillatoria son capaces de realizar un movimiento ondulatorio; el filamento oscila de un lado a otro. En las columnas de agua, algunas cianobacterias flotan formando vesículas de gas, como en las arqueas. Estas vesículas no son orgánulos como tales. No están limitados por membranas lipídicas, sino por una cubierta proteica.
Fijación de nitrógeno
Algunas cianobacterias pueden fijar nitrógeno atmosférico en condiciones anaeróbicas por medio de células especializadas llamadas heterocistos. Los heterocistos también pueden formarse en las condiciones ambientales apropiadas (anóxicas) cuando el nitrógeno fijado es escaso. Las especies formadoras de heterocistos están especializadas en la fijación de nitrógeno y pueden fijar gas nitrógeno en amoníaco (NH3), nitritos (NO−2) o nitratos (NO−3), que pueden ser absorbidos por las plantas y convertidos en proteínas y ácidos nucleicos (el nitrógeno atmosférico no está biodisponible para las plantas, excepto para aquellas que tienen bacterias fijadoras de nitrógeno endosimbióticas, especialmente la familia Fabaceae, entre otras). otros).
Las cianobacterias de vida libre están presentes en el agua de los arrozales, y las cianobacterias se pueden encontrar creciendo como epífitas en las superficies del alga verde, Chara, donde pueden fijar nitrógeno. Las cianobacterias como Anabaena (un simbionte del helecho acuático Azolla) pueden proporcionar biofertilizantes a las plantaciones de arroz.
Fotosíntesis
Fijación de carbono
Las cianobacterias utilizan la energía de la luz solar para impulsar la fotosíntesis, un proceso en el que la energía de la luz se utiliza para sintetizar compuestos orgánicos a partir de dióxido de carbono. Debido a que son organismos acuáticos, por lo general emplean varias estrategias que se conocen colectivamente como un mecanismo de concentración de "CO2& #34; para ayudar en la adquisición de carbono inorgánico (CO2 o bicarbonato). Entre las estrategias más específicas está la prevalencia generalizada de microcompartimentos bacterianos conocidos como carboxisomas, que cooperan con transportadores activos de CO2 y bicarbonato, para acumular bicarbonato en el citoplasma de la célula. Los carboxisomas son estructuras icosaédricas compuestas de proteínas de cubierta hexamérica que se ensamblan en estructuras similares a jaulas que pueden tener varios cientos de nanómetros de diámetro. Se cree que estas estructuras atan la enzima fijadora de CO2, RuBisCO, al interior del caparazón, también como la enzima anhidrasa carbónica, utilizando la canalización metabólica para mejorar las concentraciones locales de CO2 y así aumentar la eficiencia de la enzima RuBisCO.
Transporte de electrones
A diferencia de las bacterias moradas y otras bacterias que realizan una fotosíntesis anoxigénica, las membranas tilacoides de las cianobacterias no se continúan con la membrana plasmática sino que son compartimentos separados. La maquinaria fotosintética está incrustada en las membranas de los tilacoides, con ficobilisomas que actúan como antenas captadoras de luz adheridas a la membrana, dando la pigmentación verde observada (con longitudes de onda de 450 nm a 660 nm) en la mayoría de las cianobacterias.
Si bien las células de cianobacterias utilizan la mayoría de los electrones de alta energía derivados del agua para sus propias necesidades, una fracción de estos electrones puede donarse al entorno externo a través de la actividad electrogénica.
Respiración
La respiración en las cianobacterias puede ocurrir en la membrana tilacoide junto con la fotosíntesis, y su transporte de electrones fotosintéticos comparte el mismo compartimento que los componentes del transporte respiratorio de electrones. Mientras que el objetivo de la fotosíntesis es almacenar energía mediante la construcción de carbohidratos a partir de CO2, la respiración es lo contrario, con los carbohidratos convertidos nuevamente en CO2 acompañando la liberación de energía.
Las cianobacterias parecen separar estos dos procesos con su membrana plasmática que contiene solo componentes de la cadena respiratoria, mientras que la membrana tilacoide alberga una cadena de transporte de electrones fotosintética y respiratoria interconectada. Las cianobacterias utilizan electrones de la succinato deshidrogenasa en lugar de NADPH para la respiración.
Las cianobacterias solo respiran durante la noche (o en la oscuridad) porque las instalaciones utilizadas para el transporte de electrones se utilizan a la inversa para la fotosíntesis mientras están en la luz.
Cadena de transporte de electrones
Muchas cianobacterias son capaces de reducir el nitrógeno y el dióxido de carbono en condiciones aeróbicas, un hecho que puede ser responsable de su éxito evolutivo y ecológico. La fotosíntesis que oxida el agua se logra acoplando la actividad del fotosistema (PS) II e I (esquema Z). A diferencia de las bacterias de azufre verde que solo usan un fotosistema, el uso de agua como donante de electrones es energéticamente exigente y requiere dos fotosistemas.
Unidos a la membrana tilacoide, los ficobilisomas actúan como antenas captadoras de luz para los fotosistemas. Los componentes del ficobilisoma (ficobiliproteínas) son responsables de la pigmentación azul verdosa de la mayoría de las cianobacterias. Las variaciones sobre este tema se deben principalmente a los carotenoides y las ficoeritrinas que dan a las células su coloración rojo-marrón. En algunas cianobacterias, el color de la luz influye en la composición de los ficobilisomas. Con luz verde, las células acumulan más ficoeritrina, que absorbe la luz verde, mientras que con luz roja producen más ficocianina, que absorbe la luz roja. Por lo tanto, estas bacterias pueden cambiar de rojo ladrillo a verde azulado brillante dependiendo de si están expuestas a la luz verde o a la luz roja. Este proceso de "adaptación cromática complementaria" es una forma de que las células maximicen el uso de la luz disponible para la fotosíntesis.
Algunos géneros carecen de ficobilisomas y tienen clorofila b en su lugar (Prochloron, Prochlorococcus, Prochlorothrix). Estos se agruparon originalmente como proclorofitas o cloroxibacterias, pero parecen haberse desarrollado en varias líneas diferentes de cianobacterias. Por esta razón, ahora se consideran parte del grupo de las cianobacterias.
Metabolismo
En general, la fotosíntesis en las cianobacterias usa agua como donante de electrones y produce oxígeno como subproducto, aunque algunas también pueden usar sulfuro de hidrógeno, un proceso que ocurre entre otras bacterias fotosintéticas, como la bacteria del azufre púrpura.
El dióxido de carbono se reduce para formar carbohidratos a través del ciclo de Calvin. Se considera que las grandes cantidades de oxígeno en la atmósfera fueron creadas por primera vez por las actividades de las antiguas cianobacterias. A menudo se encuentran como simbiontes con otros grupos de organismos como hongos (líquenes), corales, pteridófitos (Azolla), angiospermas (Gunnera), etc.
Hay algunos grupos capaces de un crecimiento heterótrofo, mientras que otros son parásitos y causan enfermedades en invertebrados o algas (p. ej., la enfermedad de la banda negra).
Ecología

Las cianobacterias se pueden encontrar en casi todos los hábitats terrestres y acuáticos: océanos, agua dulce, suelo húmedo, rocas humedecidas temporalmente en los desiertos, roca y suelo descubiertos, e incluso rocas antárticas. Pueden ocurrir como células planctónicas o formar biopelículas fototróficas. Se encuentran dentro de piedras y conchas (en ecosistemas endolíticos). Algunos son endosimbiontes en líquenes, plantas, varios protistas o esponjas y proporcionan energía al huésped. Algunos viven en el pelaje de los perezosos, proporcionando una forma de camuflaje.
Las cianobacterias acuáticas son conocidas por sus floraciones extensas y muy visibles que pueden formarse tanto en ambientes marinos como de agua dulce. Las flores pueden tener la apariencia de pintura azul verdosa o espuma. Estas floraciones pueden ser tóxicas y, con frecuencia, provocan el cierre de aguas recreativas cuando se detectan. Los bacteriófagos marinos son parásitos importantes de las cianobacterias marinas unicelulares.
El crecimiento de cianobacterias se ve favorecido en estanques y lagos donde las aguas son tranquilas y tienen poca mezcla turbulenta. Sus ciclos de vida se interrumpen cuando el agua se mezcla de forma natural o artificial a partir de corrientes agitadas causadas por el agua que fluye de los arroyos o el agua agitada de las fuentes. Por esta razón, las floraciones de cianobacterias rara vez ocurren en los ríos a menos que el agua fluya lentamente. El crecimiento también se ve favorecido a temperaturas más altas, lo que permite que las especies de Microcystis superen a las diatomeas y las algas verdes y, potencialmente, permitan el desarrollo de toxinas.
Según las tendencias ambientales, los modelos y las observaciones sugieren que es probable que las cianobacterias aumenten su dominio en los ambientes acuáticos. Esto puede acarrear graves consecuencias, en particular la contaminación de las fuentes de agua potable. Investigadores, incluida Linda Lawton de la Universidad Robert Gordon, han desarrollado técnicas para estudiarlos. Las cianobacterias pueden interferir con el tratamiento del agua de varias maneras, principalmente al tapar los filtros (a menudo grandes lechos de arena y medios similares) y al producir cianotoxinas, que tienen el potencial de causar enfermedades graves si se consumen. Las consecuencias también pueden residir en las prácticas de gestión de la pesca y los desechos. La eutrofización antropogénica, el aumento de las temperaturas, la estratificación vertical y el aumento del dióxido de carbono atmosférico contribuyen a que las cianobacterias dominen cada vez más los ecosistemas acuáticos.
Se ha descubierto que las cianobacterias desempeñan un papel importante en los hábitats terrestres. Se ha informado ampliamente que las costras del suelo de cianobacterias ayudan a estabilizar el suelo para evitar la erosión y retener el agua. Un ejemplo de una especie de cianobacteria que lo hace es Microcoleus vaginatus. M. vaginatus estabiliza el suelo utilizando una cubierta de polisacárido que se une a las partículas de arena y absorbe el agua.
Algunos de estos organismos contribuyen significativamente a la ecología global y al ciclo del oxígeno. La pequeña cianobacteria marina Prochlorococcus fue descubierta en 1986 y representa más de la mitad de la fotosíntesis del océano abierto. Alguna vez se pensó que los ritmos circadianos solo existían en las células eucariotas, pero muchas cianobacterias muestran un ritmo circadiano bacteriano.
"Cyanobacteria es posiblemente el grupo más exitoso de microorganismos en la tierra. Son los más diversos genéticamente; ocupan una amplia gama de hábitats en todas las latitudes, difundidos en los ecosistemas de agua dulce, marina y terrestre, y se encuentran en los nichos más extremos como las fuentes calientes, las obras de sal y las bahías hipersalinas. La cianobacteria generadora de oxígeno fotoautotrófica creó las condiciones en la atmósfera temprana del planeta que dirigía la evolución del metabolismo aeróbico y la fotosíntesis eucariota. Cyanobacteria cumple funciones ecológicas vitales en los océanos del mundo, siendo importantes contribuyentes a los presupuestos globales de carbono y nitrógeno". – Stewart y Falconer
Cianobiontes

Hoja y colonización de raíz por cyanobacteria
(2) En la superficie de la raíz, la cianobacteria exhibe dos tipos de patrón de colonización; en el cabello raíz, filamentos de Anabaena y Nostoc especies forman colonias sueltas, y en la zona restringida en la superficie de la raíz, específicas Nostoc especies forman colonias cyanobacterianas.
(3) Co-inoculación con 2,4-D y Nostoc spp. aumenta la formación para-nodule y la fijación de nitrógeno. Un gran número de Nostoc spp. isolates colonize the root endosphere and form para-nodules.
Algunas cianobacterias, los llamados cianobiontes (simbiontes de cianobacterias), tienen una relación simbiótica con otros organismos, tanto unicelulares como pluricelulares. Como se ilustra a la derecha, hay muchos ejemplos de cianobacterias que interactúan simbióticamente con las plantas terrestres. Las cianobacterias pueden ingresar a la planta a través de los estomas y colonizar el espacio intercelular, formando asas y espirales intracelulares. Anabaena spp. colonizar las raíces de las plantas de trigo y algodón. Calothrix sp. también se ha encontrado en el sistema radicular del trigo. Las monocotiledóneas, como el trigo y el arroz, han sido colonizadas por Nostoc spp. En 1991, Ganther y otros aislaron diversas cianobacterias heterocistas fijadoras de nitrógeno, incluidas Nostoc, Anabaena y Cylindrospermum, de raíz de planta y suelo. La evaluación de las raíces de las plántulas de trigo reveló dos tipos de patrones de asociación: colonización suelta del pelo de la raíz por Anabaena y colonización estrecha de la superficie de la raíz dentro de una zona restringida por Nostoc.

a) O. Magnífico con numerosos cyanobiontes presentes en las listas de circunferencia superior e inferior (cabezas de flecha negras) del cingulo denominado la cámara simbiótica.
b) O. steinii con numerosos cyanobiontes que habitan la cámara simbiótica.
c) Ampliación de la zona en b) mostrando dos cianobionts que están siendo divididos por fisión transversal binaria (flechas blancas).
Las relaciones entre los cianobiontes (simbiontes de cianobacterias) y los protistas anfitriones son particularmente notables, ya que algunas cianobacterias (diazotrofas) fijadoras de nitrógeno desempeñan un papel importante en la producción primaria, especialmente en océanos oligotróficos limitados en nitrógeno. Las cianobacterias, en su mayoría Synechococcus y Prochlorococcus de tamaño pico, se distribuyen de manera ubicua y son los organismos fotosintéticos más abundantes en la Tierra, y representan una cuarta parte de todo el carbono fijado en los ecosistemas marinos. A diferencia de las cianobacterias marinas de vida libre, se sabe que algunos cianobiontes son responsables de la fijación de nitrógeno en lugar de la fijación de carbono en el huésped. Sin embargo, las funciones fisiológicas de la mayoría de los cianobiontes siguen siendo desconocidas. Se han encontrado cianobiontes en numerosos grupos de protistas, incluidos dinoflagelados, tintínidos, radiolarios, amebas, diatomeas y haptofitos. Entre estos cianobiontes, se sabe poco sobre la naturaleza (p. ej., diversidad genética, especificidad del cianobionte o huésped y estacionalidad del cianobionte) de la simbiosis involucrada, particularmente en relación con el huésped dinoflagelado.
Comportamiento colectivo
Algunas cianobacterias, incluso las unicelulares, muestran comportamientos colectivos sorprendentes y forman colonias (o floraciones) que pueden flotar en el agua y desempeñar funciones ecológicas importantes. Por ejemplo, hace miles de millones de años, las comunidades de cianobacterias paleoproterozoicas marinas podrían haber ayudado a crear la biosfera tal como la conocemos al enterrar compuestos de carbono y permitir la acumulación inicial de oxígeno en la atmósfera. Por otro lado, las floraciones de cianobacterias tóxicas son un problema cada vez mayor para la sociedad, ya que sus toxinas pueden ser dañinas para los animales. Las floraciones extremas también pueden agotar el oxígeno del agua y reducir la penetración de la luz solar y la visibilidad, comprometiendo así el comportamiento de alimentación y apareamiento de las especies que dependen de la luz.
Como se muestra en el diagrama de la derecha, las bacterias pueden permanecer en suspensión como células individuales, adherirse colectivamente a las superficies para formar biopelículas, sedimentar pasivamente o flocular para formar agregados suspendidos. Las cianobacterias pueden producir polisacáridos sulfatados (una neblina amarilla que rodea los grupos de células) que les permiten formar agregados flotantes. En 2021, Maeda et al. descubrió que el oxígeno producido por las cianobacterias queda atrapado en la red de polisacáridos y células, lo que permite que los microorganismos formen floraciones flotantes. Se cree que las fibras de proteínas específicas conocidas como pili (representadas como líneas que irradian desde las células) pueden actuar como una forma adicional de unir las células entre sí o sobre las superficies. Algunas cianobacterias también usan vesículas de gas intracelulares sofisticadas como ayudas de flotación.
El diagrama de arriba a la izquierda muestra un modelo propuesto de distribución microbiana, organización espacial, ciclos de carbono y O2 en grupos y áreas adyacentes. (a) Los grupos contienen filamentos de cianobacterias más densos y microbios heterótrofos. Las diferencias iniciales de densidad dependen de la motilidad de las cianobacterias y pueden establecerse en escalas de tiempo breves. El color azul más oscuro fuera del grupo indica concentraciones de oxígeno más altas en áreas adyacentes a los grupos. Los medios óxicos aumentan las frecuencias de inversión de los filamentos que comienzan a salir de los grumos, lo que reduce la migración neta fuera del grumo. Esto permite la persistencia de las aglomeraciones iniciales en escalas de tiempo breves; (b) Acoplamiento espacial entre la fotosíntesis y la respiración en grupos. El oxígeno producido por las cianobacterias se difunde en el medio suprayacente o se utiliza para la respiración aeróbica. El carbono inorgánico disuelto (DIC) se difunde en el cúmulo desde el medio suprayacente y también se produce dentro del cúmulo por la respiración. En soluciones óxicas, altas concentraciones de O2 reducen la eficiencia de la fijación de CO2 y resultan en la excreción de glicolato. En estas condiciones, la aglomeración puede ser beneficiosa para las cianobacterias si estimula la retención de carbono y la asimilación de carbono inorgánico por parte de las cianobacterias dentro de las aglomeraciones. Este efecto parece promover la acumulación de partículas de carbono orgánico (células, vainas y organismos heterótrofos) en grupos.
No ha quedado claro por qué y cómo las cianobacterias forman comunidades. La agregación debe desviar recursos del negocio principal de producir más cianobacterias, ya que generalmente implica la producción de grandes cantidades de material extracelular. Además, las células en el centro de los agregados densos también pueden sufrir sombra y escasez de nutrientes. Entonces, ¿qué ventaja trae esta vida comunitaria para las cianobacterias?

Nuevos conocimientos sobre cómo las cianobacterias forman floraciones provienen de un estudio de 2021 sobre la cianobacteria Synechocystis. Estos utilizan un conjunto de genes que regulan la producción y exportación de polisacáridos sulfatados, cadenas de moléculas de azúcar modificadas con grupos sulfato que a menudo se pueden encontrar en algas marinas y tejidos animales. Muchas bacterias generan polisacáridos extracelulares, pero los sulfatados solo se han visto en cianobacterias. En Synechocystis, estos polisacáridos sulfatados ayudan a la cianobacteria a formar agregados flotantes al atrapar burbujas de oxígeno en la red viscosa de células y polisacáridos.
Estudios anteriores sobre Synechocystis han demostrado que los pelos de tipo IV, que decoran la superficie de las cianobacterias, también desempeñan un papel en la formación de floraciones. Estas fibras proteicas retráctiles y adhesivas son importantes para la motilidad, la adhesión a sustratos y la captación de ADN. La formación de floraciones puede requerir tanto pili tipo IV como Synechan; por ejemplo, los pili pueden ayudar a exportar el polisacárido fuera de la célula. De hecho, la actividad de estas fibras proteicas puede estar relacionada con la producción de polisacáridos extracelulares en cianobacterias filamentosas. Una respuesta más obvia sería que los pili ayudan a construir los agregados uniendo las células entre sí o con el polisacárido extracelular. Al igual que con otros tipos de bacterias, ciertos componentes de los pili pueden permitir que las cianobacterias de la misma especie se reconozcan entre sí y establezcan contactos iniciales, que luego se estabilizan mediante la construcción de una masa de polisacárido extracelular.
El mecanismo de flotación de burbujas identificado por Maeda et al. se une a una serie de estrategias conocidas que permiten a las cianobacterias controlar su flotabilidad, como el uso de vesículas de gas o la acumulación de lastre de carbohidratos. Los pili tipo IV por sí solos también podrían controlar la posición de las cianobacterias marinas en la columna de agua al regular la resistencia viscosa. El polisacárido extracelular parece ser un activo multipropósito para las cianobacterias, desde un dispositivo de flotación hasta el almacenamiento de alimentos, un mecanismo de defensa y una ayuda para la movilidad.
Muerte celular
Uno de los procesos más críticos que determinan la ecofisiología de las cianobacterias es la muerte celular. La evidencia respalda la existencia de una muerte celular controlada en las cianobacterias, y se han descrito varias formas de muerte celular como respuesta al estrés biótico y abiótico. Sin embargo, la investigación de la muerte celular en cianobacterias es un campo relativamente joven y la comprensión de los mecanismos subyacentes y la maquinaria molecular que sustenta este proceso fundamental sigue siendo difícil de alcanzar. Sin embargo, los informes sobre la muerte celular de las cianobacterias marinas y de agua dulce indican que este proceso tiene implicaciones importantes para la ecología de las comunidades microbianas. Se han observado diferentes formas de muerte celular en las cianobacterias bajo varias condiciones estresantes, y se ha sugerido que la muerte celular juega un papel clave. en los procesos de desarrollo, como la diferenciación de acinetos y heterocistos.
Cianófagos
Los cianófagos son virus que infectan a las cianobacterias. Los cianófagos se pueden encontrar tanto en ambientes marinos como de agua dulce. Los cianófagos marinos y de agua dulce tienen cabezas icosaédricas, que contienen ADN de doble cadena, unidas a una cola por proteínas conectoras. El tamaño de la cabeza y la cola varía entre las especies de cianófagos. Los cianófagos, como otros bacteriófagos, se basan en el movimiento browniano para colisionar con las bacterias y luego usan las proteínas de unión al receptor para reconocer las proteínas de la superficie celular, lo que conduce a la adherencia. Los virus con colas contráctiles luego dependen de los receptores que se encuentran en sus colas para reconocer proteínas altamente conservadas en la superficie de la célula huésped.
Los cianofagos infectan una amplia gama de cianobacterias y son reguladores clave de las poblaciones de cianobacterias en ambientes acuáticos, y pueden ayudar a prevenir la proliferación de cianobacterias en ecosistemas marinos y de agua dulce. Estas floraciones pueden representar un peligro para los humanos y otros animales, particularmente en los lagos de agua dulce eutróficos. La infección por estos virus es muy frecuente en células pertenecientes a Synechococcus spp. en ambientes marinos, donde se ha informado que hasta el 5% de las células pertenecientes a células de cianobacterias marinas contienen partículas de fagos maduros.
El primer cianófago, LPP-1, se descubrió en 1963. Los cianófagos se clasifican dentro de las familias de bacteriófagos Myoviridae (por ejemplo, AS-1, N-1), Podoviridae (por ejemplo, LPP-1) y Siphoviridae (por ejemplo, S-1).
Movimiento
Desde hace tiempo se sabe que las cianobacterias filamentosas realizan movimientos superficiales y que estos movimientos son el resultado de pili tipo IV. Además, se sabe que Synechococcus, una cianobacteria marina, nada a una velocidad de 25 μm/s por un mecanismo diferente al de los flagelos bacterianos. Se cree que la formación de ondas en la superficie de las cianobacterias empuja el agua circundante hacia atrás. Se sabe que las células son móviles por un método de deslizamiento y un nuevo método de natación no fototáctico no caracterizado que no implica movimiento flagelar.
Muchas especies de cianobacterias son capaces de deslizarse. Deslizarse es una forma de movimiento celular que se diferencia de gatear o nadar en que no depende de ningún órgano externo obvio o cambio en la forma celular y ocurre solo en presencia de un sustrato. El deslizamiento en las cianobacterias filamentosas parece ser impulsado por un 'chorro de limo'. mecanismo, en el que las células extruyen un gel que se expande rápidamente a medida que se hidrata proporcionando una fuerza de propulsión, aunque algunas cianobacterias unicelulares utilizan pili tipo IV para deslizarse.
Las cianobacterias tienen estrictos requisitos de luz. Muy poca luz puede dar como resultado una producción de energía insuficiente y, en algunas especies, puede hacer que las células recurran a la respiración heterótrofa. Demasiada luz puede inhibir las células, disminuir la eficiencia de la fotosíntesis y causar daños por decoloración. La radiación ultravioleta es especialmente letal para las cianobacterias, y en algunos casos los niveles solares normales son significativamente perjudiciales para estos microorganismos.
Las cianobacterias filamentosas que viven en tapetes microbianos a menudo migran vertical y horizontalmente dentro del tapete para encontrar un nicho óptimo que equilibre sus requisitos de luz para la fotosíntesis con su sensibilidad al daño solar. Por ejemplo, las cianobacterias filamentosas Oscillatoria sp. y Spirulina subsalsa que se encuentran en las esteras bentónicas hipersalinas de Guerrero Negro, México, migran hacia las capas inferiores durante el día para escapar de la intensa luz solar y luego ascienden a la superficie al anochecer. Por el contrario, la población de Microcoleus chthonoplastes que se encuentran en los mantos hipersalinos de Camargue, Francia, migran a la capa superior del manto durante el día y se distribuyen homogéneamente por el manto durante la noche. Un experimento in vitro usando Phormidium uncinatum también demostró que esta especie' tendencia a migrar para evitar la radiación dañina. Estas migraciones suelen ser el resultado de algún tipo de fotomovimiento, aunque otras formas de taxis también pueden desempeñar un papel.
Las cianobacterias emplean el fotomovimiento, la modulación del movimiento celular en función de la luz incidente, como un medio para encontrar las condiciones óptimas de luz en su entorno. Hay tres tipos de fotomovimiento: fotocinesis, fototaxis y respuestas fotofóbicas.
Los microorganismos fotocinéticos modulan su velocidad de deslizamiento en función de la intensidad de la luz incidente. Por ejemplo, la velocidad con la que se desliza Phormidium autumnale aumenta linealmente con la intensidad de la luz incidente.
Los microorganismos fototácticos se mueven según la dirección de la luz dentro del entorno, de modo que las especies fototácticas positivas tenderán a moverse más o menos en paralelo a la luz y hacia la fuente de luz. Especies como Phormidium uncinatum no pueden dirigirse directamente hacia la luz, sino que dependen de colisiones aleatorias para orientarse en la dirección correcta, después de lo cual tienden a moverse más hacia la fuente de luz. Otros, como Anabaena variabilis, pueden dirigir doblando el tricoma.
Por último, los microorganismos fotofóbicos responden a gradientes de luz espaciales y temporales. Una reacción fotofóbica intensificada ocurre cuando un organismo ingresa a un campo de área más brillante desde uno más oscuro y luego invierte la dirección, evitando así la luz brillante. La reacción opuesta, llamada reacción de reducción, ocurre cuando un organismo ingresa a un área oscura desde un área brillante y luego invierte la dirección, permaneciendo así en la luz.
Evolución
Historia de la Tierra
Duración de la vida | ||||||||||||||||||||||||||||||||||||||||||||||
−4500 — – — – 4.000 - 4000 – — – −3500 – – — – −3000 – – — – −2500 — – — – −2000 - – — – −1500 — – — – 1000−1000 – — – .500 - 500 – — – 0 - | Agua Vida única Fotosíntesis Eukaryotes Vida multicelular Plantas Artropods Molluscs Flores Dinosaurios Mamíferos Aves Primados Hadean Archean Proterozoico Phanerozoic |
| ||||||||||||||||||||||||||||||||||||||||||||
(Hace millones de años) *Edades de hielo | ||||||||||||||||||||||||||||||||||||||||||||||
Los estromatolitos son estructuras acumulativas bioquímicas en capas formadas en aguas poco profundas por la captura, unión y cementación de granos sedimentarios por biopelículas (esteras microbianas) de microorganismos, especialmente cianobacterias.
Durante el Precámbrico, las comunidades de microorganismos estromatolíticos crecieron en la mayoría de los ambientes marinos y no marinos de la zona fótica. Después de la explosión de animales marinos en el Cámbrico, el pastoreo de las esteras de estromatolitos por parte de los herbívoros redujo en gran medida la aparición de estromatolitos en ambientes marinos. Desde entonces, se encuentran principalmente en condiciones hipersalinas donde los invertebrados que pastan no pueden vivir (por ejemplo, Shark Bay, Australia Occidental). Los estromatolitos proporcionan registros antiguos de vida en la Tierra mediante restos fósiles que datan de hace 3,5 Ga. A partir de 2010, la evidencia indiscutible más antigua de cianobacterias es de hace 2,1 Ga, pero hay alguna evidencia de que se remonta a hace 2,7 Ga. Las concentraciones de oxígeno en la atmósfera permanecieron alrededor o por debajo del 1% del nivel actual hasta hace 2,4 Ga (el Gran Evento de Oxigenación). El aumento de oxígeno puede haber causado una caída en la concentración de metano atmosférico y desencadenó la glaciación de Huronian hace alrededor de 2,4 a 2,1 Ga. De esta manera, las cianobacterias pueden haber acabado con gran parte de las otras bacterias de la época.
Los oncolitos son estructuras sedimentarias compuestas de oncoides, que son estructuras en capas formadas por el crecimiento de cianobacterias. Los oncolitos son similares a los estromatolitos, pero en lugar de formar columnas, forman estructuras aproximadamente esféricas que no estaban adheridas al sustrato subyacente cuando se formaron. Los oncoides a menudo se forman alrededor de un núcleo central, como un fragmento de caparazón, y los microbios incrustantes depositan una estructura de carbonato de calcio. Los oncolitos son indicadores de aguas cálidas en la zona fótica, pero también se conocen en ambientes de agua dulce contemporáneos. Estas estructuras rara vez superan los 10 cm de diámetro.
Un esquema de clasificación anterior de los fósiles de cianobacterias los dividía en porostromata y espongiostromata. Estos ahora se reconocen como taxones de forma y se consideran taxonómicamente obsoletos; sin embargo, algunos autores han defendido que los términos permanezcan de manera informal para describir la forma y estructura de los fósiles bacterianos.
Origen de la fotosíntesis
Por lo que sabemos, la fotosíntesis oxigénica solo evolucionó una vez (en las cianobacterias procariotas), y todos los eucariotas fotosintéticos (incluidas todas las plantas y algas) han adquirido esta capacidad de ellos. En otras palabras, todo el oxígeno que hace que la atmósfera sea respirable para los organismos aeróbicos proviene originalmente de las cianobacterias o de sus descendientes posteriores.
Las cianobacterias siguieron siendo los principales productores primarios a lo largo del Eón Proterozoico (2500–543 Ma), en parte porque la estructura redox de los océanos favorecía a los fotoautótrofos capaces de fijar nitrógeno. Las algas verdes se unieron a las verdeazuladas como los principales productores primarios en las plataformas continentales cerca del final del Proterozoico, pero solo con las radiaciones del Mesozoico (251–65 Ma) de dinoflagelados, cocolitofóridos y diatomeas, la producción primaria en las aguas marinas de la plataforma tomó una forma moderna. Las cianobacterias siguen siendo críticas para los ecosistemas marinos como productores primarios en los giros oceánicos, como agentes de fijación biológica de nitrógeno y, en forma modificada, como plástidos de algas eucariotas marinas.
Origen de los cloroplastos
Los cloroplastos primarios son orgánulos celulares que se encuentran en algunos linajes eucariotas, donde se especializan en realizar la fotosíntesis. Se considera que han evolucionado a partir de cianobacterias endosimbióticas. Después de algunos años de debate, ahora se acepta generalmente que los tres grupos principales de eucariotas endosimbióticos primarios (es decir, plantas verdes, algas rojas y glaucofitas) forman un gran grupo monofilético llamado Archaeplastida, que evolucionó después de un evento endosimbiótico único.
La similitud morfológica entre los cloroplastos y las cianobacterias fue reportada por primera vez por el botánico alemán Andreas Franz Wilhelm Schimper en el siglo XIX. Los cloroplastos solo se encuentran en plantas y algas, allanando así el camino para que el biólogo ruso Konstantin Mereschkowski sugiriera en 1905 el origen simbiogénico de el plástido. Lynn Margulis llamó la atención sobre esta hipótesis más de 60 años después, pero la idea no se aceptó por completo hasta que comenzaron a acumularse datos complementarios. El origen cianobacteriano de los plástidos ahora está respaldado por varias pruebas filogenéticas, genómicas, bioquímicas y estructurales. La descripción de otro evento de endosimbiosis primaria independiente y más reciente entre una cianobacteria y un linaje eucariota separado (el rhizarian Paulinella chromatophora) también da credibilidad al origen endosimbiótico de los plástidos.
Además de esta endosimbiosis primaria, muchos linajes eucariotas han estado sujetos a eventos endosimbióticos secundarios o incluso terciarios, es decir, el "tipo Matryoshka" absorción por un eucariota de otro eucariota portador de plástidos.
Los cloroplastos tienen muchas similitudes con las cianobacterias, incluido un cromosoma circular, ribosomas de tipo procariótico y proteínas similares en el centro de reacción fotosintético. La teoría endosimbiótica sugiere que las bacterias fotosintéticas fueron adquiridas (por endocitosis) por las primeras células eucariotas para formar las primeras células vegetales. Por lo tanto, los cloroplastos pueden ser bacterias fotosintéticas que se adaptaron a la vida dentro de las células vegetales. Al igual que las mitocondrias, los cloroplastos aún poseen su propio ADN, separado del ADN nuclear de las células huésped de la planta, y los genes en este ADN del cloroplasto se asemejan a los de las cianobacterias. El ADN en los cloroplastos codifica proteínas redox como los centros de reacción fotosintéticos. La hipótesis CoRR propone que esta ubicación conjunta es necesaria para la regulación redox.
Orígenes marinos
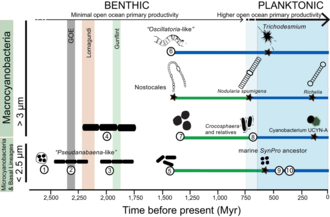
Las cianobacterias han transformado fundamentalmente la geoquímica del planeta. Múltiples líneas de evidencia geoquímica respaldan la ocurrencia de intervalos de cambios ambientales globales profundos al comienzo y al final del Proterozoico (2500–542 Mya). Si bien es ampliamente aceptado que la presencia de oxígeno molecular en el registro fósil temprano fue el resultado de la actividad de las cianobacterias, se sabe poco sobre cómo la evolución de las cianobacterias (por ejemplo, la preferencia de hábitat) puede haber contribuido a los cambios en los ciclos biogeoquímicos a lo largo de la historia de la Tierra. La evidencia geoquímica ha indicado que hubo un primer aumento en la oxigenación de la superficie de la Tierra, que se conoce como el Gran Evento de Oxidación (GOE), a principios del Paleoproterozoico (2500–1600 Mya). Un segundo pero mucho más pronunciado aumento en los niveles de oxígeno, conocido como el Evento de Oxigenación Neoproterozoico (NOE), ocurrió alrededor de 800 a 500 Mya. Los datos recientes de isótopos de cromo apuntan a niveles bajos de oxígeno atmosférico en la superficie de la Tierra durante el Proterozoico medio, lo que es consistente con la evolución tardía de las cianobacterias planctónicas marinas durante el Criogénico; ambos tipos de evidencia ayudan a explicar la aparición tardía y la diversificación de los animales.
Comprender la evolución de las cianobacterias planctónicas es importante porque su origen transformó fundamentalmente los ciclos del nitrógeno y el carbono hacia el final del Precámbrico. Sin embargo, no está claro qué eventos evolutivos llevaron a la aparición de formas planctónicas en mar abierto dentro de las cianobacterias y cómo estos eventos se relacionan con la evidencia geoquímica durante el Precámbrico. Hasta ahora, parece que la geoquímica oceánica (p. ej., las condiciones euxínicas durante el Proterozoico temprano y medio) y la disponibilidad de nutrientes probablemente contribuyeron al aparente retraso en la diversificación y la colonización generalizada de los ambientes de mar abierto por cianobacterias planctónicas durante el Neoproterozoico.
Genética
Las cianobacterias son capaces de una transformación genética natural. La transformación genética natural es la alteración genética de una célula resultante de la captación e incorporación directa de ADN exógeno de su entorno. Para que tenga lugar la transformación bacteriana, la bacteria receptora debe estar en un estado de competencia, lo que puede ocurrir en la naturaleza como respuesta a condiciones tales como inanición, alta densidad celular o exposición a agentes que dañan el ADN. En la transformación cromosómica, el ADN transformante homólogo puede integrarse en el genoma receptor mediante recombinación homóloga, y este proceso parece ser una adaptación para reparar el daño del ADN.
Reparación de ADN
Las cianobacterias se ven desafiadas por el estrés ambiental y las especies reactivas de oxígeno generadas internamente que causan daños en el ADN. Las cianobacterias poseen numerosos E. coli-como los genes de reparación del ADN. Varios genes de reparación del ADN están altamente conservados en las cianobacterias, incluso en genomas pequeños, lo que sugiere que los procesos de reparación del ADN central, como la reparación por recombinación, la reparación por escisión de nucleótidos y la reparación de desajustes de ADN dirigidos por metilo, son comunes entre las cianobacterias.
Clasificación
Filogenia
| 16S rRNA basado en LTP_12_2021 | GTDB 07-RS207 por Genome Taxonomy Database | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Taxonomía
Históricamente, las bacterias se clasificaron primero como plantas que constituyen la clase Schizomycetes, que junto con las Schizophyceae (algas verdeazuladas/cianobacterias) formaron el phylum Schizophyta, luego en el phylum Monera en el reino Protista por Haeckel en 1866, que comprende Protogens, Protamaeba, Vampyrella, Protomonae y Vibrio, pero no Nostoc y otras cianobacterias, que se clasificaron con las algas, luego reclasificadas como Procariontes de Chatton.
Las cianobacterias se clasificaban tradicionalmente por morfología en cinco secciones, a las que se hace referencia con los números I–V. Los primeros tres, Chroococcales, Pleurocapsales y Oscillatoriales, no están respaldados por estudios filogenéticos. Los dos últimos, Nostocales y Stigonematales, son monofiléticos y forman las cianobacterias heterocistas.
Los miembros de Chroococales son unicelulares y generalmente se agregan en colonias. El criterio taxonómico clásico ha sido la morfología celular y el plano de división celular. En Pleurocapsales, las células tienen la capacidad de formar esporas internas (baeocitos). El resto de las secciones incluyen especies filamentosas. En Oscillatoriales, las células están dispuestas uniseriadamente y no forman células especializadas (akinetes y heterocistos). En Nostocales y Stigonematales, las células tienen la capacidad de desarrollar heterocistos en ciertas condiciones. Stigonematales, a diferencia de Nostocales, incluye especies con tricomas verdaderamente ramificados.
La mayoría de los taxones incluidos en el filo o división Cyanobacteria aún no han sido publicados válidamente bajo el Código Internacional de Nomenclatura de Procariotas (ICNP), excepto:
- Las clases Croobacteria, Hormogoneae y Gloeobacteria
- Las órdenes Chroococcales, Gloeobacterales, Nostocales, Oscillatoriales, Pleurocapsales y Stigonematales
- Las familias Prochloraceae y Prochlorotrichaceae
- Los géneros Halospirulina, Planktothricoides, Prochloroccus, Prochloron, y Prochlorothrix
El resto están válidamente publicados bajo el Código Internacional de Nomenclatura para algas, hongos y plantas.
Anteriormente, se pensaba que algunas bacterias, como Beggiatoa, eran cianobacterias incoloras.
La taxonomía actualmente aceptada se basa en la Lista de nombres procarióticos con posición en la nomenclatura (LPSN) y el Centro Nacional de Información Biotecnológica (NCBI). Clase "Cianobacterias"
- Subclase Gloeobacteria
- Gloeobacterales Cavalier-Smith 2002
- Subclase Phycobacteria
- "Elainellales"
- "Eurycoccales"
- Gloeoemargaritales Moreira et al. 2016
- "Leptolyngbyales"
- "Neosynechococcales"
- "Phormidesmiales"
- Prochlorococcaceae Komárek & Strunecky 2020 [PCC-6307]
- Pseudanabaenales Hoffmann, Komárek " Kastovsky 2005
- Termostichales Komárek & Strunecký 2020
- "Thermosynechococcales"
- Nostocophycidae
- Cyanobacteriales Rippka " Cohen-Bazire 1983 (Chamaesiphonales, Chroococcales, Chroococcidiopsidales, Nostocales, Oscillatoriales, Pleurocapsales, Spirulinales, Stigonematales)
- Synechococcophycidae
- "Limnotrichales"
- Prochlorotrichaceae Burger-Wiersma et al. 1989 {PCC-9006}
- Synechococcales Hoffmann, Komárek " Kastovsky 2005
Relación con los humanos
Biotecnología
La cianobacteria unicelular Synechocystis sp. PCC6803 fue el tercer organismo procariota y primer organismo fotosintético cuyo genoma fue completamente secuenciado. Sigue siendo un organismo modelo importante. Cyanothece ATCC 51142 es un importante organismo modelo diazotrófico. Los genomas más pequeños se han encontrado en Prochlorococcus spp. (1,7 Mb) y la mayor en Nostoc punctiforme (9 Mb). Las de Calothrix spp. se estiman en 12–15 Mb, tan grandes como la levadura.
Investigaciones recientes han sugerido la posible aplicación de las cianobacterias a la generación de energía renovable mediante la conversión directa de la luz solar en electricidad. Las vías fotosintéticas internas pueden acoplarse a mediadores químicos que transfieren electrones a electrodos externos. A más corto plazo, se están realizando esfuerzos para comercializar combustibles a base de algas, como el diésel, la gasolina y el combustible para aviones. Las cianobacterias también se han diseñado para producir etanol y los experimentos han demostrado que cuando se sobreexpresan uno o dos genes CBB, el rendimiento puede ser incluso mayor.
Las cianobacterias pueden poseer la capacidad de producir sustancias que algún día podrían servir como agentes antiinflamatorios y combatir infecciones bacterianas en humanos. Se ha demostrado que la producción fotosintética de azúcar y oxígeno de las cianobacterias tiene valor terapéutico en ratas con ataques cardíacos. Si bien las cianobacterias pueden producir naturalmente varios metabolitos secundarios, pueden servir como anfitriones ventajosos para la producción de metabolitos derivados de plantas debido a los avances biotecnológicos en biología de sistemas y biología sintética.
El color azul extraído de la espirulina se utiliza como colorante alimentario natural.
Investigadores de varias agencias espaciales argumentan que las cianobacterias podrían usarse para producir bienes para el consumo humano en futuros puestos tripulados en Marte, mediante la transformación de los materiales disponibles en este planeta.
Nutrición humana
Algunas cianobacterias se venden como alimento, en particular Arthrospira platensis (Spirulina) y otras (Aphanizomenon flos-aquae).
Algunas microalgas contienen sustancias de alto valor biológico, como ácidos grasos poliinsaturados, aminoácidos, proteínas, pigmentos, antioxidantes, vitaminas y minerales. Las algas verdeazuladas comestibles reducen la producción de citocinas proinflamatorias al inhibir la vía NF-κB en macrófagos y esplenocitos. Los polisacáridos de sulfato exhiben actividad inmunomoduladora, antitumoral, antitrombótica, anticoagulante, antimutagénica, antiinflamatoria, antimicrobiana e incluso antiviral contra el VIH, el herpes y la hepatitis.
Riesgos para la salud
Algunas cianobacterias pueden producir neurotoxinas, citotoxinas, endotoxinas y hepatotoxinas (por ejemplo, las bacterias productoras de microcistina del género microcystis), que se conocen colectivamente como cianotoxinas.
Las toxinas específicas incluyen anatoxina-a, guanitoxina, aplisiatoxina, cianopeptolina, cilindrospermopsina, ácido domoico, nodularina R (de Nodularia), neosaxitoxina y saxitoxina. Las cianobacterias se reproducen explosivamente bajo ciertas condiciones. Esto da como resultado la proliferación de algas que pueden volverse dañinas para otras especies y representar un peligro para los humanos y los animales si las cianobacterias involucradas producen toxinas. Se han documentado varios casos de intoxicación humana, pero la falta de conocimiento impide una evaluación precisa de los riesgos, y la investigación de Linda Lawton, FRSE en la Universidad Robert Gordon, Aberdeen y colaboradores tiene 30 años de examinar el fenómeno y los métodos para mejorar la seguridad del agua..
Estudios recientes sugieren que una exposición significativa a altos niveles de toxinas productoras de cianobacterias como BMAA puede causar esclerosis lateral amiotrófica (ELA). Las personas que viven a menos de media milla de lagos contaminados con cianobacterias han tenido un riesgo 2,3 veces mayor de desarrollar ELA que el resto de la población; las personas alrededor del lago Mascoma de New Hampshire tenían un riesgo de ELA hasta 25 veces mayor que la incidencia esperada. El BMAA de las costras del desierto que se encuentran en todo Qatar podría haber contribuido a tasas más altas de ELA en los veteranos de la Guerra del Golfo.
Control químico
Varios productos químicos pueden eliminar las floraciones de cianobacterias de los sistemas acuáticos más pequeños, como las piscinas. Incluyen hipoclorito de calcio, sulfato de cobre, cupricida y simazina. La cantidad necesaria de hipoclorito de calcio varía según la proliferación de cianobacterias, y se necesita tratamiento periódicamente. Según el Departamento de Agricultura de Australia, una dosis de 12 g de material al 70 % en 1000 L de agua suele ser eficaz para tratar una floración. El sulfato de cobre también se usa comúnmente, pero el Departamento de Agricultura de Australia ya no lo recomienda, ya que mata ganado, crustáceos y peces. El cupricida es un producto de cobre quelatado que elimina las floraciones con menores riesgos de toxicidad que el sulfato de cobre. Las dosis recomendadas varían de 190 mL a 4,8 L por 1000 m2. Los tratamientos con alumbre férrico a razón de 50 mg/L reducirán la proliferación de algas. Simazine, que también es un herbicida, seguirá matando las flores durante varios días después de la aplicación. Simazine se comercializa en diferentes concentraciones (25, 50 y 90 %), la cantidad recomendada necesaria para un metro cúbico de agua por producto es 25 % de producto 8 mL; 50% producto 4 mL; o 90% producto 2.2 mL.
Cambio climático
Es probable que el cambio climático aumente la frecuencia, la intensidad y la duración de las floraciones de cianobacterias en muchos lagos, embalses y estuarios eutróficos. Las cianobacterias que forman flores producen una variedad de neurotoxinas, hepatotoxinas y dermatotoxinas, que pueden ser fatales para las aves y los mamíferos (incluidas las aves acuáticas, el ganado y los perros) y amenazan el uso de las aguas para la recreación, la producción de agua potable, el riego agrícola y la pesca. Las cianobacterias tóxicas han causado importantes problemas en la calidad del agua, por ejemplo, en el lago Taihu (China), el lago Erie (EE. UU.), el lago Okeechobee (EE. UU.), el lago Victoria (África) y el mar Báltico.
El cambio climático favorece la proliferación de cianobacterias tanto directa como indirectamente. Muchas cianobacterias que forman flores pueden crecer a temperaturas relativamente altas. El aumento de la estratificación térmica de lagos y embalses permite que las cianobacterias flotantes floten hacia arriba y formen densas floraciones superficiales, lo que les da un mejor acceso a la luz y, por lo tanto, una ventaja selectiva sobre los organismos de fitoplancton no flotantes. Las sequías prolongadas durante el verano aumentan los tiempos de residencia del agua en embalses, ríos y estuarios, y estas aguas cálidas estancadas pueden proporcionar las condiciones ideales para el desarrollo de la proliferación de cianobacterias.
La capacidad del género de cianobacterias dañinas Microcystis para adaptarse a niveles elevados de CO2 se demostró en experimentos de laboratorio y de campo. Microcystis spp. absorben CO2 y HCO3− y acumulan carbono inorgánico en los carboxisomas, y se descubrió que la competitividad de las cepas depende de la concentración de carbono inorgánico. Como resultado, se espera que el cambio climático y el aumento de los niveles de CO2 afecten la composición de las cepas de las floraciones de cianobacterias.
Galería
Video – Oscillatoria y Gleocapsa – con movimiento oscilatorio como filamentos Oscillatoria oriente hacia la luz
Contenido relacionado
Euglenozoa
Academias Nacionales de Ciencias, Ingeniería y Medicina
Delfín



















![Cyanobacterial remains of an annulated tubular microfossil Oscillatoriopsis longa [172] Scale bar: 100 μm](https://upload.wikimedia.org/wikipedia/commons/thumb/3/38/Oscillatoriopsis_longa_fossil.jpg/217px-Oscillatoriopsis_longa_fossil.jpg)







